表皮生长因子受体表达水平与甲状腺乳头状癌疾病进展的相关性的meta分析
朱玉娇 李玥 宋守君 薛海波
滨州医学院附属医院内分泌科,山东 256603
原发性甲状腺癌占所有恶性肿瘤的1%,为我国排名第7位的常见恶性肿瘤,在女性常见恶性肿瘤中排第3位[1-3]。最常见的甲状腺恶性肿瘤为甲状腺乳头状癌(papillary thyroid carcinoma,PTC),占甲状腺癌的80%~85%[4]。近几十年来PTC的发病率在世界范围内迅速上升[5]。虽然PTC病理类型分化良好,生长缓慢,恶性程度低,但具有多中心的发生趋势,早期可能出现颈部淋巴结转移等特征[6]。目前针对此类肿瘤的防治研究已成为本领域的热点。表皮生长因子受体(epidermal growth factor receptor,EGFR)属于酪氨酸激酶ErbB家族,这些跨膜蛋白在与EGF家族的肽生长因子结合后被激活并发挥作用[7]。研究发现EGFR在许多癌症中存在过度表达或突变,特别是在乳腺癌、卵巢癌和非小细胞肺癌中,它的过度表达及激活与预后差、耐药、肿瘤转移和低生存率有关,但EGFR与PTC临床特征的关系尚未明确[8]。为此,本研究通过数据库检索相关文献并进行meta分析,以明确EGFR表达水平与PTC淋巴结转移、远处转移、临床分期等临床特征的相关性,以指导临床预后判断及药物选择。
1 资料与方法
1.1 检索策略及数据库选择使用计算机搜索数据库:PubMed、Medline、Cochrane图书馆、SinoMed、Embase、中国知网数据库(CNKI)、万方数据库、维普数据库,对2020年10月之前发表的论文进行系统检索。语种限定为中英文,搜索使用医学主题词及关键词进行手动搜索及参考回溯:中文“表皮生长因子受体”“甲状腺乳头状癌”“淋巴结转移”“远处转移”“肿瘤长径”“临床分期”,英文“EGFR”“epidermal growth factor receptor”“papillary thyroid carcinoma”“lymph node”“distant metastasis”“tumor diameter”“clinical stage”。同时对检索到的文章的参考列表进行审查,以确定其他研究。
1.2 文献选择标准
1.2.1 纳入标准(1)国内外公开发表的关于EGFR、PTC及淋巴结转移、远处转移、临床分期等的一次性文献;(2)文献研究方法均为病例-对照研究并分析EGFR与PTC临床特征相关性;(3)纳入的患者均行手术治疗,并且术后病理明确诊断为PTC,性别、国籍、疾病严重程度不限;(4)EGFR检测方法不受限;(5)纳入文献的数据均有全文可供提取。
1.2.2 排除标准(1)重复发表的文献及论文;(2)个案报道、系统评价、会议报告、综述、动物实验等;(3)实验设计及统计方法不严谨;(4)无可用数据及非病例-对照研究的文献;(5)细针穿刺活检抽取组织的文献;(6)文献研究对象有其他恶性肿瘤疾病史。
1.3 数据的提取与质量评价由2名研究者独立检索、阅读相关文献并交叉核对数据,剔除不合格及不相关文献,若有分歧,可征求第3名研究者的意见。提取文献数据包括:第一作者姓名、发表时间、国家、样本量、EGFR表达情况及淋巴结转移、肿瘤长径、远处转移、临床分期等临床特征信息等。质量评价采用纽卡斯尔-渥太华量表(NOS):包括研究人群的选择(4分)、组间可比性(2分)和暴露因子的测定(3分),三者相加得出NOS评分。
1.4 统计学方法对所提取的数据应用RevMan 5.3及STATA 12.0进行meta分析。根据meta分析的要求提取数据、建立数据库,对EGFR高表达组及低表达组中PTC患者临床特征(性别、淋巴结转移、远处转移、肿瘤长径、临床分期)比较进行meta分析。对所选二分类变量采用比值比(OR)及其95%置信区间(CI)来表示(P<0.05为差异有统计学意义),分析结果用森林图表示。采用I²进行异质性检验:若P>0.1且I²<50%,考虑异质性较低,采用固定效应模型;若P<0.1且I²>50%,考虑异质性较高,采用随机效应模型。通过剔除单个研究并观察对合并效应量的影响进行敏感性分析,并采用Begg检验纳入文献的发表偏倚情况。
2 结 果
2.1 文献检索结果在数据库中使用检索词检索,共检索到298篇文献,剔除重复文献80篇,通过阅读文献标题及摘要排除不相干文献127篇,通过按照纳入及排除标准仔细阅读全文,剔除无可用数据62篇,排除非病例对照研究22篇,最终共纳入7篇文章,其中1篇中文文献、6篇英文文献。根据NOS评分标准,总分范围为0~9分,得分≥6分相当于高质量文献。该7篇纳入的病例对照研究评分在6~9分,纳入的文献质量较可靠,见图1、表1。

表1 纳入研究的7篇文献的基本情况

图1 文献筛选流程及结果
2.2 meta分析结果
2.2.1 EGFR与PTC患者性别的相关性对来自6项研究的597例PTC患者进行了分析,结果显示OR值为0.95,95%CI为0.63~1.43,效应量检验提示:Z=0.27,P=0.79,森林图显示其OR的95%CI落在森林图垂直线上,这些数据显示EGFR表达水平与PTC患者性别之间无相关性,见图2。

图2 表皮生长因子受体与甲状腺乳头状癌患者性别之间的关系
2.2.2 EGFR与PTC患者淋巴结转移的相关性纳入7篇文章进行meta分析,共涉及636例PTC患者。其中370例EGFR高表达患者中181例(48.9%)出现淋巴结转移,266例EGFR低表达患者中58例(21.8%)出现淋巴结转移。meta分析显示,OR=4.88,95%CI为3.29~7.24,整体效果检验Z=7.86,P<0.000 01,其OR的95%CI落在森林图的右边,表明EGFR高表达与PTC患者淋巴结转移存在明显相关性,EGFR的高表达可能促进了PTC淋巴结转移,见图3。
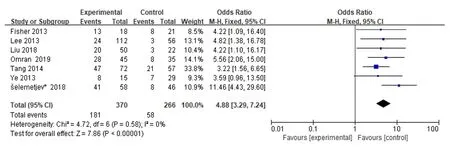
图3 表皮生长因子受体与甲状腺乳头状癌患者淋巴结转移的关系
2.2.3 EGFR与PTC肿瘤长径的相关性其中2项研究分析了EGFR与PTC患者肿瘤长径之间的关系,根据原发病肿瘤的大小分为<2.3 cm组和≥2.3 cm组,meta分析显示OR为2.23(95%CI:1.25~3.98),在森林图中OR的95%CI置于垂直线的右侧(总效应量检验:Z=2.72,P=0.007),表明EGFR高表达与PTC患者肿瘤大小存在相关性,见图4。
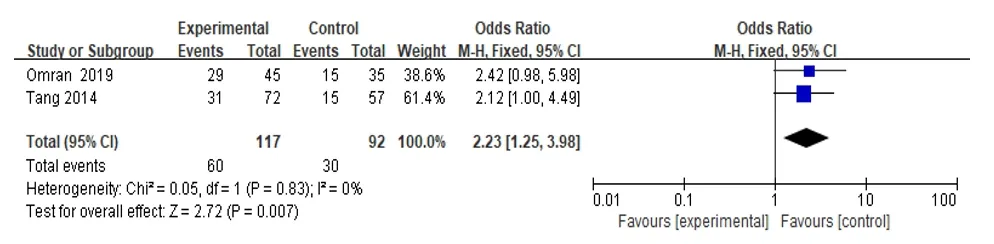
图4 表皮生长因子受体与甲状腺乳头状癌患者肿瘤长径之间的关系
2.2.4 EGFR与PTC患者远处转移的相关性7项研究中有2项研究分析了EGFR与PTC患者远处转移的关系,meta分析结果显示,OR为4.12(95%CI:1.52~11.19),OR的95%CI位于森林地图垂直线的右侧(总体效果测试中Z=2.78,P=0.005),提示EGFR高表达与PTC患者远处转移有明显的相关性,见图5。

图5 表皮生长因子受体与甲状腺乳头状癌患者远处转移之间的关系
2.2.5 EGFR与PTC患者临床分期的相关性对纳入的4项研究进行了meta分析,并根据临床分期分为两组,一组为Ⅰ、Ⅱ期,另一组为Ⅲ、Ⅳ期。结果显示,OR=2.30(95%CI:1.47~3.60),OR的95%CI位于森林地图垂直线的右侧(Z=3.66,P=0.000 2)。上述分析结果提示,EGFR表达水平与PTC患者临床分期存在明显相关性,EGFR的过度表达可能促进PTC的侵袭、生长或转移,见图6。
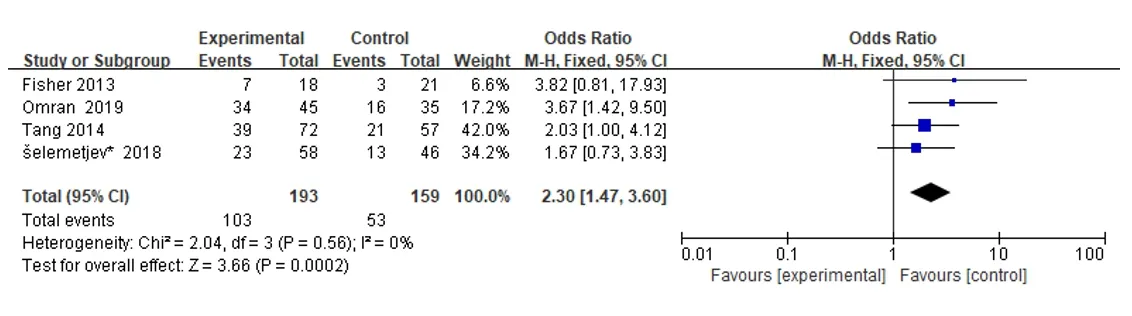
图6 表皮生长因子受体与甲状腺乳头状癌患者临床分期之间的关系
2.3 发表偏倚检测与敏感性分析以淋巴结转移、临床分期、性别为效应指标对meta分析纳入的文献进行Begg检测,各检测结果Pr>|Z|>0.05(continuity corrected),结果均提示各文献无发表偏倚。通过分别剔除单个研究进行敏感性分析,结果发现在逐一剔除单个研究后异质性(I²)无明显变化,且方向与之前未发生变化,提示上述结果基本可靠。
3 讨 论
表皮生长因子受体家族(HER)由4种同源跨膜蛋白构成,包括EGFR/HER1/ErbB1、HER2/ErbB2、HER3/ErbB3和HER4/ErbB4。其中EGFR属于酪氨酸激酶受体(RTK),它由一个具有激酶活性的C端胞内区和一个N端胞外配体结合位点(一个疏水性跨膜结构域)组成[16]。EGFR是一种横跨细胞膜的受体蛋白,它在细胞表面被EGF诱导形成二聚体,从而激活其酪氨酸激酶活性造成受体反磷酸化。EGFR的酪氨酸自磷酸化位点与下游的信号蛋白形成大的信号复合物,这种复合物可以促进各种信号通路(如PI3K/AKT/mTOR、RAS/RAF/MEK1/ERK1/2)的激活,最终造成细胞的增殖、分化、凋亡、迁移等不同的生物学反应,甚至可以造成细胞的侵袭性。在高达30%的实体瘤(包括乳腺癌、结直肠癌、肺癌、胰腺癌、胃癌、头颈癌和胶质母细胞瘤)中EGFR均有表达,而它的过度表达和激活突变通常与预后不良相关[8,17]。
PTC是预后较好的内分泌肿瘤,虽然PTC患者中的大多数不会出现临床复发,但仍有部分PTC患者的临床过程是不可预测的,往往死于局部复发或淋巴结等转移性疾病。因此,确定PTC患者预后差的高危因素非常重要,但目前尚缺乏相对特异性的指标来调整监测和准确评估预后,所以有必要进行能够预测肿瘤细胞侵袭性标志物的探索[18]。既往已有研究发现EGFR在PTC、甲状腺滤泡状癌、间变性甲状腺癌中均有表达。体外试验研究证实,使用抗EGFR抗体和EGFR酪氨酸激酶小分子抑制剂AG1478通过抑制EGFR而对甲状腺癌细胞株起到了抗增殖作用[19-20]。Kim等[21]研究报道,使用EGFR酪氨酸激酶抑制剂AEE788对体外培养的间变性甲状腺癌细胞具有抑制细胞增殖和诱导凋亡的作用。然而,临床研究的结果存在一定差异。有些临床研究证实EGFR高表达能促进甲状腺癌浸润性,而另有研究发现高表达的EGFR与甲状腺乳头状微小癌的淋巴侵袭和淋巴结转移呈负相关[22]。因此,鉴于目前研究结果的不一致性,有必要运用meta分析方法将此类研究数据进行汇总分析评价。
本研究中最终纳入了7篇病例-对照研究,涉及636例PTC患者。meta分析结果显示,EGFR高表达是PTC淋巴结转移(OR=4.88,95%CI:3.29~7.24;合并效应量检验,Z=7.86,P<0.000 01)、远 处 转 移(OR=4.12,95%CI:1.52~11.19;合并效应量检验,Z=2.78,P=0.005)、肿瘤增大(OR:2.23,95%CI:1.25~3.98;合 并效 应 量 检 验,Z=2.72,P=0.007)及高临床分期(OR=2.30,95%CI:1.47~3.60;合并效应量检验,Z=3.66,P=0.000 2)的危险因素。但是并没有发现EGFR与性别之间相关性(P=0.79)。这提示EGFR的过度表达可能在PTC肿瘤生长、淋巴结及远处转移、临床分期等方面发挥着重要作用,参与了PTC疾病进展的过程。因此,EGFR表达水平对PTC患者预后的判断具有一定的临床意义,进而指导靶向治疗药物的选择。
早期、高分化型甲状腺癌多数可以治愈,晚期、低分化或未分化患者大多数行姑息治疗,分子靶向治疗的出现俨然为当前和未来临床需求提供了潜在的甲状腺癌治疗策略。目前多激酶酪氨酸激酶抑制剂(TKIs)等靶向药物治疗甲状腺癌成为研究热点。索拉非尼是第1个进行Ⅲ期临床试验的TKIs,并于2013年被美国食品药品监督管理局(FDA)批准用于治疗转移性难治性分化型甲状腺癌(DTC)。乐伐替尼完成了在放射性碘(RAI)难治性DTC患者中进行的Ⅲ期临床研究,并于2015年被FDA批准用于RAI耐药转移性DTC。Kim等[23]进一步研究发现,乐伐替尼和索拉非尼交替对难治性甲状腺癌治疗效果较好。亦有报道称EGFR在甲状腺癌中过度表达显著高于其他类型的癌症[24]。关于对EGFR的靶向药物如嵌合单克隆抗体(帕尼妥单抗和西妥昔单抗等)和EGFR-TKIs(吉非替尼、厄洛替尼)对甲状腺癌治疗的相关研究也相继报道。有研究显示在转移性间变性甲状腺癌小鼠模型中使用EGFR和组蛋白去乙酰化酶(HDAC)的双重抑制剂CUDC-101发现可以抑制肿瘤生长和转移,并显著延长生存期[25]。Schiff等[26]研究发现,吉非替尼单独和紫杉醇联合应用能够降低裸鼠甲状腺癌细胞模型中癌细胞的生长。Wang等[27]将EGFR靶向单克隆抗体西妥昔单抗(C225)联合10-羟基喜树碱(10-HCPT)结合在纳米颗粒表面,利用低强度聚焦超声聚焦甲状腺组织,在间变性甲状腺癌裸鼠体内抑制了肿瘤生长。在应用相关靶向等药物治疗后是否会降低PTC患者的侵袭性,从而提高患者的生存率仍需要进一步的深入研究。
由于本研究最终纳入的相关研究相对较少,并且尚缺乏高质量的随机对照试验研究,尚未能针对PTC其他相关临床特征,如甲状腺浸润、血管钙化、组织学亚型、肿瘤复发率等情况进行分析,存在一定的局限性。未来期待有更多的高质量随机对照试验研究的完成并进一步明确EGFR表达水平与PTC相关临床特征之间的关系,为PTC预后及防治提供新的治疗靶点。

