替加环素与5种抗菌药物对耐左氧氟沙星嗜麦芽窄食单胞菌的体外药敏试验及联合药敏试验
尉景娟 马立艳 苏建荣
(首都医科大学附属北京友谊医院临床检验中心,北京 100050)
嗜麦芽窄食单胞菌(Stenotrophomonasmaltophilia, SMA)是近年来导致医院内感染较常见的多重耐药革兰阴性杆菌。在医院血流感染中,是最常见的碳青霉烯耐药的致病菌之一[1]。由于SMA的固有耐药及获得性耐药基因的增加,使β-内酰胺类等一线抗菌药物的治疗无效[2]。替加环素是甘氨酰环素类抗菌药物,抗菌谱广且活性强。替加环素在国内上市后,微生物实验室使用的美国临床和实验室标准协会(Clinical and Laboratory Standard Institute, CLSI)标准[3]针对SMA没有提供替加环素的体外药敏试验折点判读标准。本研究借用美国食品药品监督局(Food and Drug Administration, FDA)和中国国家药品监督管理局(National Medical Products Administration, NMPA)中替加环素对肠杆菌科细菌的体外药敏试验折点[4],评估替加环素对耐药SMA体外药敏及联合用药情况,为临床使用替加环素治疗耐药SMA感染提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株
收集首都医科大学附属北京友谊医院2018年7月至2020年7月临床分离培养的对左氧氟沙星耐药的SMA共33株,全部经基质辅助激光解吸电离飞行时间质谱分析(MALDI-TOF MS)鉴定。其中对左氧氟沙星耐药的菌株17株,对左氧氟沙星和复方新诺明耐药的菌株11株,对左氧氟沙星、复方新诺明及米诺环素均耐药的菌株5株。菌株来源于外周血培养7株(21.2%),导管培养7株(21.2%),尿液培养12株(36.4%),肺泡灌洗液培养4株(12.1%),胆汁培养3株(9.1%)。
1.1.2 培养基及抗菌药物
药敏试验使用的阳离子调节Mueller-Hinton肉汤为英国Oxoid公司商品。抗菌药物粉剂左氧氟沙星、复方新诺明(sulfamethoxazole-trimethoprim,SXT)、米诺环素、替加环素、头孢他啶、头孢哌酮-舒巴坦为国家卫生健康委食品药品鉴定所标准品。
1.2 方法
1.2.1 微量肉汤稀释法
采用微量肉汤稀释法对33株SMA进行6种抗生素药物的最低抑菌浓度(minimum inhibitory concentration, MIC)测定。其中左氧氟沙星、复方新诺明、米诺环素及头孢他啶按照美国临床和实验室标准化协会(CLSI)2020年M100-30th推荐的抗生素选择和折点试验及判读结果[3]。替加环素根据中国医疗保健国际交流促进会临床微生物与感染分会等推荐的FDA及NMPA的折点试验及判读结果[4],其对肠杆菌科细菌的抗生素折点:≤2 μg/mL为敏感,≥8 μg/mL为耐药。头孢哌酮-舒巴坦为本院临床常用针对革兰阴性杆菌感染的抗生素,在本试验中未提供折点及判读结果。大肠埃希菌ATCC25922和铜绿假单胞菌ATCC27853作为本试验的质控菌株。
1.2.2 棋盘式微量肉汤稀释法
使用棋盘式微量肉汤稀释法检测联合药敏。联合药敏组合为替加环素分别联合左氧氟沙星、复方新诺明、米诺环素、头孢他啶、头孢哌酮-舒巴坦。棋盘法测试药物浓度范围包括替加环素1/8 MIC~8 MIC浓度,左氧氟沙星、复方新诺明、米诺环素和头孢他啶为1/32 MIC~32 MIC浓度,头孢哌酮-舒巴坦为0.125 μg/mL~128 μg/mL。以新鲜牛肉汤为培养基,将7个浓度梯度的替加环素50 μL加至96孔板的A~G行,H行作为生长对照。其他11个浓度梯度的抗生素50 μL加入1~11列,第12列作为生长对照。取新鲜SMA菌落制备1.5×108CFU/mL菌悬液,Mueller-Hinton肉汤将菌液1∶1 000稀释,每孔中加入100 μL菌液,密封后35 ℃普通空气孵育箱内孵育20 h 后判读结果。
1.2.3 结果判读
微量肉汤稀释法的结果评价:孔内能够完全抑制SMA的最低药物浓度为MIC。阳性对照孔内出现细菌的明显生长,说明试验有效,若出现跳孔现象,需重复试验。药敏结果判读标准依据CLSI M100-30th[3]。
联合药敏需记录单独使用替加环素及其他单独药物的MIC,包括MICA单药和MICB单药,并选择两种药物联合应用的最佳组合,并计算抑菌浓度(fractional inhibitory concentration, FIC)指数。
1.2.4 FIC指数计算和判读标准
FIC指数=FICA+ FICB
FIC≤0.5为两种药物有协同作用,0.5
2 结果
2.1 抗生素敏感试验结果
17株对左氧氟沙星耐药的SMA的抗生素的敏感率如下:左氧氟沙星0.0%,复方新诺明100.0%,米诺环素100.0%,替加环素76.4%,头孢他啶11.7%;11株对左氧氟沙星和复方新诺明耐药SMA的抗生素敏感率:左氧氟沙星0.0%,复方新诺明0.0%,米诺环素72.7%,替加环素54.5%,头孢他啶18.2%;5株对左氧氟沙星、复方新诺明及米诺环素耐药的SMA对本实验中使用的抗生素敏感率均为0.0%。详见表1。

表1 抗菌药物对临床SMA体外药敏试验结果Tab.1 Activities of selected antibiotic against clinical Stenotrophomonas maltophilia
2.2 联合药敏试验结果
棋盘式微量肉汤稀释法药敏结果显示,替加环素与5种抗菌药物分别联合使用对33株SMA的体外联合抑菌试验显示均未见拮抗现象。对左氧氟沙星耐药的17株SMA体外联合药敏结果显示:替加环素与左氧氟沙星、复方新诺明、米诺环素、头孢他啶及头孢哌酮-舒巴坦的协同作用百分比分别为17.6%、5.9%、0.0%、17.6%、11.7%,相加作用百分比分别为29.4%、23.5%、11.7%、35.3%、35.3%,FIC指数范围为0.16~1.5。对左氧氟沙星和复方新诺明耐药的11株SMA的体外联合药敏显示:替加环素与左氧氟沙星、复方新诺明、米诺环素、头孢他啶及头孢哌酮-舒巴坦的协同作用百分比分别为18.2%、0.0%、0.0%、18.2%、9.1%,相加作用百分比分别为9.1%、18.2%、9.1%、27.2%、36.3%,FIC指数范围为0.25~1.5,其协同及相加作用较左氧氟沙星耐药的SMA有所降低。对左氧氟沙星、复方新诺明及米诺环素耐药的5株SMA的体外联合药敏结果显示:替加环素与左氧氟沙星、复方新诺明、米诺环素、头孢他啶及头孢哌酮-舒巴坦的协同作用百分比分别为20.0%、0.0%、0.0%、20.0%、20.0%,相加作用百分比均为20.0%,FIC指数范围为0.5~1.5,其协同及相加作用百分比最低。详见表2。
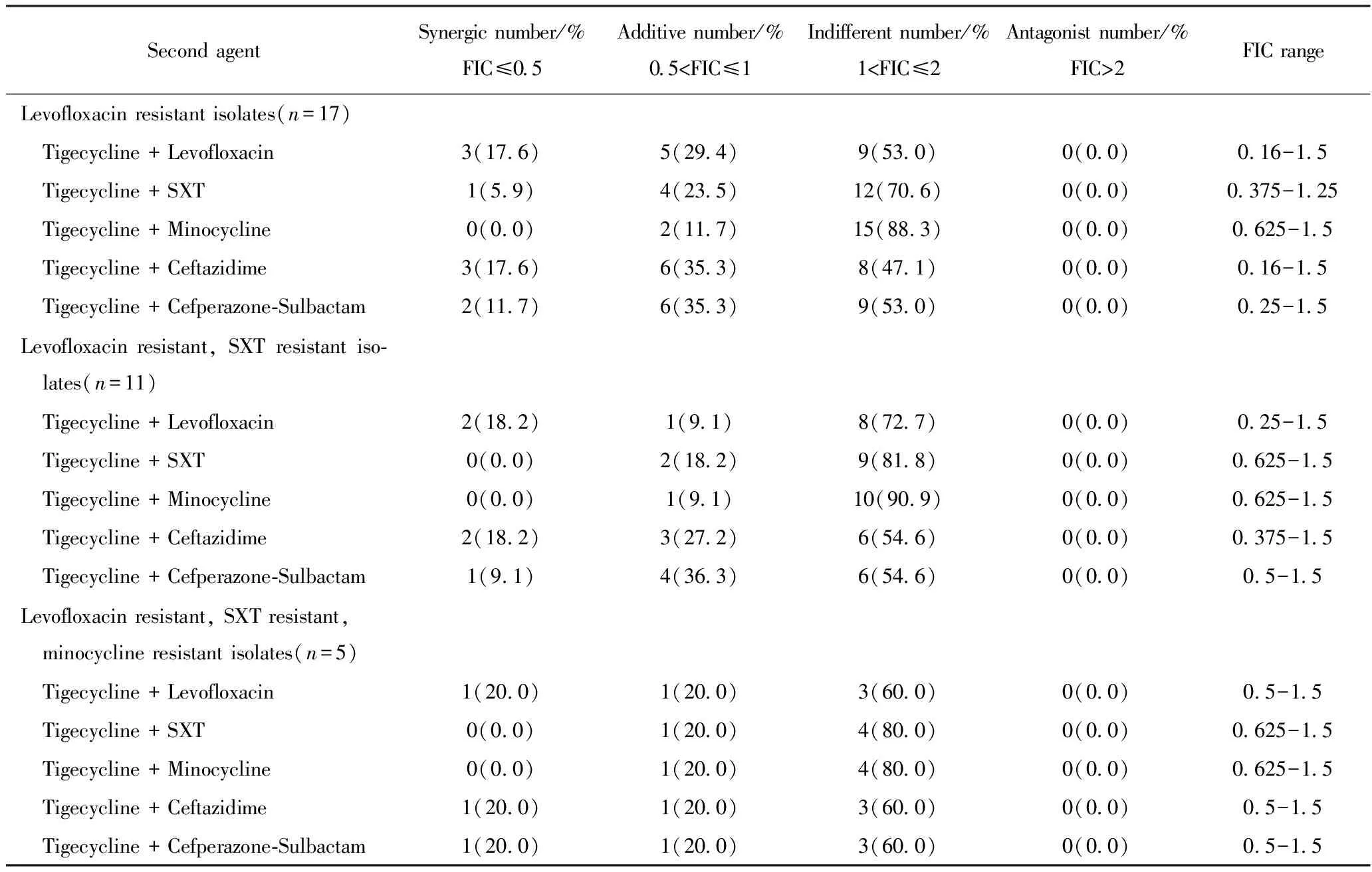
表2 替加环素联合5种抗菌药物对SMA的体外联合药敏结果Tab.2 Results of chequerboard testing of tigecycline and a second antibacterial agent against clinical Stenotrophomonas maltophilia n(%)
3 讨论
SMA是一种在自然环境和医院内广泛存在的条件致病菌,可以存在于水源和潮湿环境中,其毒力和致病性较低,但在免疫缺陷和重症监护室等特定人群可以引起严重的肺部感染或血流感染,且具有很高的病死率,随着逐年增加的院内感染率,给临床医护人员及感染管理人员带来了很大的挑战和压力[6-9]。SMA含有β-内酰胺酶,对β-内酰胺酶类抗生素天然耐药,其可借助产生氨基糖苷类修饰酶以及外排泵表达等机制对多种抗生素耐药[10-11]。治疗SMA感染一般首选复方新诺明,体外药敏试验的敏感率相对较高[12]。但是复方新诺明的耐药及药物不良反应的报道越来越多,而且缺乏可靠的药代动力学-药效学(PK-PD)数据,使复方新诺明的使用受到了限制[13-14]。左氧氟沙星等氟喹诺酮类药物可作为复方新诺明的替代品[15]。但是左氧氟沙星的耐药性增加、不良反应及药物间拮抗作用使其使用受限[16]。米诺环素与复方新诺明的体外药敏试验敏感率差异无统计学意义[17]。替加环素是甘氨酰环素类抗菌药物,是半合成四环素米诺环素的衍生物,对SMA,甚至对SXT耐药的SMA都具有很好的体外抗菌活性[18]。
本研究中筛选了33株对左氧氟沙星耐药的SMA,体外药敏试验结果显示,除了5株对左氧氟沙星、复方新诺明及米诺环素均耐药的SMA之外,替加环素对其他28株耐药SMA表现出较好的抑菌活性,即使是对左氧氟沙星和复方新诺明耐药的SMA,其敏感率也达到了54.5%,略低于米诺环素的敏感率72.7%,远高于头孢他啶的敏感率18.2%,与Biagi等[19]的研究结果相符。
本研究中使用的替加环素对SMA没有推荐的药敏折点,而是以肠杆菌细菌为参考,就可能会对替加环素的实际敏感率评估过高或过低。实验中共纳入33株耐药SMA,其中多重耐药的SMA只有5株,菌株数量过少,也可能会导致实验结果有所偏差。尽管体外实验不能完全模拟药物在体内的抑菌效果,但本研究结果显示,替加环素联合左氧氟沙星、头孢他啶或头孢哌酮-舒巴坦,或可为临床治疗耐药SMA引起的感染提供治疗选择。

