增强CT影像组学鉴别小肾癌与乏脂肪肾血管平滑肌脂肪瘤的价值
向玲玲 ,吴晶涛,郜言坤 ,罗先富,朱庆强,田彤彤
1. 大连医科大学第二临床学院,辽宁 大连 116044;
2. 扬州大学临床医学院江苏省苏北人民医院影像科,江苏 扬州 225001
小肾肿瘤指肿瘤直径≤4 cm的肾脏肿瘤[1],临床上一般将肾癌的生物学特性、治疗方案及预后判断作为依据,以制定小肾肿瘤体积的界定标准,欧洲泌尿协会(European Association of Urology,EAU)将肿瘤直径≤4 cm的肾细胞癌(renal cell carcinoma,RCC)定义为小肾癌[2],其大多为进展缓慢,且转移与复发率极低的早期局限性肾癌(T1a期),临床常推荐行保留肾单位术(nephron sparing surgery,NSS),因此4 cm常作为小肾肿瘤体积的界定标准。近年来,随着影像学检查技术的发展、普及,小肾肿瘤检出率呈逐年上升趋势,但由于肿瘤体积小,缺乏典型影像学征象,常规影像学诊断方法对小肾肿瘤良恶性的鉴别诊断价值有限。据报道,20%~30%的小肾肿瘤为良性[3],以血管平滑肌脂肪瘤(angiomyolipoma,AML)最常见,但其中的乏脂肪肾AML(fatpoor renal AML,fpAML)因不含或仅含少量脂肪成分,与小肾癌影像学特征表现类似,临床影像工作中常难以鉴别,术前小肾癌和fpAML的误诊率高达1.7%~22.0%[4],因此小肾肿瘤准确的术前定性诊断对临床治疗方案的选择具有重要意义,可以极大程度地避免不必要的手术。影像组学是一种新兴计算机辅助诊断技术,目前主要是应用计算机体层成像(computed tomography,CT)纹理分析技术[5]或仅基于单期CT扫描图像和二维病灶提取影像组学特征[6-7]。本研究旨在基于多期相CT增强扫描构建全肿瘤分析的影像组学模型,以鉴别小肾癌与fpAML,并比较各期的鉴别效能。
1 资料和方法
1.1 一般资料
回顾并分析2012年7月—2019年12月扬州大学临床医学院江苏省苏北人民医院收治的125例直径≤4 cm的肾脏肿瘤患者的CT图像。术后病理学检查诊断为小肾癌80例(包括肾透明细胞癌49例、乳头状肾细胞癌19例、嫌色细胞癌12例),其中男性55例,女性25例,年龄27~80岁,平均(58.3±12.1)岁,肿瘤大小为1.0~4.0 cm,平均(2.64±0.81)cm。fpAML 45例,其中男性9例,女性36例,年龄31~76岁,平均(54.4±12.0)岁,肿瘤大小0.9~3.9 cm,平均(2.47±1.23)cm。纳入标准:① 术后病理学检查证实为fpAML或RCC;② 术前均接受3期增强CT扫描(皮髓质期、实质期、排泄期);③ 肿瘤直径≤4 cm。排除标准:① CT图像上有明显伪影;② 肿瘤直径>4 cm;③ 以囊性为主的肿瘤;④ 病灶存在肉眼可见脂肪或钙化成分。
1.2 图像采集
采用美国GE公司Optima CT660、LightSpeed VCT CT99、Discovery CT750 HD等64排螺旋CT机。扫描参数:管电压为120 kV,管电流为250~300 mA,扫描层厚及层间距均为5 mm,螺距0.895。增强扫描经肘前静脉注射80 mL非离子型造影剂碘海醇(350 mgI/mL),流速3.2 mL/s。肾皮髓质期、实质期及排泄期扫描时间分别为注射对比剂后25~35、60~100及180 s。
1.3 影像组学方法
1.3.1 图像分割
将纳入患者的CT增强图像从影像归档和通信系统(Picture Archiving and Communication System,PACS)以DICOM格式导入Darwin智能科研平台(北京医准智能科技有限公司)。所有图像层厚为5 mm,采用人工手动分割,由2名放射科医师(分别具有2年、12年腹部影像学工作经验)沿病灶边缘内侧1~2 mm逐层手工勾画三维感兴趣区(region of interest,ROI)。首先在皮髓质期确定病灶的三维ROI,再以皮髓质期图像为参考,将其略微调整后在实质期、排泄期图像获得病灶的ROI(图1)。
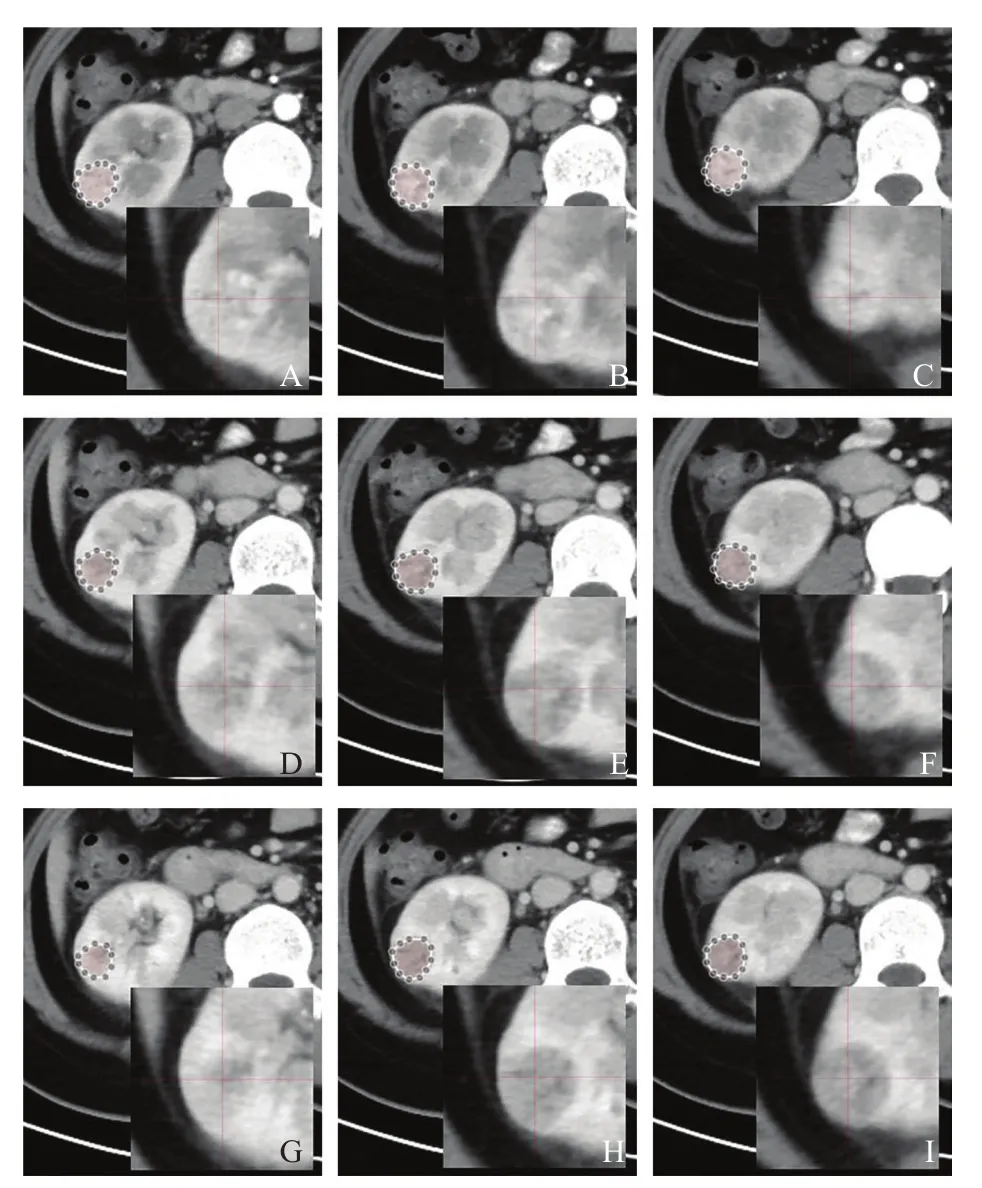
图1 Darwin智能科研平台勾画三维ROI示意图
1.3.2 多期增强CT影像组学特征提取
将已标记影像按照3∶1的比例划分训练集(93例)与测试集(32例)。使用标准化方法(将每一维度特征减去均值再除以方差,使之均值为0,方差为1)对特征进行预处理后,利用Darwin平台从训练集中提取特征,并在独立测试集中进行验证以减少过度拟合。提取的特征包括7种类型:一阶特征、形状特征(3D)、灰度共生矩阵(gray level co-occurrence matrix,GLCM)、灰度区域大小矩阵(gray level size zone matrix,GLSZM)、灰度游程矩阵特征(gray level run length matrix,GLRLM)、邻域灰度差分矩阵(neighbouring gray tone difference matrix,NGTDM)和灰度依赖矩阵(gray level dependence matrix,GLDM)。
1.3.3 特征筛选及构建影像组学预测模型
本研究依次采用迭代筛选特征(Wrapper式)、最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)回归模型(Embedded式)进行特征降维,剔除不相关或冗余特征,最终筛选出对鉴别小肾癌与fpAML最有价值的特征子集。利用筛选出来的特征,分别结合支持向量机(support vector machine,SVM)、逻辑回归(logistic regression,LR)分类器对预测模型进行训练,并在独立测试集中进行验证。其中SVM分类器核函数为线性核函数和径向基函数。
1.4 统计学处理
2 结 果
2.1 研究对象一般资料比较
小肾癌组和fpAML组性别差异有统计学意义,(χ2=27.394,P=0.00)比较发现fpAML好发于女性;年龄差异无统计学意义。
2.2 影像组学特征分析
对3期CT增强图像进行多种滤波处理(包括对数、平方、平方根、指数、梯度、小波变换操作),共提取特征1 223个,采用迭代剔除、LASSO回归模型筛选,最终筛选出91个特征(表1)。
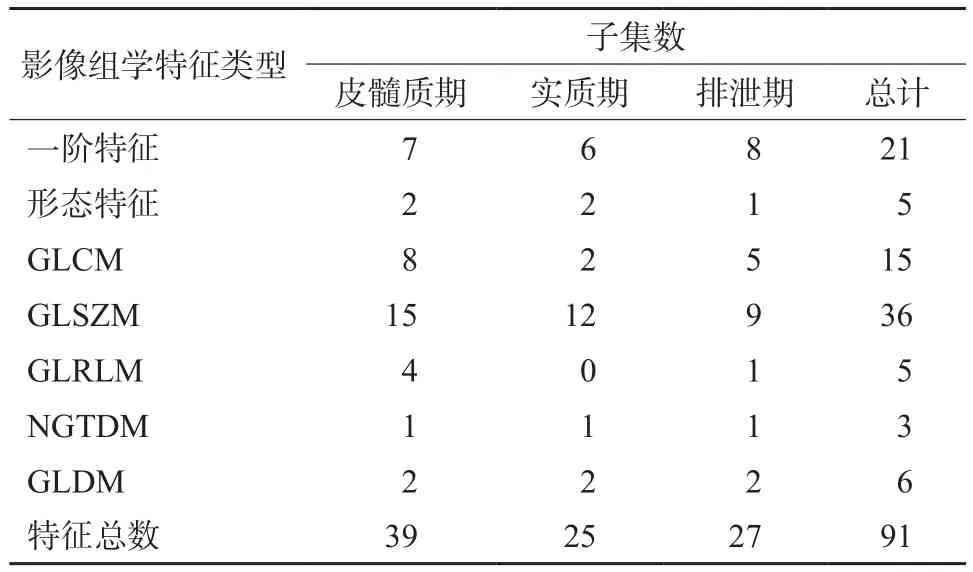
表1 最优影像组学特征子集
2.3 影像组学预测模型的构建与评估
分别结合SVM、LR分类器对3期CT增强扫描最优特征参数构建影像组学模型,绘制ROC曲线(图2),并计算AUC、特异度、灵敏度和准确度,以评价SVM模型与LR模型对小肾癌与fpAML鉴别诊断效能。结果表明,基于皮髓质期构建的SVM、LR模型均具有较好的鉴别效能,其中SVM模型优于LR模型;基于实质期、排泄期构建的SVM、LR模型对小肾癌与fpAML具有一定的鉴别效能。综合3期比较发现皮髓质期为鉴别小肾癌与fpAML的优势期相,其中SVM模型鉴别效能优于LR模型(表2)。
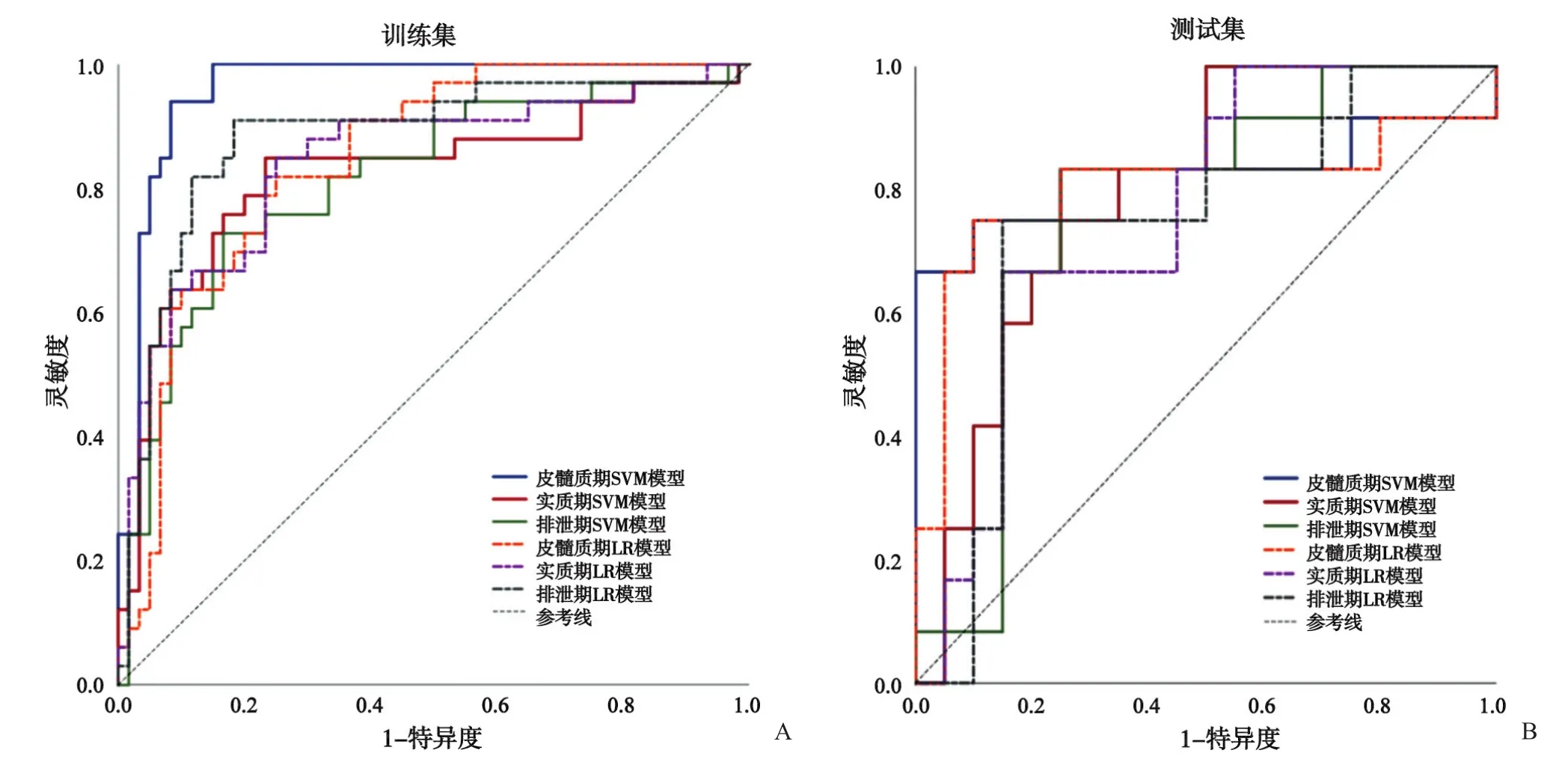
图2 3期增强CT构建SVM、LR模型鉴别小肾癌与fpAML的ROC曲线(A为训练集,B为测试集)
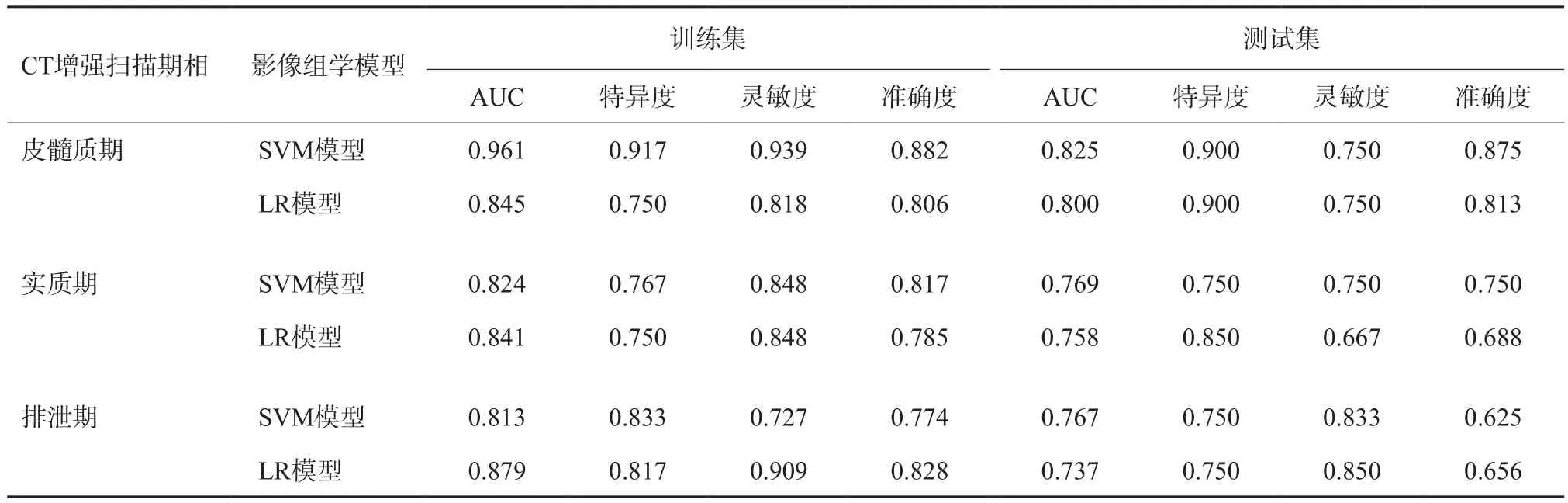
表2 影像组学SVM、LR模型性能比较
3 讨 论
临床影像工作中,小肾肿瘤的鉴别主要依靠CT或磁共振成像(magnetic resonance imaging,MRI)平扫和增强图像上肿瘤的CT值、成分(出血、坏死、钙化)、强化方式,以及与周围正常组织的关系(包膜、角度)对两者加以鉴别[8-9],但定性分析极易受到影像工作者的主观判断影响。影像组学利用高级数据模型算法可对病灶中肉眼难以观察的异质改变进行全面、定量的分析,已经在疾病的定性诊断、肿瘤恶性程度判断、肿瘤疗效评估和预后预测中取得突破性进展[10]。目前,多篇文献提出纹理分析技术及影像组学模型对肾癌与fpAML有较好的鉴别效能,You等[11]对小肾肿瘤的4期CT增强图像进行定量纹理分析,使用SVM分类器,筛选出5个对肾透明细胞癌与fpAML具有显著鉴别能力的纹理特征,所选特征参数的最大AUC值为0.85,但利用传统纹理分析技术所提取的特征数量极其有限;Lee等[6]每次仅利用一种特征降维方式对单相CT增强图像提取纹理特征,导致其获得较低AUC值。Feng等[7]基于58例患者的3期CT增强扫描图像提取纹理特征,通过两种降维算法(Mann-WhitneyU检验和支持向量机递归特征消除)先后对特征进行选择,并结合SVM分类器构建的分类模型以鉴别不同亚型小肾癌与fpAML,最终获得AUC值为0.955,该模型虽获得较高的AUC值,但是仅选取肿瘤最大截面的单张轴位图像勾画二维ROI进行纹理分析,所提取的纹理信息仅能反映该层面ROI的生理异质性,所包含的肿瘤信息不全面,对全肿瘤的鉴别价值可能有限。
与上述研究不同,本文是针对直径≤4 cm的肾脏肿块,这类肿块体积较小、生长缓慢,没有较大肾癌容易坏死、强化明显等特点,在常规CT和MRI图像分析中缺乏特征性表现,因此对小肾肿瘤的高效鉴别比肾脏较大肿瘤之间的鉴别更具有临床意义。此外,本研究通过容积提取整个肿瘤的纹理信息,可更加准确真实地反映该肿瘤组织整体的特征。Hötker等[12]指出全肿瘤分析在评价肿瘤异质性方面优于二维分析。本研究先后使用Wrapper式与Embedded式特征算法对所提取特征降维,最终分别选取皮髓质期39个、实质期25个与排泄期27个特征构建影像组学模型,获得最佳AUC值,这与杨熠等[13]研究结果一致,鉴别肾癌与fpAML时使用大小为30~40的特征子集时可获得最高准确度。本研究结果显示,肾脏皮髓质期的影像组学特征对小肾癌与fpAML的鉴别效能优于实质期与排泄期,且SVM模型优于LR模型,SVM模型的AUC值均在0.825以上,准确度也在0.875以上,优于Lee等[6]仅基于排泄期图像的影像组学分析结果。这可能与小肾癌多为富血供肿瘤,其皮髓质期强化程度明显高于fpAML,与其余两期比较两者之间的强化差异更加明显有关,可见皮髓质期蕴含更多的影像组学纹理信息。此外,小肾肿瘤与特征之间可能存在非线性关系,而SVM模型与LR模型均为线性模型,但本研究中的SVM模型均采用两种核函数解决非线性问题,因此SVM模型鉴别效能优于LR模型。本研究表明,基于各时相CT图像提取的影像组学特征,以所建立的SVM、LR模型量化人眼无法辨别的组织之间的异质性,与以往研究[14]报道相符,通过影像组学模型有望实现小肾肿瘤的良恶性鉴别,以达到精准医疗的目的。
本研究仍存在以下局限性:① 尽管本研究已经收集3期增强CT图像,但是仍缺少平扫期影像学资料。既往研究[15]表明,肾脏CT平扫期在区分AML与RCC中有一定作用。② 手动分割无法保证3期ROI的形状、大小完全一致,如果能引入计算机自动分割可能更加精确。③ 尽管本研究与其他同类研究比较,样本量相对充足,但是各组数据样本仍旧欠均衡,可能会存在偏倚。
综上所述,基于3期CT增强扫描的影像组学模型鉴别小肾癌与fpAML具有一定的可行性,其中肾皮髓质期鉴别效能优于实质期与排泄期,且SVM模型诊断价值较LR模型更高。但不同类型肾癌影像学特征差异巨大(如肿瘤血供),我们期望在今后的研究中进一步扩大样本量,分别研究影像组学模型在不同类型肾癌之间或不同类型肾癌与fpAML之间的鉴别效能,促使影像组学模型能更好地应用于小肾肿瘤的鉴别诊断中,减少影像工作者在临床实践中的主观错误,避免对临床医师产生不准确引导而导致不必要的手术。

