超声造影鉴别诊断乳腺良恶性病变的价值
杨道辉,袁海霞, ,吴爱琴,夏罕生, ,范培丽, ,王文平,
1. 复旦大学附属中山医院厦门医院超声科,福建 厦门 361015;
2. 复旦大学附属中山医院超声科,上海 200032
乳腺癌是全球女性最常见的恶性肿瘤,且发病率有逐年上升趋势[1]。常规超声检查价格低廉、无电离辐射、可反复多次检查,是临床上筛查乳腺疾病的常用方法。美国放射学会(American College of Radiology,ACR)的乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)是临床上常规灰阶超声诊断乳腺良恶性疾病最常用的标准,在临床上已得到广泛的应用[2]。一些研究[3-4]表明,BI-RADS诊断乳腺癌具有很高的灵敏度,但同时具有较高的假阳性结果,导致许多患者接受不必要的穿刺活检。超声造影(contrast-enhanced ultrasound,CEUS)作为一种纯血池成像技术能随血液进入组织及病灶的毛细血管网。不仅能显示乳腺病灶的形态学表现,还能实时、动态地观察乳腺组织及病灶内微循环灌注特征。本研究旨在探究乳腺良恶性病变的CEUS声像图特征,以期提高乳腺疾病的诊断水平。
1 资料和方法
1.1 研究对象
本研究回顾并分析2019年4月—2020年1月复旦大学附属中山医院厦门医院经粗针穿刺或手术后病理学检查证实的66例女性乳腺占位性病变,其中恶性肿瘤41例,良性病变25例。所有患者术前均行常规超声及CEUS检查。纳入标准:① 成年女性患者;② 术前未行放化疗及其他治疗;③ 既往无造影剂过敏史;④ 无严重心肺功能疾病;⑤ 无其他器官恶性肿瘤病史。
1.2 仪器与方法
所有的病灶都采用美国GE公司的Logiq E9彩色多普勒超声诊断仪进行常规超声及实时灰阶CEUS观察。患者取仰卧位,双手上举、充分暴露双侧乳腺,使用ML6-15高频线阵探头行常规超声检查,对可疑病灶进行多切面扫查,观察病灶的大小、形态、位置等。随后切换至CEUS模式,使用9L高频线阵探头,采用低机械指数(mechanical index,MI)下双幅实时谐波CEUS技术。造影剂使用意大利Bracco公司生产的声诺维(SonoVue),每次使用前用5 mL生理盐水进行溶解,充分振荡混匀后,经肘正中静脉团注4.0 mL,随后用5 mL生理盐水冲管。注入造影剂后,叮嘱患者平静呼吸。在注入造影剂的同时,对乳腺病灶进行实时连续观察,连续存储并记录造影剂注入后90 s内乳腺病灶的造影动态图像,并持续观察至病灶内造影剂廓清。
1.3 超声观察指标
所有超声图像由高年资(5年以上)超声科医师进行分析。常规超声观察乳腺病灶位置、回声、大小,以及病灶内彩色多普勒血流显像(color Doppler flow imaging,CDFI)血流分布情况等。选择病灶内血流最丰富的切面,切换至CEUS模式,造影剂经肘正中静脉团注后,观察并记录乳腺病灶开始增强时间、造影剂填充方向、病灶周围是否有穿支血管、达峰时间、达峰时增强程度、CEUS后病灶增强范围、增强方式及病灶高增强持续时间等。
1.4 统计学处理
采用SPSS 22.0软件进行统计学分析,计量资料采用t检验,计数资料采用χ2检验比较。P<0.05为差异有统计学意义。
2 结 果
2.1 临床及病理学检查结果
66例乳腺病变患者均为女性,恶性肿瘤患者平均年龄(54.1±9.6)岁,良性病变患者平均年龄(43.1±8.4)岁,差异有统计学意义(P<0.05)。所有患者均行穿刺活检或外科手术治疗,66例乳腺病灶中,最终病理学检查结果证实41例为乳腺恶性肿瘤,其中浸润性导管癌36例,导管原位癌(ductal carcinomainsitu,DCIS)3例,包裹内乳头状癌1例,黏液癌1例。25例为乳腺良性病变,其中乳腺病及纤维腺瘤17例,导管内乳头状瘤5例,炎性病变3例。
2.2 CEUS表现
CEUS显示,乳腺恶性肿瘤及良性病变在造影剂填充方向、CEUS后病灶大小、是否有蟹足样穿支血管、增强方式及病灶内高增强持续时间上的差异均有统计学意义(P均<0.05,表1)。27例(65.9%)乳腺恶性肿瘤造影剂呈由外向内填充,仅9例(36.0%)乳腺良性病变造影剂呈向心性填充。32例(78.0%)乳腺恶性肿瘤CEUS后病灶范围较常规灰阶超声增大,而仅8例(32.0%)乳腺良性病变CEUS后病灶范围较常规灰阶超声增大。25例(61.0%)乳腺恶性肿瘤CEUS后病灶周围可见扭曲的蟹足样穿支血管,仅8例(32.0%)乳腺良性病变CEUS后病灶周边可见穿支血管。32例(78.0%)乳腺恶性肿瘤表现为不均匀增强,仅8例(32.0%)良性病变呈不均匀增强。CEUS时乳腺恶性肿瘤与良性病变在达峰时增强程度、开始增强时间及达峰时间等声像图方面的差异均无统计学意义(P均>0.05)。乳腺恶性肿瘤与良性病变的病灶CEUS达峰时均以高增强表现为主,39例(95.1%)乳腺恶性肿瘤及21例(84.0%)良性病变均呈高增强表现,但乳腺恶性肿瘤病灶高增强持续时间为(66.9±24.6)s,良性病变仅为(56.2±26.8)s,差异有统计学意义(P<0.05,图1、2)。
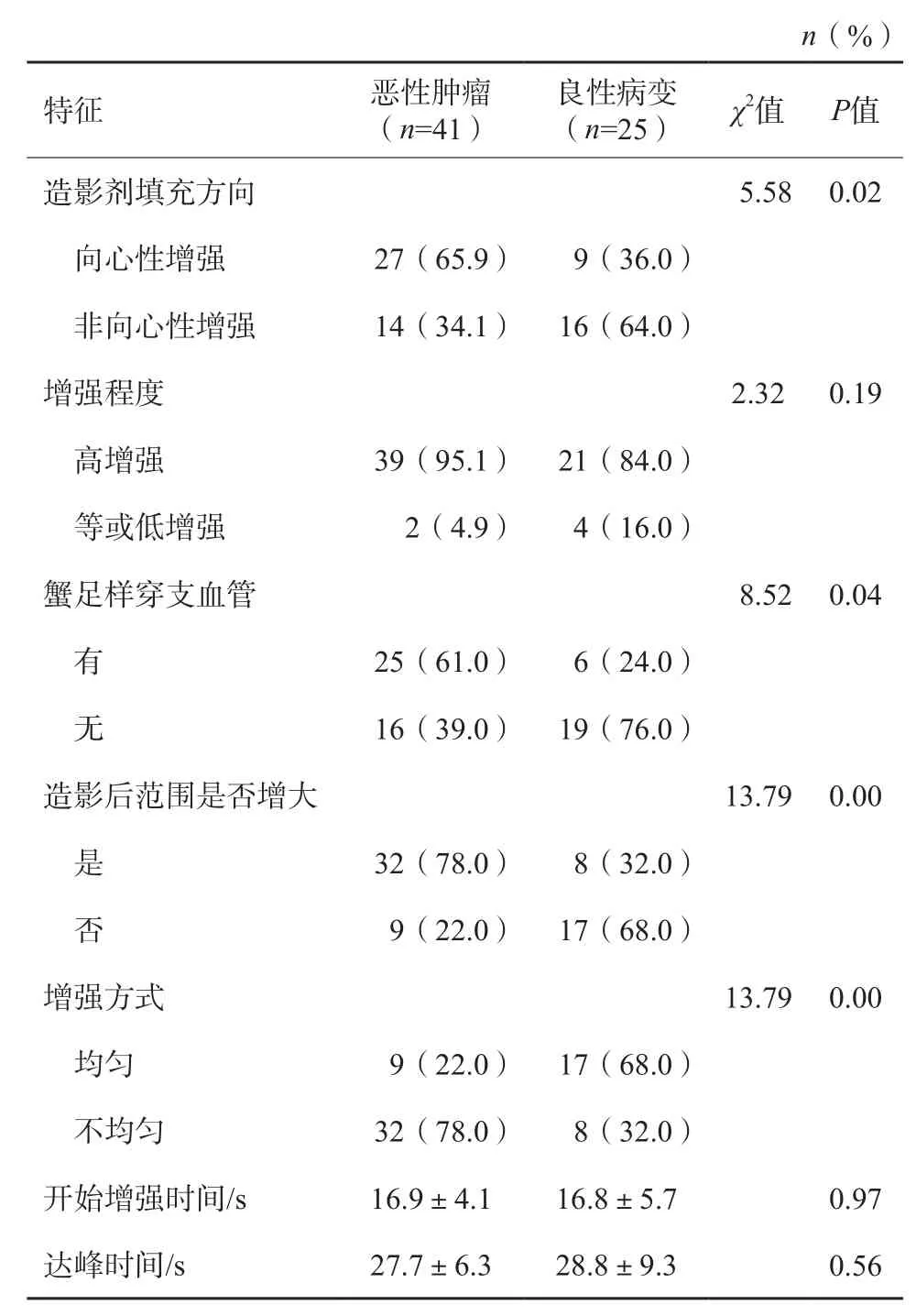
表1 乳腺病灶CEUS声像图特征
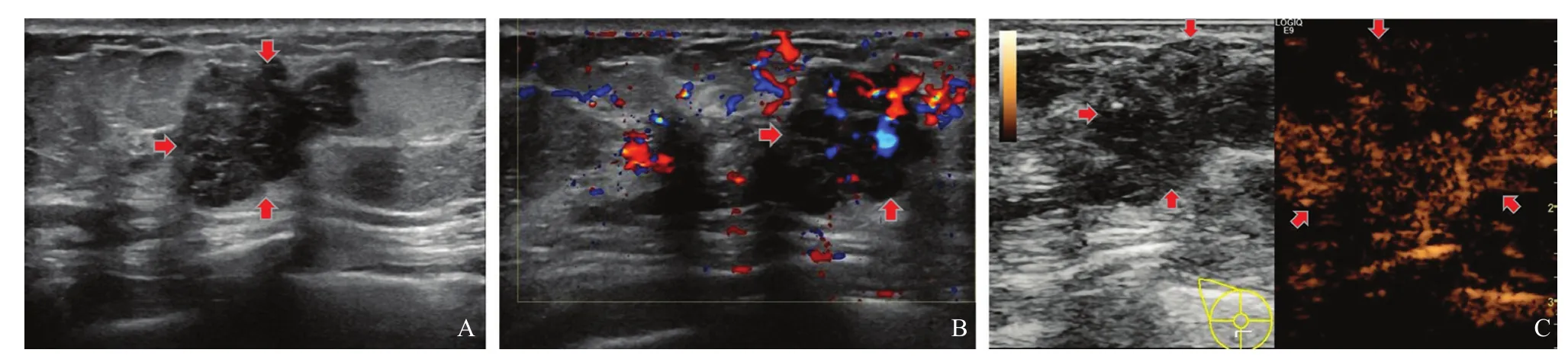
图1 乳腺恶性肿瘤的超声表现
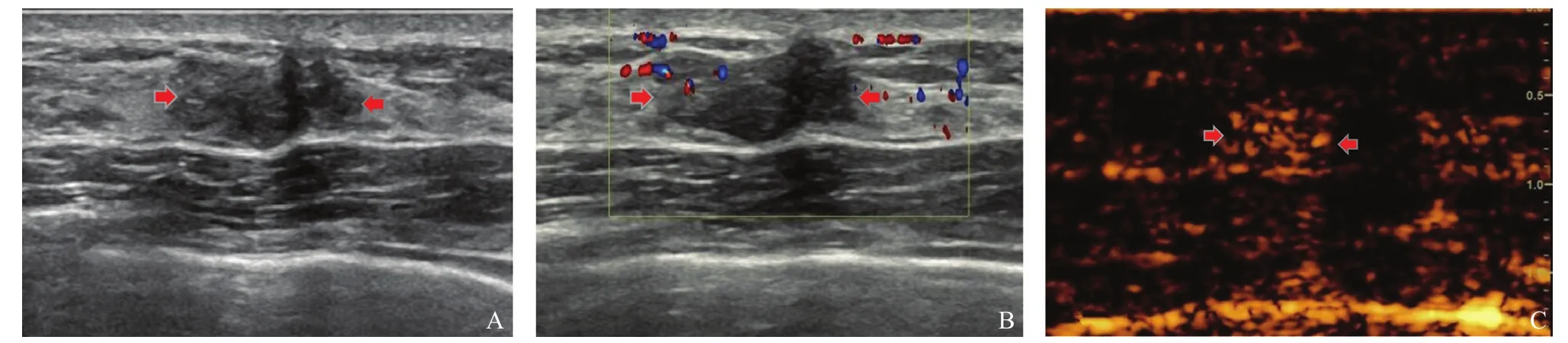
图2 乳腺纤维腺瘤的超声表现
2.3 CEUS的诊断效能
CEUS后病灶范围增大诊断乳腺恶性肿瘤的灵敏度、特异度、准确度及曲线下面积(area under curve,AUC)分别为78.0%、68.0%、74.2%及0.73;不均匀增强诊断乳腺恶性肿瘤的灵敏度、特异度、准确度及AUC分别为78.0%、68.0%、74.2%及0.73;病灶周围蟹足样血管诊断乳腺恶性肿瘤的灵敏度、特异度、准确度及AUC分别为63.4%、78.0%、68.2%及0.70;造影剂由外向内填充诊断乳腺恶性肿瘤的灵敏度、特异度、准确度及AUC分别为65.9%、64.0%、65.2%及0.65。持续高增强时间以62.5 s作为截断值诊断乳腺恶性肿瘤的灵敏度、特异度及AUC分别为69.2%、66.7%及0.70。
3 讨 论
常规超声和钼靶X线检查是乳腺肿瘤筛查较常用的检查手段,但是部分早期及BI-RADS 3、4级乳腺恶性肿瘤常规二维超声及钼靶X线检查的影像学特征不明显,诊断困难。Sun等[5]比较了常规灰阶超声、钼靶X线检查及磁共振成像(magnetic resonance imaging,MRI)对乳腺良恶性病变的诊断效能,发现MRI诊断乳腺疾病的准确度和灵敏度分别为86.9%和95.5%,诊断效能优于常规灰阶超声及钼靶X线检查。但是MRI检查无法实时动态地观察病灶影像学特征且检查禁忌较多,如严重的造影剂过敏、对肾脏的毒性作用、幽闭恐惧症及金属植入物检查的禁忌等。近年来有相关研究[6-7]发现,CEUS诊断乳腺良恶性病变的诊断效能与增强MRI相仿甚至略优。CEUS检查以简便、可实时动态观察及能重复多次检查等优势在临床上应用越来越广泛。以声诺维为代表的第二代“纯血池”CEUS造影剂能进入乳腺组织及病灶的毛细血管网,实时清晰、准确地显示病灶及周围腺体的微循环血流灌注情况,有助于诊断及鉴别诊断乳腺恶性肿瘤[8]。
尽管有许多国内外学者对乳腺恶性肿瘤的CEUS声像图特征进行过研究,但是目前仍然缺乏统一的诊断标准,限制了CEUS在乳腺疾病中的广泛应用。国内外研究[9-16]结果显示,CEUS有助于乳腺良恶性疾病的诊断及鉴别诊断。本研究结果显示,乳腺恶性肿瘤CEUS时显示增强范围较常规超声增大,病灶周围可见蟹足样穿支血管,病灶以向心性不均匀增强为主。乳腺恶性肿瘤受血管内皮生长因子受体影响,肿瘤外周有许多新生微血管,使其不断向周围组织浸润生长,因此CEUS时乳腺恶性肿瘤病灶范围较常规灰阶超声增大,而乳腺良性病变CEUS时病灶范围与常规灰阶超声比较无明显变化[17-20]。本研究结果显示,78.0%的乳腺恶性肿瘤在CEUS时显示病灶范围较常规灰阶超声检查时增大,而仅有32.0%的乳腺良性病变CEUS后病灶范围较常规灰阶超声增大。研究[21-22]指出,约66.7%的乳腺恶性肿瘤病灶范围被常规超声检查低估,且被低估部分的组织在病理学上多数为DCIS及DCIS伴局部浸润,这些病灶在常规超声上以非肿块型为主。而CEUS通过病灶微循环高灌注特征可以清楚地显示病灶浸润范围及血流灌注特征,弥补常规超声对病灶微循环显示的不足。因此,CEUS后病灶范围增大不仅有助于诊断乳腺恶性肿瘤,也有助于准确地判断乳腺恶性肿瘤病灶浸润范围。血管内皮生长因子可以刺激乳腺组织生成新生血管延伸到恶性肿瘤中,形成血管网络。由于恶性肿瘤的异质性,其内部血管走行杂乱、扭曲、变形。而良性病变滋养血管走行平直,多数沿着病灶周围走行[23-24]。本研究显示,CEUS时乳腺恶性肿瘤周围呈现蟹足样滋养血管,而乳腺良性病变周边可见少数走行平直或环绕病灶走行的滋养血管。CEUS造影剂微泡作为纯血池显像剂,能够真实地显示病灶内部及外周的微循环灌注特征。本研究发现,乳腺恶性肿瘤病灶以向心性增强为主(65.9%),而良性病变多数表现为非向心性增强(64.0%)。国内相关学者[25-26]的研究也发现,DCIS及DCIS伴局部浸润主要表现为向心性增强,因为肿瘤的血管生成与肿瘤细胞释放的血管内皮生长因子密切相关,恶性肿瘤病灶外周带微血管密度要高于中央区。本研究中78%的乳腺恶性肿瘤以不均匀增强为主,而68%的良性病变表现为均匀增强,与既往文献[14]报道相符。因此,通过CEUS观察病灶内造影剂填充方向、CEUS后病灶大小、是否有蟹足样穿支血管及增强方式等声像图特征,有助于诊断和鉴别诊断乳腺良恶性病变。
乳腺恶性肿瘤由于病灶内滋养血管丰富,CEUS呈典型高增强表现,而乳腺良性病变CEUS增强表现尚存在一些争论,一些学者[12,27]认为,乳腺良性病变CEUS主要表现为等增强或者低增强;也有研究[28-29]发现,乳腺良性病变尤其是伴导管上皮增生的纤维腺瘤血供较周围腺体明显丰富,CEUS以高增强表现为主。而本研究发现,多数乳腺良性病变CEUS时增强程度高于周围腺体组织,其中4例导管内乳头状瘤和3例炎性病变均表现为高增强,14例乳腺病和纤维腺瘤呈高增强表现。这是由于良性病变和恶性肿瘤病灶内新生血管的生成,微血管密度较周围腺体更高,微循环灌注量更大,因此乳腺良恶性病变在CEUS时均以高增强表现为主。本研究中乳腺恶性肿瘤CEUS时多数呈持续高增强[(66.9±24.6)s]表现且造影剂廓清缓慢;虽然良性病变也以高增强表现为主,但造影剂廓清速度更快,高增强持续时间比恶性肿瘤短[(56.2±26.8)s](P<0.05)。Zhao等[30]的研究也发现,乳腺恶性肿瘤的造影剂廓清时间比良性病变延长,这可能是由于恶性肿瘤内血管网密集,走行扭曲、杂乱。通过比较乳腺恶性肿瘤与良性病变的高增强持续时间差异,有助于鉴别高增强的乳腺良性病变与恶性肿瘤。
本研究存在不足之处:① 纳入的患者数量不多,需要扩大样本量进一步验证。② 通过回放观察动态图像,读取病灶开始增强时间、达峰时间及高增强持续时间存在一定误差。③ 选择血供丰富的切面进行CEUS检查,单一的切面不足以全面地评价病灶的微循环特征。
综上所述,CEUS定性分析对鉴别诊断乳腺良恶性病变具有重要的临床应用价值,能为临床医师提供准确的病灶切缘信息,因此,应在临床中推广应用CEUS。

