硫化氢对氧糖剥夺/复氧神经元细胞自噬和凋亡的作用研究
蒋文武,洪岳,邬力祥,邓吕红
1.南方医科大学第五附属医院神经外科,广州 510920;2.中南大学基础医学院生理学系,长沙 410013;3.南华大学附属第一医院神经外科,湖南 衡阳 421001;4.南方医科大学第五附属医院眼科,广州 510920
脑卒中是全球成人死亡和永久性致残的主要原因,60%~80%的脑卒中患者是由于急性血管阻塞所致,由于缺血缺氧导致神经元不可逆损伤,伴随患者神经系统功能损伤,甚至死亡。其中缺血再灌注损伤对脑卒中的作用引起了学者的长期关注[1]。研究显示自噬在脑缺血再灌注损伤中具有多重作用[2]。自噬是一种高度保守的生物现象,参与炎症、肿瘤和神经系统疾病等多种疾病[3]。硫化氢(hydrogen sulfide,H2S)是继一氧化碳和一氧化氮之后被发现的第3种气体信号分子,机体内有完备的内源性H2S生成机制。H2S参与调节线粒体功能、细胞氧化还原状态,发挥多种保护作用。H2S生成障碍可引起多种疾病,例如肝损伤、肾损伤以及神经系统疾病[4,5]。本组既往研究证明外源性H2S可以减轻大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)引起的脑缺血再灌注损伤,并在离体实验中初步观察到外源性H2S可以减轻氧糖剥夺-复氧(oxygen-glucose deprivation/reoxygenation,OGD/R)引起的神经元细胞的凋亡[6],但其具体机制尚未阐述清楚。磷酸腺苷活化蛋白激酶(AMP-activated protein kinase,AMPK)是一种丝氨酸/苏氨酸蛋白激酶,是细胞内高度保守的能量状态的感受器,是参与维持细胞能量代谢稳态的一种重要的信号分子[7]。研究报道AMPK可以通过mTOR调控细胞的自噬过程[8]。AMPK对mTOR活性的抑制参与低氧诱导的细胞自噬的激活[9],可能在缺血再灌注诱导的组织损伤中扮演着重要的角色[7,10]。本研究进一步探讨外源性H2S是否通过AMPK/mTOR通路抑制自噬从而减轻OGD/R诱导的神经元细胞损伤。
1 材料与方法
1.1 材料
1.1.1 主要试剂 AMPK过表达质粒(上海吉凯基因)、Opti-MEM(Gibco,美国)、Lipofectamine 2000(Invitrogen,美国)、RPMI-1640培养基(Gibco,美国)、胎牛血清(Gibco,美国)、TRIzol(Invitrogen,美国)、逆转录试剂盒(Fermentas,美国)、Taq PCR Mix(The rmo,美国)、PVDF膜(Millipore,美国)、p-AMPK一抗(武汉三鹰)、AMPK一抗(武汉三鹰)、p-mTOR一抗(CST,美国)、mTOR一抗(CST,美国)、p62一抗(CST,美国)、cleaved caspase 3一抗(Abcam,美国)、β-actin一抗(Abcam,美国)、ECL发光试剂(Millipore,美国)、caspase3活性检测试剂盒(Promega,美国)。
1.1.2 主要仪器 Real time-PCR仪(Bio-Rad,美国)、全自动多功能酶标仪(The rmo Scientific,USA)、倒置显微镜(Nikon,日本)、CO2恒温细胞培养箱(IT61,日本)、凝胶成像系统(Bio-Rad,美国)。
1.2 方法
1.2.1 神经元细胞PC12培养 大鼠神经元细胞PC12细胞株购自中国科学院典型培养物保藏委员会细胞库,采用含10%胎牛血清的RPMI-1640培养基培养。细胞培养于含5%CO2的37℃培养箱中。
1.2.2 细胞分组处理 探讨H2S对OGD/R诱导的大鼠神经元损伤机制时,分为正常组、OGD/R组和(OGD/R+NaHS)组,其中(OGD/R+NaHS)组在操作中增加NaHS(100μmol/L)。探讨AMPK在H2S减轻OGD/R诱导的大鼠神经元损伤时,分为转染对照质粒组、转染AMPK过表达质粒组,(转染对照质粒+OGD/R)组,以及(转染AMPK过表达质粒组+OGD/R)组。
1.2.3 OGD/R模型建立 根据文献报道[11],PC12细胞更换为无糖D-Hank’s液后,置于密闭盒子内,快速充入95%N2和5%CO2的混合气体,重复3次后置于37℃恒温箱中进行氧糖剥夺4 h;随后将细胞培养基更换成含血清的RPMI-1640培养基,置于常规含5%CO2的37℃培养箱中继续培养,24 h后收集细胞进行后续检测。
1.2.4 AMPK过表达质粒转染 PC12细胞接种于12孔培养板,采用不含双抗的培养基培养,待细胞融合至50%左右,取0.8 g质粒与50 L Opti-MEM混合,室温下温育5 min。将Lipofectamine 2000试剂轻柔摇匀,取1 L Lipofectamine 2000试剂在另一管中与50 L Opti-MEM混合,室温下温育5 min。把稀释后的质粒与稀释后的Lipofectamine2000进行混合,轻轻地颠倒混匀。室温放置20 min后加入培养细胞。4 h后,更换新鲜含血清的培养基继续培养72 h。转染后细胞可进行后续实验。
1.2.5 real-time PCR检测基因表达 PC12细胞处理后,采用TRIzol裂解,并按照说明书提取细胞总RNA,取1μg总RNA逆转录为cDNA,并以此为模板采用real-time PCR法检测目的基因的表达。根据各基因的Ct值,采用2-Ct法计算各基因的相对表达量。本研究所用大鼠特异性引物序列如下:AMPK:正向TTCGGGAAAGTGAAGGTGGG,反 向GGTTCTGGA TCTCTCTGCGG;Caspase 3:正 向GGAGCTTGGAA CGCGAAGAA,反向ACACAAGCCCATTTCAGGGT;β-actin:正 向GTCGTACCACTGGCATTGTG,反 向CTCTCAGCTGTGGTGGTGAA。
1.2.6 Western blot检测蛋白表达 PC12细胞处理后,采用含蛋白酶抑制剂的RIPA裂解液收集总蛋白,经浓度测定后取30μg总蛋白在12%SDS-PAGE胶上电泳分离,之后转移至PVDF膜上,经5%小牛血清封闭后分别孵育一抗(p-AMPK:1:2000;AMPK:1:1000;p-TOR:1:1500;TOR:1:2000;p62:1:1000;cleaved caspase 3:1:1000;β-actin:1:1000),4℃过夜;次日洗去未结合一抗后室温孵育相应的HRP-二抗(1:7500);最后采用ECL化学发光试剂显色,各目的条带的灰度值与内参β-actin灰度值的比值表示其相对表达量。
1.2.7 细胞Caspase-3活性检测 PC12细胞经不同处理后,收集细胞并充分裂解,随后严格按着试剂盒说明书操作,最后使用多功能酶标仪检测细胞内Caspase-3活性。
1.3 统计学分析
采用SPSS 19.0软件进行统计处理,计量资料采用均数±标准差()表示。两独立样本均数比较采用t检验,多组样本均数比较采用单因素方差分析(one-way ANOVA),组间两两比较采用S-N-K检测。P<0.05认为差异具有统计学意义。
2 结果
2.1 NaHS对OGD/R处理神经元细胞mTOR蛋白表达的影响
OGD/R处理明显降低大鼠神经元PC12细胞pmTOR蛋白的表达(P<0.05,图1A~B),而总mTOR蛋白表达未见明显改变(P>0.05,图1C)。而NaHS处理能显著提高OGD/R诱导神经元细胞中p-mTOR蛋白表达(P<0.05,图1D),增加p-mTOR/mTOR的比值(P<0.05,图1)。且NaHS处理能显著降低OGD/R诱导神经元细胞LC3-II与LC3-I比值(P<0.05,图1),提示外源性H2S可激活OGD/R神经元细胞mTOR信号通路,从而抑制OGD/R诱导的自噬。
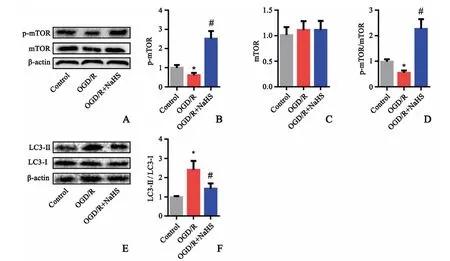
图1 NaHS对OGD/R大鼠神经元细胞mTOR蛋白表达的影响(n=6)A、E:Western blot条带B:p-mTOR蛋白含量分析图C:mTOR蛋白含量分析图D:p-mTOR与mTOR比值F:LC3-II与LC3-I比值*P<0.05,与Control组相比#P<0.05,与OGD/R组相比Fig.1 The effect of NaHSon the expression of mTORprotein in neurons of OGD/RratsA,E:The image of Western blot;B:Diagram of p-mTOR protein content;C:Diagram of mTOR protein content;D:The ratio of pmTOR and mTOR;F:The ratio of LC3-IIand LC3-I;*P<0.05,vs control group;#P<0.05,vs OGD/Rgroup
2.2 NaHS对OGD/R处理神经元细胞AMPK蛋白表达的影响
Western blot结果显示OGD/R处理大鼠神经元PC12细胞24 h可显著增加胞内p-AMPK蛋白表达(P<0.05),总AMPK蛋白表达未见明显改变(P>0.05)。而NaHS处理可明显降低OGD/R大鼠神经元细胞p-AMPK蛋白的表达(P<0.05),并降低p-AMPK/AMPK的比值(P<0.05,图2)。表明外源性H2S抑制OGD/R神经元细胞AMPK磷酸化。
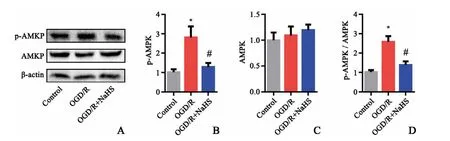
图2 NaHS对OGD/R大鼠神经元细胞的AMPK蛋白表达的影响(n=6)A:Western blot条带B:p-AMPK蛋白含量分析图C:AMPK蛋白含量分析图;D:p-AMPK与AMPK比值*P<0.05,与Control组相比#P<0.05,与OGD/R组相比Fig.2 The effect of NaHSon the expression of AMPK protein in neurons of OGD/RratsA:The image of Western blot;B:Diagram of p-AMPK protein content;C:Diagram of AMPK protein content;D:The ratio of p-AMPK and AMPK;*P<0.05,vs control group;#P<0.05,vs OGD/Rgroup
2.3 AMPK过表达对NaHS调节OGD/R神经元mTOR蛋白和p62蛋白表达的影响
为阐明AMPK在NaHS减轻OGD/R诱导神经元细胞自噬中的作用,采用AMPK过表达质粒转染细胞。结果显示AMPK过表达质粒显著增加PC12细胞AMPK mRNA和蛋白表达(P<0.01,图3A~C)。与Control组相比,AMPK过表达预处理的大鼠神经元OGD/R处理24 h后p-mTOR蛋白表达显著降低(P<0.05),而p62蛋白的表达增加(P<0.05,图3D~F)。提示外源性H2S通过抑制AMPK、激活mTOR磷酸化,从而降低大鼠神经元细胞自噬。
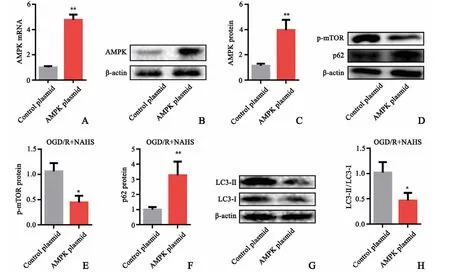
图3 AMPK过表达对NaHS调节OGD/R神经元细胞的mTOR蛋白和p62蛋白表达的影响(n=3)A:AMPK mRNA表达B~C:AMPK蛋白表达D:Western blot条带E:p-mTOR蛋白含量分析图F:p62蛋白含量分析图G:Western blot条带H:LC3-II与LC3-I比值*P<0.05,与control质粒组相比**P<0.01,与control质粒组相比Fig.3 The effect of AMPK over expression on the expression of p-mTOR and p62 in neurons of OGD/Rrats(n=3)A:The expression of AMPK mRNA;B~C:The expression of AMPK protein;D:The image of Western blot;E:Diagram of p-mTORprotein content;F:Diagram of p62 protein content;G:The image of Western blot;H:The ratio of LC3-IIand LC3-I;*P<0.05,vs control plasmid group;**P<0.01,vs control plasmid group
2.4 AMPK过表达对NaHS处理OGD/R神经元细胞凋亡的影响
与Control组相比,AMPK过表达质粒预处理的大鼠神经元OGD/R后,凋亡相关蛋白Caspase-3 mRNA显著上调(P<0.05),Caspase-3的活化形式cleaved Caspase-3蛋白表达以及Caspase-3活性显著升高(P<0.05)。此外,DNA片断含量明显升高(P<0.05,图4)。表明过表达AMPK可消除NaHS减轻OGD/R诱导的神经元细胞凋亡。

图4 AMPK过表达对NaHS减轻OGD/R诱导PC12细胞凋亡的影响(n=5)A:Caspase-3 mRNA表达B~C:cleaved-Capase-3蛋白表达D:Caspase-3活性检测结果E:DNA片段化结果*P<0.05,与control组相比**P<0.01,与control组相比Fig.4 The effect of AMPK over expression on the apoptosis of PC12 cellsreduced by NaHS(n=5)A:The expression of caspase-3 mRNA;B~C:The expression of caspase-3 protein;D:Result of the activity of caspase-3;E:Result of DNA fragment;*P<0.05,vs control group;**P<0.01,vs control group
3 讨论
脑组织缺血时神经元细胞经历氧糖剥夺,在血流恢复时神经元的氧糖供应也随之得以恢复,但在这个过程中,神经元发生了复杂的分子生物学改变。本研究在前期工作基础上,观察到大鼠神经元经历OGD/R后,胞内AMPK激活,从而抑制mTOR,最终导致自噬活性异常增强,诱导细胞损伤。而外源性H2S预处理,可减轻上述过程,体现出细胞保护效应。因此,本研究从细胞水平上阐述了H2S减轻OGD/R诱导的神经元损伤,丰富了H2S减轻脑卒中的分子机制。
AMPK是一个可表达在全身各器官细胞内,高度保守的能感应能量状态的感受器。当机体发生饥饿和缺氧等时,胞内AMP/ATP比例升高,AMPK则被激活,继而磷酸化下游蛋白以维持稳态。本研究观察到发生脑缺血再灌注时,神经元处于低氧和能量供给不足的状态,AMPK磷酸化水平增高,提示AMPK激活。研究报道心肌细胞发生OGD/R时,AMPK活性也发生改变[12]。但与本研究不同的是,采用激动剂激活AMPK可减轻OGD/R诱导的心肌细胞损伤[12],这可能与AMPK激活后下游分子事件存在差异有关。近期有研究报道,阻断H2S的内源性生成,可异常激活AMPK,导致OGD/R诱导的神经元发生内质网应激,加重细胞损伤[13],这进一步证实H2S能够抑制OGD/R时神经元AMPK的异常激活,从而减轻细胞损伤。
自噬在神经元中的作用存在双刃剑的效应。一定程度的自噬具有自我保护作用,例如自噬可清除受损伤的线粒体,维持胞内稳态[14]。然而,过度激活的自噬也参与大脑缺血再灌注损伤。Feng等[15,16]报道柚皮苷通过抑制线粒体自噬而减轻大脑缺血再灌注损伤。此外,右旋美托咪啶通过上调HIF-1α,抑制神经元自噬,从而减轻小鼠脑缺血再灌注损伤[17]。本组前期研究中观察到MCAO诱导的大鼠脑缺血再灌注损伤时,脑组织自噬活性异常增强[6],而在OGD/R处理的大鼠神经元中mTOR活性下降,提示异常增强的自噬可能是导致神经元损伤的重要机制。本研究也丰富了自噬在神经元缺血再灌注损伤中的作用。
脑组织缺血时神经细胞发生以凋亡为主的神经元死亡,文献显示减轻神经细胞凋亡可以有效降低脑梗死体积[18]。本研究观察到过表达AMPK可消除NaHS减轻OGD/R诱导的神经元细胞凋亡,提示NaHS可能通过激活AMPK减轻OGD/R诱导的神经元细胞凋亡。
H2S在神经系统中的内源性保护作用日益突显。例如,内源性H2S生成障碍可加剧帕金森病小鼠1-甲基-4-苯基-1,2,3,6-四氢吡啶诱导的神经元的损伤[4]。H2S可以通过降低氧化应激,抑制自噬性的神经元细胞死亡,从而减轻脊髓缺血再灌注损伤[19]。本组前期研究已证实外源性补充H2S可减轻MCAO诱导的大鼠脑缺血再灌注损伤[6]。因此,继续探讨H2S在多种神经系统疾病的代谢改变机制,明确内外源性H2S的保护作用和机制,可尽早实现H2S的临床运用。
综上所述,本实验从细胞水平证实了H2S可通过抑制AMPK活化,进而抑制缺血再灌注时大脑神经元过度的自噬,最终减轻神经元损伤。本实验揭示了H2S减轻大鼠脑缺血再灌注损伤的分子机制,为H2S的临床运用提供了可靠的实验依据。