布洛芬治疗动脉导管未闭的疗效及并发症研究
孙玄,陈玲,周建华,高金枝,胡晓琳
(华中科技大学同济医学院附属同济医院,湖北武汉 430030)
动脉导管未闭(patent ductus arteriosus,PDA)发病率与早产儿胎龄相关,国外研究指出,胎龄≥30 周早产儿PDA 发生率为10 %,而胎龄25~29 周早产儿PDA 发生率高达80%[1]。持续性PDA可导致早产儿血流动力学发生紊乱,产生一系列临床症状,称之为症状性动脉导管未闭(symptomatic patent ductus arteriosus, sPDA),使患儿住院时间延长,严重者甚至危及生命[2-3]。目前国内外研究对早产儿PDA 的管理仍存在许多争议,由于缺乏充足的循证医学证据,对早产儿的PDA是否应进行干预、何时何种方式干预仍不明确,早期积极性干预与症状性治疗的争议仍然存在[4-5]。吲哚美辛和布洛芬均为非选择性环氧合酶抑制剂,为目前临床上PDA一线治疗药物,文献报道布洛芬治疗PDA的成功率为70%~85%[6-7]。但目前少有研究探讨布洛芬对早产儿sPDA和非症状性动脉导管未闭(non-symptomatic patent ductus arteriosus, nsPDA)的疗效,及其对PDA相关并发症发生率的影响。本研究旨在比较布洛芬治疗早产儿sPDA和nsPDA的疗效,同时对药物治疗后各组患儿PDA相关并发症的发生情况进行分析,为临床治疗提供参考。
1 资料和方法
1.1 一般资料
选择2016年5月至2019年4月同济医院新生儿科收治的早产儿。纳入标准:(1)胎龄<34周,生后24 h内入住新生儿科;(2)于生后第1周末完善超声心动图检查并诊断为PDA;(3)临床资料完整。排除标准:(1)存在布洛芬用药禁忌证之一,如血小板减少症(血小板计数<50×109/L)、出血性疾病、少尿(每小时尿量<1 mL/kg)、血清肌酐升高(>1.8 mg/dL)、坏死性小肠结肠炎(necrotizing enterocolitis,NEC)或肠穿孔[8];(2)生后早期(1 周内)发生败血症、NEC 或死亡;(3)存在严重消化道或泌尿系统畸形、遗传代谢性疾病、染色体异常;(4)合并需维持动脉导管持续开放的严重先天性心脏病如法洛四联征等。研究期间共收治<34周早产儿1 044 例,其中252例生后第 1周诊断为PDA,纳入研究。本研究经医院伦理委员会批准实施,患儿家长均知情并签署知情同意书。
1.2 方法
1.2.1 sPDA诊断标准 具有以下6 项中3 项临床表现,同时符合超声心动图诊断标准[9]。临床表现:(1)胸骨左缘闻及收缩期或连续性杂音;(2)心前区搏动增强;(3)水冲脉;(4)安静时心率>180 次/分;(5)无法解释的呼吸状况恶化;(6)胸部X线片显示肺血管影增多及心脏扩大或肺水肿征象。超声心动图诊断标准:(1)左心房内径/主动脉内径≥1.5 mm;(2)肺动脉瓣舒张期返流;(3)动脉导管内径>1.5 mm。
1.2.2 分组及治疗方法 根据sPDA诊断标准将252例早产儿分为sPDA组94例和nsPDA组158例,nsPDA组根据住院期间是否接受过布洛芬治疗分为nsPDA-1组(92例)和nsPDA-2组(66例)。
治疗方法:sPDA 组和nsPDA-1 组患儿住院期间在诊断明确后均接受了口服布洛芬治疗,布洛芬(上海强生制药有限公司,布洛芬混悬滴剂15 mL,0.6 g)应用方法:首剂10 mg/kg,第2、3剂各5 mg/kg,口服,每日1次。且所有治疗患儿均于生后第1周末至第2周应用布洛芬,并于疗程结束后3 d内复查超声心动图。而nsPDA-2组早产儿在住院期间未给予药物关闭动脉导管,生后第2周末或出院前均已复查超声心动图。
1.3 观察指标
1.3.1 三组早产儿围产期情况 比较三组早产儿胎龄、出生体质量、性别、分娩方式、小于胎龄儿(small for gestational age, SGA)、胎膜早破>24 h及围产期窒息的发生情况等。
1.3.2 三组早产儿动脉导管关闭率 记录sPDA组和nsPDA-1组在接受口服布洛芬治疗后的动脉导管关闭情况,并与nsPDA-2组未接受布洛芬治疗动脉导管的关闭率进行比较。
1.3.3 三组早产儿PDA相关并发症的发生情况 记录三组早产儿诊断PDA后肺炎、支气管肺发育不良(bronchopulmonary dysplasia,BPD)、喂养不耐受、Bell 分期Ⅱ期以上NEC、颅内出血(intraventricular hemorrhage, IVH)及急性肾损伤等PDA 相关并发症发生情况。急性肾损伤诊断标准[10]:血清肌酐≥0.3 mg/dL或患儿血清肌酐最低值的150%,同时合并尿量减少[≤1 mL/(kg·h)]。喂养不耐受诊断需满足以下任意1项[11]:(1)频繁呕吐,每天超过3 次以上;(2)奶量不增或减少,持续3 d以上;(3)胃残余量超过上次喂养量的1/3或24 h胃残余量超过总喂养量的1/4;(4)腹胀,24 h腹围增加>1.5 cm伴有肠型;(5)胃内咖啡物,大便潜血阳性,第2周末每次喂入量<8 mL/kg。BPD、NEC 和IVH 诊断标准参照《实用新生儿学》第5 版诊断标准[10]。
1.4 统计学方法
应用SPSS 23.0 统计软件。计量资料均进行正态性检验,不服从正态分布的数据采用M(Q1,Q3)描述,三组组间比较采用多个独立样本非参数检验Kruskal-Wallis 法。计数资料采用百分数描述,三组组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 三组早产儿围产期情况比较
sPDA组患儿胎龄和出生体质量小于nsPDA-1组和nsPDA-2组(P<0.05),但nsPDA-1组和nsPDA-2组患儿胎龄和出生体质量比较差异无统计学意义(P>0.05)。三组早产儿分娩方式、SGA、胎膜早破>24 h、围产期窒息的发生率比较差异无统计学意义(P>0.05)。见表1。
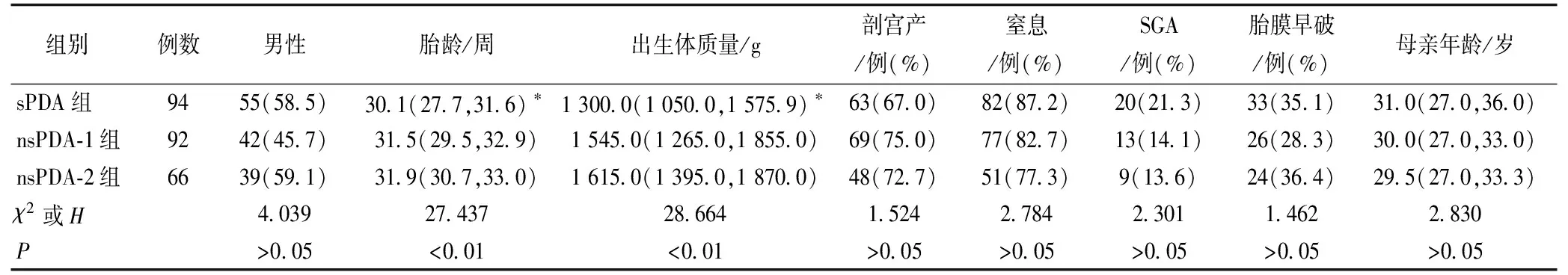
表1 三组早产儿围产期情况比较
2.2 三组早产儿动脉导管关闭率
口服布洛芬疗程结束后,sPDA组52例患儿动脉导管关闭,关闭率为55.3%;nsPDA-1组81例患儿动脉导管关闭,关闭率为88.0%;nsPDA-2组复查超声心动图54例患儿动脉导管自然关闭,关闭率为81.8%。三组患儿比较差异有统计学意义(P<0.05);sPDA组关闭率显著低于nsPDA-1组和nsPDA-2组(P<0.05),但nsPDA-1组和nsPDA-2组组间关闭率比较差异无统计学意义(P>0.05)。
2.3 药物治疗后三组患儿PDA 相关并发症发生情况比较
三组早产儿肺炎、BPD、喂养不耐受、NEC、IVH 及肾损伤发生率比较差异均有统计学意义(P<0.05)。sPDA 组肺炎、BPD、喂养不耐受、NEC 及IVH 的发生率高于nsPDA-1 组和nsPDA-2 组(P<0.05),而nsPDA-1组和nsPDA-2组上述PDA并发症发生率比较差异无统计学意义(P>0.05);sPDA 组和nsPDA-1 组的肾损伤发生率比较差异无统计学意义(P>0.05),但均高于nsPDA-2 组(P<0.05)。见表2。
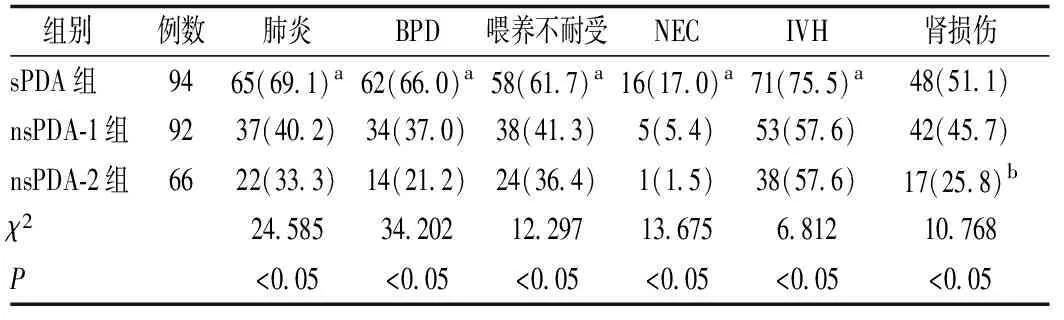
表2 药物治疗后三组患儿PDA相关并发症的比较 例(%)
3 讨论
动脉导管未闭是早产儿的常见疾病,当通过动脉导管的左向右分流引起机体血流动力学紊乱,并出现一系列临床症状时,称为症状性动脉导管未闭(sPDA)。本研究结果提示,sPDA组患儿胎龄及出生体质量均小于nsPDA-1组和nsPDA-2组,差异有统计学意义(P<0.05)。胎龄越小,早产儿各器官系统发育越不成熟,持续的动脉导管未闭更易导致血流动力学紊乱,并产生临床症状,使sPDA发生率增加。Dani C等[12]研究指出,胎龄越小早产儿,PDA发生血流动力学紊乱的比例越高,胎龄23~24 周、25~28 周早产儿发生sPDA的比例分别为70%和59%。因此,对于胎龄较小的早产儿,PDA持续存在应引起临床高度重视,避免发展为sPDA。
目前国内外研究对早产儿PDA的治疗时机和治疗药物选择仍存在较大争议。本研究选用目前临床上较为常用的布洛芬作为PDA治疗药物,不少研究表明布洛芬和吲哚美辛在治疗早产儿PDA方面的有效性相似,但布洛芬不良反应更少[13-15]。本研究结果显示布洛芬治疗疗程结束后,sPDA组动脉导管关闭率明显低于nsPDA-1组,而nsPDA-1组口服布洛芬后PDA关闭率与nsPDA-2组自然关闭率比较差异无统计学意义。因此,当早产儿PDA存在临床症状时,药物治疗效果较差。Liebowitz M 等[16]的研究指出,早产儿PDA延迟性药物治疗较预防性药物治疗动脉导管关闭率显著降低,PDA持续时间明显延长。Conrad C等[17]也认为,当PDA出现临床症状时再予药物治疗,患儿动脉导管关闭率较低。此外Dani C等[12]提示,胎龄越小,药物治疗血流动力学紊乱PDA的失败率更高。而本研究sPDA组早产儿胎龄和出生体质量均明显小于nsPDA-1组,提示小胎龄和低出生体质量也可能影响PDA治疗成功率。因此,由于sPDA组早产儿药物疗效较差,对于胎龄越小、出生体质量越低的早产儿,应在出现临床症状前尽早给予药物干预PDA,以提高治疗成功率;对于胎龄较大的nsPDA患儿,由于药物治疗与保守治疗效果无明显差异,可优先选择综合干预措施来促进动脉导管关闭。
早产儿生后动脉导管持续开放早期即可出现明显的左向右分流,导致肺循环血流量增加,易于发生肺充血、肺水肿甚至呼吸衰竭。El-Khuffash A等[18]指出,动脉导管分流量越大,BPD发生的风险越高。此外,Schena F等[19]也指出,sPDA持续时间每增加1周,BPD发生率增加约70%。动脉导管分流引起体循环血流量减少,可导致重要脏器如肠、肾和脑血流灌注不足,最终导致一系列并发症,如喂养不耐受、NEC、肾功能受损、IVH、脑室旁白质软化(PVL)和脑瘫等[20-21]。本研究指出,经过药物治疗后,sPDA组患儿肺炎、BPD、喂养不耐受、NEC及IVH的发生率均高于nsPDA-1组和nsPDA-2组,而nsPDA-1组与nsPDA-2组早产儿上述并发症发生率比较差异无统计学意义(P>0.05),提示sPDA早产儿经口服布洛芬治疗后各种并发症发生率仍较nsPDA 早产儿高,口服布洛芬治疗并不能降低sPDA患儿相关并发症的发生率。研究指出,sPDA或延迟性药物治疗可导致相关并发症如肺出血、重度IVH、慢性肺部疾病、脑血流紊乱及心力衰竭等发生率明显升高[22]。Kluckow M等[23]选择胎龄<29周的早产儿,于生后12 h内完善超声心动图诊断PDA后立即给予吲哚美辛治疗,结果发现,生后早期吲哚美辛治疗较出现症状后药物治疗可显著降低肺出血和IVH的发生率。因此,由于sPDA药物治疗并发症发生率较高,对于早产儿尤其是胎龄较小的早产儿,sPDA应重视早发现、早治疗,尽可能避免更多、更严重的并发症发生。此外,本研究证实,sPDA组和nsPDA-1组的肾损伤发生率比较差异无统计学意义,但均显著高于nsPDA-2组。布洛芬作为非选择性环氧化酶抑制剂,血管收缩作用显著,可导致肾脏血供减少,从而发生少尿、肾损伤甚至肾衰竭[14],因此在口服布洛芬治疗PDA的同时需密切监测患儿尿量及肾功能的变化。
综上所述,本研究认为胎龄及出生体质量越小的早产儿,sPDA发生率越高;sPDA早产儿出生1周后口服布洛芬治疗其疗效低于nsPDA患儿,并较后者更容易出现相关并发症(肺炎、BPD、喂养不耐受、NEC 及IVH)。提示胎龄越小、体质量越低早产儿发生sPDA的风险越高,故应考虑尽早给予药物及综合干预措施来促进动脉导管关闭,提高极早早产儿的存活率和降低远期并发症发生率。

