丹参酮ⅡA在低氧诱导肺动脉高压中的保护作用
刘礼姣,邱庆竹,郑均敏,谢利剑
(上海交通大学附属儿童医院,上海市儿童医院,上海 200062)
肺动脉高压(PAH)是一种病因复杂、高致死性进行性的心血管疾病,主要表现为逐渐升高的肺动脉压力,最终可导致肺血管重构、右心室肥大和功能衰竭,甚至死亡[1]。肺动脉细胞尤其是肺动脉平滑肌细胞(pulmo-nary aterial smooth muscle cells,PASMCs)无序增殖增加和凋亡减少引起的肺血管重塑是PAH发生发展的重要病理基础[2]。目前,临床上广泛应用的靶向药物治疗,如前列环素类、内皮素受体拮抗剂、磷酸二酯酶抑制剂等不能从根本上逆转肺血管重构,对PAH的疗效并不理想,因此,关于PAH的临床诊治依然极具挑战性。
丹参酮ⅡA(tanshinone ⅡA,TanⅡA)是丹参中含量丰富的脂溶性活性药理成分,具有扩张冠状动脉血管、改善微循环、保护心脏、减少和清除血小板聚集、增强机体抗缺氧能力、拮抗脂质过氧化和清除自由基等重要作用。研究[3-5]发现,Tan Ⅱ A通过促进肿瘤细胞凋亡及影响其自噬与增殖发挥良好的抗肿瘤活性。Tan Ⅱ A通过降低细胞周期蛋白依赖性激酶抑制剂P27蛋白降解,使细胞周期停止在G0/G1期,抑制PASMCs增殖,但Tan Ⅱ A对PASMCs自噬与凋亡的影响目前尚不明确[6]。研究[7]显示,经典的抗凋亡通路磷脂酰肌醇-3激酶/丝氨酸/苏氨酸蛋白激酶(phosphatidylinositol-3-kinase/Akt,PI3K/Akt)在自噬中也发挥着重要调控作用。因此,本研究通过建立低氧诱导PAH小鼠及细胞模型,分析TanⅡA对PAH的治疗作用,并初步探讨TanⅡA对低氧诱导的PAH中PI3K/Akt信号通路及自噬和凋亡的影响。
1 材料和方法
1.1 试剂和仪器
C57BL6雄性小鼠15只(8周龄,体质量22~25 g,上海SLAC实验动物有限公司),TanⅡA(10 mg,纯度≥97%,美国Sigma,加入1 mL二甲基亚砜将其充分溶解,配制成浓度为10 mg/mL的原液),二甲基亚砜(DMSO,美国Sigma),BCA蛋白浓度检测试剂盒(北京BLKW Biotechnology),RIPA裂解液、总超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒、脂质氧化(MDA)检测试剂盒(上海碧云天生物技术公司),常压低氧实验箱(长沙长锦科技有限公司),测氧仪(浙江建德电化学仪器厂),PowerLab Systerm电生理信号采集仪、聚乙烯导管(AD Instruments 公司),人肺动脉平滑肌细胞(hPASMCs,美国Sciencell),平滑肌细胞培养基、平滑肌细胞生长因子、青霉素/链霉素溶液(双抗,美国Sciencell),胎牛血清(北京Solarbio),无酚红细胞培养基(DMEM,美国Gibco),胰蛋白酶消化液(北京Solarbio),聚丙烯酰胺凝胶预混液(上海碧云天生物技术公司),预染蛋白Marker(美国Thermo Fisher),Loading Buffer及ECL化学发光试剂盒(新赛美生物科技公司),兔抗鼠磷酸甘油醛脱氢酶(GAPDH)多克隆抗体(英国CST),兔抗鼠Bax多克隆抗体(一抗,美国Proteintech Group),兔抗鼠P62抗体(一抗,美国CST公司),兔抗鼠Akt抗体(一抗)及兔抗鼠磷酸化Akt(Phosphorylated-Akt,P-Akt)抗体(一抗,美国CST公司),辣根过氧化酶标记二抗(山羊抗兔,英国CST公司),二氧化碳培养箱(日本SANYO),三气培养箱(美国Thermo Scientific)。
1.2 实验方法
1.2.1 低氧动物模型建立及分组 取15只8周龄C57BL6雄性小鼠,体质量22~25 g,适应性饲养1周后,随机分为3组:常氧组(n=5)、低氧组(n=5)和低氧+TanⅡA组(n=5)。常氧组呼吸正常空气,低氧组和低氧+TanⅡA组置于常压低氧箱内,采用测氧仪监测使箱内氧浓度维持在10.0%±0.5%,石灰钠和无水氯化钙吸收箱内过量的CO2及水蒸气,将CO2浓度控制在0.5%以内,每天低氧24 h,连续2周。2周后低氧+TanⅡA组每天腹腔注射TanⅡA 10 mg/(kg·d),其他两组小鼠腹腔注射磷酸盐缓冲液(phosphate buffered saline,PBS),连续2周,2周中低氧组和低氧+TanⅡA组继续置于低氧环境中,在4周造模过程中3组小鼠均置于同一房间内,饲养条件相同,每天均自由进食及饮水。
1.2.2 小鼠右心室压力测定、取材及肺组织病理学观察 4周造模结束后称量小鼠质量,腹腔注射1%戊巴比妥钠(10 μL/g)使小鼠麻醉,待其进入麻醉状态后,取仰卧位用细线固定四肢及门牙在解剖台上,颈部皮肤消毒后进行颈部正中切口,逐层钝性分离肌肉、结缔组织,游离右侧颈外静脉,结扎远心端,动脉夹夹闭近心端,用聚乙烯导管(导管内充满0.5%肝素溶液,抗凝血)行右侧颈外静脉插管术,固定导管,导管另一端经压力换能器与Power Lab 电生理信号采集仪相连,记录右心室收缩压(RVSP)。测压结束后,对小鼠胸腹部皮肤消毒,迅速打开胸腔,充分暴露心、肺等脏器,取装有适量磷酸盐缓冲溶液(PBS)的5 mL注射器,用针头迅速刺入右心室,缓慢注入PBS进行灌流,然后小心分离心、肺。其中右肺放置于无酶冻存管中后立即置于液氮罐内快速冷却,随后置于-80 ℃低温冰箱内保存,用于后续检测实验,左肺以4%甲醛溶液固定24 h后,行病理切片及苏木精伊红染色法(HE)染色。
1.2.3 小鼠肺组织中氧化应激相关产物检测 取-80 ℃低温冰箱中冷冻备用的肺组织适量,采用预冷生理盐水冲洗除去血液,吸水纸吸干称质量后迅速置于1.5 mL无菌EP管中,加入适量RIPA裂解液(肺组织质量占裂解液比例为10%),采用超声波细胞破碎仪充分磨碎后再静置裂解10 min(以上操作均在冰上进行),10 min后10%肺组织匀浆于4 ℃离心,12 000 r/min,离心10 min,然后取上清液并转移至新标记好的1.5 mL EP管内,采用BCA蛋白检测试剂盒测定上清液蛋白浓度。参照试剂盒说明书,分别采用硫代巴比妥酸(TBA)法测定小鼠肺组织MDA水平,WST-8法测定小鼠肺组织中总SOD活性。
1.2.4 PASMCs培养 PASMCs采用配制好的hPASMCs培养基(由基础平滑肌培养液、2.0%胎牛血清、0.5%平滑肌细胞生长因子和0.5%青霉素/链霉素双抗混合制成)培养,每2天换液1次,待细胞生长达80%~90%,以0.25%胰蛋白酶消化分散细胞,离心后重悬,并进行传代培养,传代培养至第2~5代细胞即可用于后续实验。将实验细胞接种于培养皿中,采用不含胎牛血清的无酚红DMEM培养基培养24 h,待细胞同步化后随机分成常氧组(n=3)、低氧组(n=3)、低氧+TanⅡA组(n=3),TanⅡA浓度参照文献[8]设定为5 μg/mL,每组设置3个复孔,其中常氧组置于37 ℃、5%CO2、95%空气的培养箱内培养24 h;低氧组和低氧+TanⅡA组放置于3%O2、5%CO2、95%N2低氧培养箱内培养24 h。
1.2.5 免疫印迹法(WB)检测Bax、P62及P-Akt及Akt表达 24 h培养结束后,将预冷好的PBS溶液适量加入“1.2.4”项下3组细胞培养皿中,轻轻摇动培养皿后弃去PBS,以上过程重复3次。洗净培养皿内原培养液后,每个培养皿中加入适量含苯甲基磺酰氧(PMSF)的RIPA裂解液(1 mL裂解液中加入10 μL PMSF),摇匀后置于冰上裂解30 min,采用洁净的细胞刮轻轻将细胞完全收刮于培养皿一侧,并用移液枪转移至已标记好的1.5 mL EP管内,整个过程在冰上操作。将含有细胞裂解蛋白的EP管放入预冷好的离心机内离心15 min,4 ℃,12 000 r/min,取上清液转移至新的1.5 mL EP管内做好标记置于冰上。取上述上清液适量,采用蒸馏水稀释12.5倍后进行蛋白浓度测定。取50 μg蛋白样品,10%十二烷基硫酸钠聚丙烯酰胺(SDS-PAGE)凝胶电泳,200 mA恒流转膜适当时间,将目的蛋白转移至聚偏二氧乙烯(PVDF)膜上,裁膜后在常温摇床上5% BSA封闭缓冲液中封闭1 h,后将条带分别浸于Bax(1∶2 000)、P62(1∶1 000)、Akt(1∶1 000)、P-Akt(1∶2 000)的一抗稀释液中4 ℃冰箱内孵育过夜。洗膜3次,每次10 min,常温下辣根过氧化物酶标记山羊抗兔IgG二抗稀释液中孵育1 h,再洗膜3次,每次10 min。显色液显色后转至暗箱内进行化学发光显影,应用Image J软件分析各目的蛋白及内参GAPDH的灰度值,两者灰度值的比值作为目的蛋白的相对表达量。
1.3 统计学方法
2 结果
2.1 TanⅡA对3组小鼠RVSP的影响
4周造模结束后,低氧组小鼠意外死亡1只,常氧组及低氧+TanⅡA组小鼠均成功存活。右心导管测压结果显示,与常氧组比较,低氧组小鼠RVSP增加(t=9.149,P<0.05);与低氧组比较,低氧+TanⅡA组RVSP降低(t=2.963,P<0.05)。见表1。

表1 TanⅡA对3组小鼠RVSP的影响
2.2 HE染色下3组小鼠肺组织病理学改变比较
常氧组小鼠肺组织结构正常,肺小动脉具有完整内膜及正常平滑肌肌层组织,管壁周围几乎无炎症细胞浸润。与常氧组比较,低氧组可见肺小动脉内膜不光滑,管壁和平滑肌肌层组织增厚,血管腔减小,管壁周围可见大量炎细胞浸润。与低氧组比较,低氧+TanⅡA组病理改变减轻,肺小动脉内膜不光滑,管壁和平滑肌肌层组织有一定程度增厚,血管腔减小,管壁周围炎细胞浸润减少,见图1。
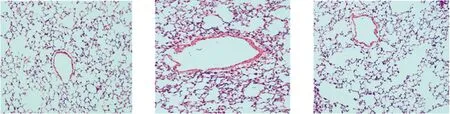
常氧组 低氧组 低氧+TanⅡA组
2.3 3组小鼠肺组织中MDA含量及SOD活性变化比较
与常氧组比较,低氧组小鼠肺组织中MDA含量增加,SOD活性下降(t分别为3.164及4.446,P均<0.05)。与低氧组比较,低氧+TanⅡA组小鼠肺组织中MDA含量减少,SOD活性增加(t分别为2.306及3.058,P均<0.05)。见表2。

表2 3组小鼠肺组织中MDA含量及SOD活性变化比较 mg/prot
2.4 3组PASMCs中Bax、P62及PI3K/Akt信号通路中P-Akt蛋白表达水平比较
与常氧组比较,低氧组PASMCs中Bax蛋白表达降低,P62蛋白表达增加(t分别为47.930、19.110,P均<0.05);与低氧组比较,低氧+TanⅡA组PASMCs中Bax蛋白表达增加,P62蛋白表达降低(t分别为4.218、8.700,P均<0.05)。与常氧组比较,低氧组PASMCs中P-Akt/Akt值增加(t=7.463,P<0.05)。常氧组与低氧+Tan Ⅱ A组P-Akt/Akt值比较差异无统计学意义(t=0.266,P>0.05)。与低氧组比较,低氧+TanⅡA组PASMCs中P-Akt/Akt值降低(t=6.906,P<0.05)。见表3。
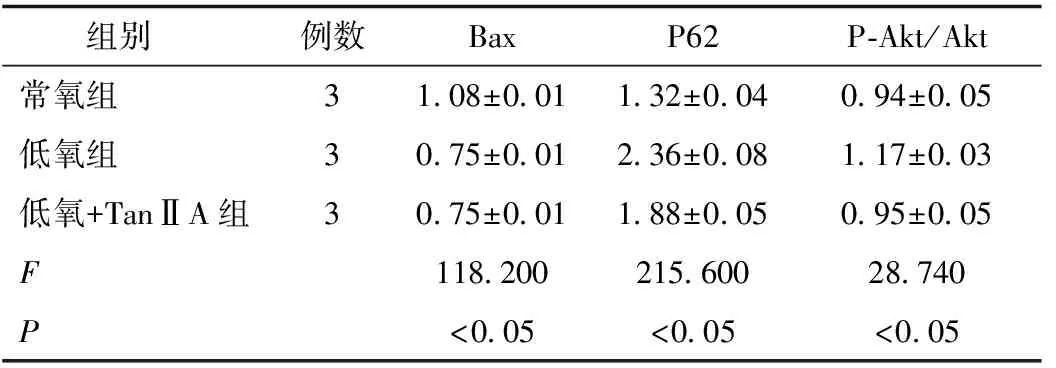
表3 3组PASMCs中Bax、P62及PI3K/Akt信号通路中P-Akt蛋白表达水平比较
3 讨论
PAH是一个发病机制复杂、起病隐匿的全球性健康问题,在任何年龄段均可发生,流行病学显示,全球PAH发病率约1%[8]。异常增高的肺血管阻力和肺动脉压力为PAH的主要特征,这种压力的持续增高与血管周围炎症反应、PASMCs增殖异常、肺血管重塑以及血管异常收缩等多种因素相关[9-10]。PAH的定义为平均肺动脉压>25 mm Hg,正常肺毛细血管楔压<15 mm Hg,且肺血管阻力>3 WU,目前诊断肺动脉高压金标准是右心导管检查[11]。
本研究采用慢性低氧性PAH模型,选用体型较小,遗传稳定性较高的C57BL6小鼠,这种模型是基于薛全福等[12]的研究方法加以改造。低氧性PAH主要病理生理特征是肺血管收缩和肺血管重构[13]。本研究结果显示,随着低氧时间延长,低氧组小鼠进食量、进水量、活动量减少,精神状态逐渐变差,但低氧组体质量较常氧组改变不明显;肺组织切片HE染色结果提示,与常氧组比较,低氧组肺血管壁和平滑肌肌层组织增厚、血管腔减小、管壁周围大量炎性细胞浸润,提示低氧导致肺血管重构,与国外低氧建立小鼠PAH模型结果相似[14]。基于本课题组前期造模方法[15]及右心导管测压、肺组织HE染色结果,本研究低氧诱导的小鼠PAH模型成功建立。同时,肺组织切片HE染色结果提示,与低氧组比较,低氧+TanⅡA组管壁和平滑肌肌层组织增厚程度减轻、管壁周围炎细胞浸润减少。右心导管测压结果显示,与常氧组比较,低氧组小鼠RVSP增加;与低氧组比较,低氧+TanⅡA组RVSP降低,表明TanⅡA可改善低氧状态下的肺血管重塑,减轻低氧PAH中右心室收缩压。本研究结果显示,低氧组小鼠肺组织中SOD活性较常氧组下降,而MDA含量增加,低氧+TanⅡA组小鼠肺组织中SOD活性较低氧组增加,MDA含量降低,提示TanⅡA减少低氧PAH中氧化应激水平,与既往研究[16]结果一致。有研究[17]显示,氧化应激在PAH发生发展中发挥着十分重要的作用。在PAH中,SOD活性下降,氧自由基清除能力下降,MDA含量增加,并与氧自由基等物质结合,促进PASMCs异常增殖,加重肺动脉内皮损伤,同时通过激活基质金属蛋白酶(MMP)参与细胞外基质沉积,促进肺血管重构。因此,本研究中TanⅡA通过降低PAH中氧化应激水平,减轻低氧PAH中肺血管重构,达到治疗PAH的作用。
早在1891年,Romberg E等[18]提出PAH患者肺部血管存在闭塞性病变和中层增厚现象,ARCHER S L等[19-21]先后使用来源于PAH患者的原代细胞模型或动物模型的数据证明,PAH中PASMCs、肺动脉内皮细胞(PAECs)和成纤维细胞中均存在一种增殖失衡,凋亡抵抗的类癌现象。He Y等[22]通过体外低氧条件下原代PASMCs培养发现低氧组PASMCs中Bax表达低于常氧组。Yang C等[23]在低氧诱导PAH大鼠实验中发现,与对照组比较,低氧组肺组织中细胞凋亡指数下降,通过逆转录-聚合酶链反应(RT-PCR)检测mRNA表达水平发现低氧组肺组织中Bcl-2表达高于对照组,而Bax表达低于对照组。Lu J Y等[24]在研究Na+/H+交换器-1(NHE-1)抑制剂时发现,NHE-1抑制通过阻止低氧时PASMCs的Ca2+增加,导致Bcl-2表达降低及Bax表达增加从而诱导和促进低氧培养下的PASMCs凋亡,表明低氧抑制Bax/Bcl-2值增加的促凋亡作用。本研究结果显示,低氧组PASMCs中Bax表达低于常氧组,与Lu J Y等[24]研究一致,低氧环境下PASMCs凋亡减少。本研究结果表明,与低氧组比较,低氧+Tan Ⅱ A组PASMCs中Bax表达增加,提示Tan Ⅱ A通过改善低氧诱导下Bax/Bcl-2值的降低,部分逆转低氧诱导的PAH中PASMCs凋亡的减少,从而发挥减少低氧PAH中肺血管重构的作用。
自噬与凋亡是维持自身稳态的重要生理过程。自噬失调参与多种疾病的发生,近年来自噬在PAH中的作用也被广泛研究[25-27],但目前自噬在PAH的确切作用尚不明确。有研究[28]显示,激活自噬在PASMCs的作用是促增殖的促生存机制,促进肺血管重构。同时,有研究[29-31]发现,自噬在PAH患者和缺氧诱导的PAH大鼠及小鼠模型的PASMCs表达增加,自噬标记蛋白LC3 Ⅱ / Ⅰ值增加,P62蛋白表达下调。本研究结果显示,低氧组PASMCs中P62蛋白表达较常氧组增加,与Li L等[30]研究结果不一致,可能的原因为:(1)P62表达水平与细胞密度相关[32],因此,细胞培养初始接种的细胞密度可能影响P62的表达差异;(2)氧化损伤可激活红系衍生的核因子2相关因子(Nrf2)上调P62蛋白的表达保护血管平滑肌细胞[33];(3)可能与PAH中自噬呈现动态变化过程有关[34];(4)其他实验条件的不同也可能引起差异(如氧浓度等)。此外,本研究结果显示,低氧+TanⅡA组PASMCs中P62蛋白表达较低氧组降低,表明TanⅡA显著抑制低氧条件下PASMCs中P62蛋白的表达。
PI3K/Akt信号转导通路广泛存在于细胞中,参与细胞生长、增殖、分化等多种生理活动。有研究[35]表明,缺氧激活PI3K/Akt信号通路,活化的PI3K作用于膜上磷脂产生第二信使,然后使丝氨酸/苏氨酸激酶活化,活化后的Akt从细胞质转移到细胞膜上,通过磷酸化作用激活或抑制其下游靶蛋白,包括Bcl-2家族蛋白、半胱氨酸天冬氨酸蛋白酶9(Caspase 9)等,并通过这些蛋白调节细胞的增殖、凋亡及迁移等。如依赖PI3K的Akt激活后可使Bax、丝氨酸(Ser)184残基磷酸化从而导致Bax失活,同时使Bad的Ser136/Serl12残基磷酸化,导致Bad与Bcl-2解聚,解聚后的Bad与抗凋亡结合蛋白14-3-3结合,而解聚后的Bcl-2则发挥抗凋亡作用,从而抑制细胞凋亡[36]。
此外,PI3K/Akt通路参与肺动脉高压中肺血管重构及其进展。Fan Z等[37]指出PI3K/Akt通路参与肺动脉高压中PASMCs细胞骨架重排和表型转换,而PASMCs表型转换在肺动脉高压进展中发挥着重要作用[38]。Chai X等[39]发现,低氧通过激活PI3K/Akt信号通路诱导PAH大鼠肺动脉成纤维细胞增殖、迁移和分化及低氧性肺血管重构。Xia X D等[40]应用PI3K抑制剂及赖氨酸氧化酶抑制剂,可有效抑制低氧诱导的大鼠肺动脉压力升高及肺血管重构。本研究结果显示,低氧组PASMCs中P-Akt/Akt值高于常氧组,表明低氧激活PAH中PI3K/Akt信号通路,与既往研究结果一致[22,40]。低氧+TanⅡA组PASMCs中P-Akt/Akt值较低氧组降低,提示TanⅡA抑制低氧诱导下PAH中PI3K/Akt信号通路的激活,同时本研究中低氧+TanⅡA组PASMCs中Bax表达较低氧组增加,结合前文所述,缺氧激活PI3K/Akt信号通路调节细胞凋亡,因此考虑TanⅡA可能通过抑制低氧诱导下PI3K/Akt信号通路的激活,使促凋亡蛋白Bax失活减少,从而部分逆转低氧状态下PASMCs凋亡减少,改善低氧PAH中肺血管重构。
综上所述,TanⅡA具有保护低氧PAH的作用,可能与TanⅡA减轻低氧PAH中氧化应激水平及抑制低氧PASMCs中PI3K/Akt信号通路的激活,部分逆转低氧状态下PASMCs凋亡的减少,改善PAH中肺血管重构有关。本研究可为临床应用TanⅡA治疗PAH提供参考。

