超声-MRI融合导航技术在神经外科手术中价值的初步探讨
胡 星 王 涌 吕仁华 杨柳松 徐 荣 顾宇翔
MRI神经导航从1986年首次应用于临床后,现已广泛应用于神经外科手术中。其拥有良好的软组织分辨率,且不受气体、骨骼影响,术中对病灶进行定位和引导,可提高手术的准确性和安全性[1]。但神经导航使用的是术前影像资料,由于术中随着颅骨的打开、脑脊液的流失,病灶不可避免地会发生脑移位,造成导航定位的偏差,尤其一些体积小的病灶会出现导航失败而无法找到病灶。术中超声具有实时性,不存在脑漂移现象,但其较低的软组织分辨率限制了临床应用。而超声-MRI融合导航技术能结合二者的优点,最早由Roberts于1986年首次应用于神经外科术中定位[2]。近年来,超声-MRI融合导航技术有了长足进步,可以非常便捷地将MRI的高空间分辨率和超声的实时性进行互补,显示出广阔的应用前景[3]。常规超声对于颅脑是盲区,超声-MRI融合导航技术弥补了常规超声的不足,使得病灶于术前得以显现、精确定位。此外,由于超声实时性的特点,可动态跟踪手术进程,并通过瘤腔和术前MRI融合图像,指导手术切除方向,为精准切除病灶提供保证。
方 法
1.研究对象
纳入2018年1月—2018年12月在我院神经外科进行手术的患者,其中试验组34例,为超声-MRI融合导航组,对照组62例,为MRI神经导航组。所有患者均为单发病灶,均经过术后病理证实。
2.仪器与设备
超声机型:百胜公司(ESAOTE SPA;Milan,Lombardy,Italy)MayLab Twice。超声探头:浅表探头La332,频率3~11 MHz,直径5 cm;小微凸探头SC3123,频率3~9 MHz,直径4 cm。磁共振导航机型:美敦力公司 (Medtronic Inc.;Niapolis,Minnesota,USA)Medtronic StealthStation-S7。磁共振机型:美国通用电气公司(General Electric Company;Boston,Massachusetts,USA)GE Signa HDxt 3.0T。CT机型:东芝公司(Toshiba;Tokyo Port Area,Japan)TOSHIBA Aquilion tsx-101A 64排。
3.检查方法
3.1 MRI神经导航和超声-MRI融合导航
术前患者头颅体表标记6~10个进行常规磁共振增强(造影剂:钆喷酸葡胺注射液)扫描(图1A),图像刻入光盘,并将DICOM图像分别导入磁共振导航(图1B)和超声-MRI融合导航系统(图1C),根据术前影像信息勾画手术的体表边界,并以此作为拟开颅范围。
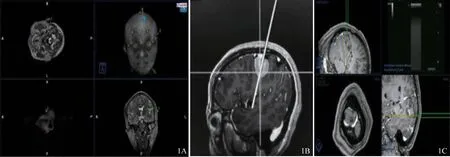
图1 术前导航和拟开颅范围
3.2 术中脑漂移纠正(图2)

图2 超声-MRI融合导航校正脑漂移
随着颅骨和硬脑膜的打开,脑脊液的流失,病灶在MRI神经导航上会发生程度不同的漂移。术中超声具有实时性,试验组应用Fine Tuning功能,通过平移、旋转超声图像,消除脑漂移,使术中超声图像和术前MRI增强图像重新匹配,并测量各病灶的漂移距离和病灶中心距离脑表面的深度,分析病灶漂移距离和深度之间的相关性。
3.3 超声-MRI融合导航判断病灶残余
病灶切除后超声实时图像与术前MRI增强图像的同一切面相融合,通过观察瘤腔与术前瘤体的吻合程度,判断病灶切除程度(图3)。以手术后即刻CT为参照,比较试验组和对照组病灶残余阳性率的差异。
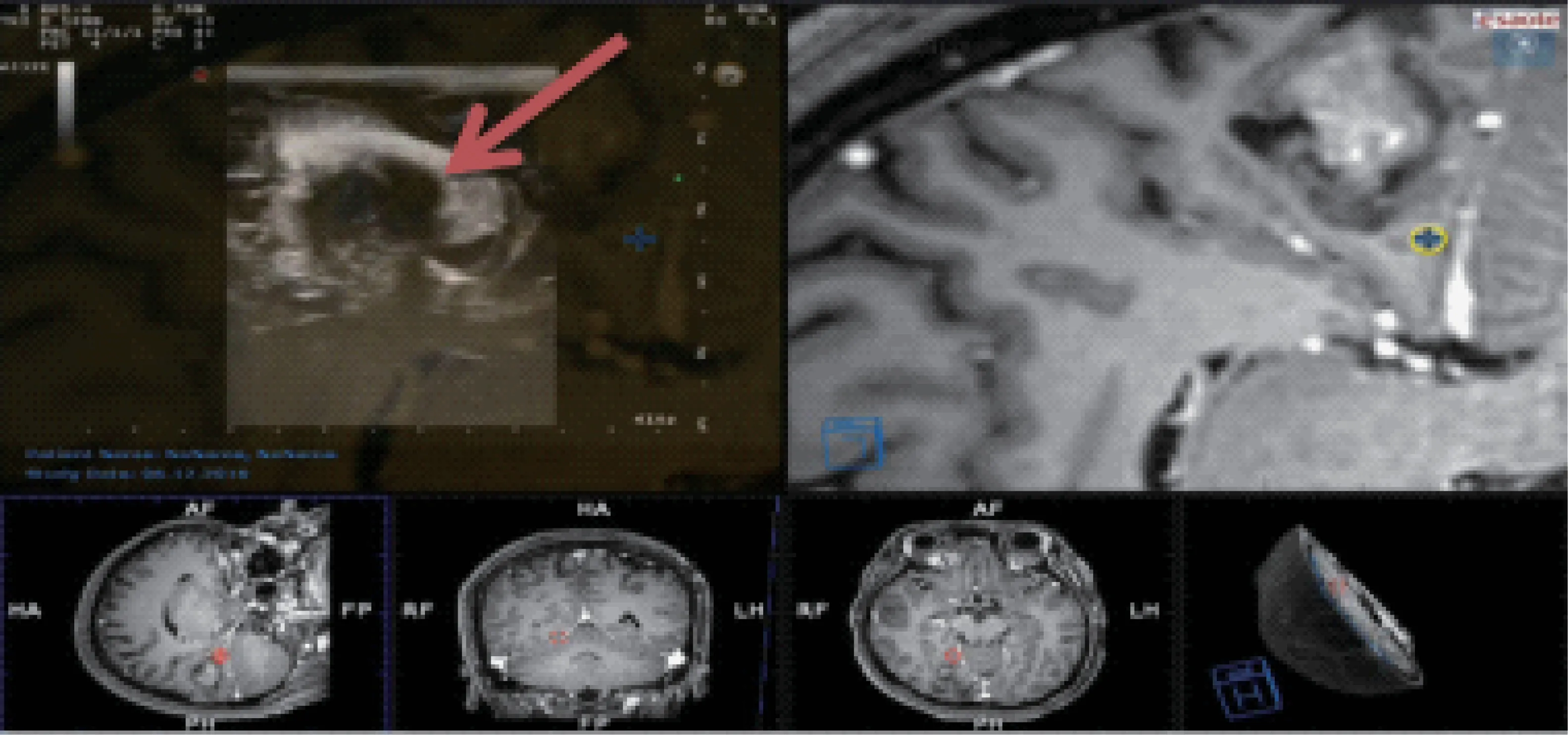
图3 术后超声-MRI融合对残余病灶评估(瘤腔边缘呈厚壁环状高回声,红箭所指)
4.判定标准和定量测定
对所有患者均依据术后即刻CT观察病灶有无残留。判定标准[4-5]:①术后CT对比术前CT或MRI增强图像,同一平面对照;②术后即刻CT观察手术切缘(是否有结节,异常实质性密度),必要时待出血或气体吸收后观察图像;③对于形态不规则肿块,必须多个平面综合分析。
5.统计学分析
采用SPSS 19.0统计软件进行分析,P<0.05为有统计学意义判定标准,计量资料均以xˉ±s表示,组间比较采用χ²检验,计数资料采用回归法分析相关性。
结 果
1.试验组和对照组一般情况
试验组男性18例 (52.9%),女性16例(47.1%),对照组男性29例(46.8%),女性33例(53.2%);试验组年龄22~71岁,平均 (59.8±4.3)岁,对照组年龄18~71岁,平均(49.8±3.3)岁。病灶分布、大小、深度和病理结果比较见表1、2。经卡方检验和方差分析,试验组和对照组之间性别,年龄,病灶分布、大小、深度和病理结果的差异均无统计学意义(P>0.05)。
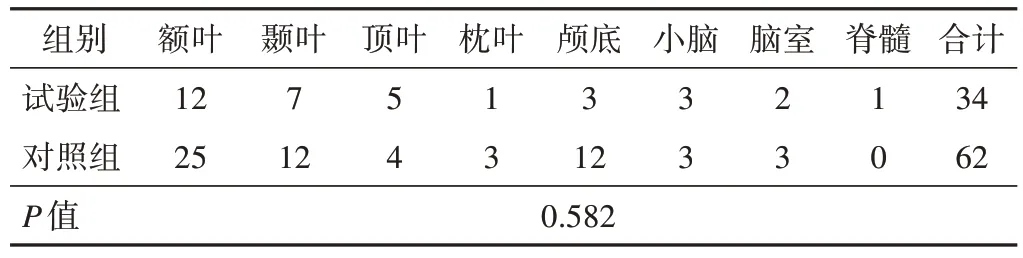
表1 病灶分布比较
2.试验组患者病灶深度与漂移距离相关性分析
以患者病灶深度为横坐标,漂移距离为纵坐标,绘制散点图(图4),并根据散点走形趋势,计算两者相关性。经回归分析,得出病灶深度与漂移距离呈明显负相关(r=-0.918,P<0.05)。

图4 试验组患者病灶深度与漂移距离关系
3.试验组和对照组术后切缘判定与CT符合率比较
术中切缘的准确判断对病灶的完整切除起到决定性作用。本研究试验组中良性病灶16例,恶性病灶18例;对照组中良性病灶32例,恶性病灶30例。试验组中29例经超声-MRI融合诊断均判断为切缘阴性,2例有残留(图5),与术后CT诊断结果一致;另有3例CT显示有肿瘤残余,但融合诊断漏诊。对照组中41例与术后CT诊断结果一致,21例CT显示肿瘤残余。试验组病灶全切率为85.3%(29/34),高于对照组的66.1%(41/62),差异有统计学意义(P<0.05)。
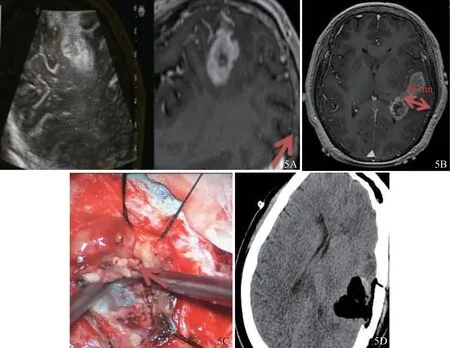
图5 胶质母细胞瘤(59岁女性患者)术后超声-MRI融合导航病灶残留

表2 试验组和对照组病灶的大小、深度和病理结果的比较
2组患者良、恶性病灶术后切缘判断与术后CT的符合情况见表3。经卡方检验,试验组所有病灶术后切缘判断准确率和恶性病灶术后切缘判断准确率均高于对照组,差异有统计学意义(P<0.05);试验组良性病灶术后切缘判断准确率与对照组间差异无统计学意义(P>0.05)。

表3 试验组和对照组术后切缘判断与术后CT符合情况n(%)
讨 论
1.病灶深度与漂移距离的相关性
由于颅脑手术过程中颅压的改变,使颅内病灶产生不定向的位置移动,即脑漂移,其会导致MRI神经导航定位发生偏差。产生脑漂移的原因可能为[6-7]:①术中颅骨的去除,支撑结构的解除,使脑压下降,病灶向低压方向偏移;②脑脊液的丢失,使得限制病灶移动的阻力降低,病灶发生更大程度移位;③实体病灶切除过程,病灶体积的缩小,引起残余病灶产生移位。术中脑漂移导致术前影像不能反映术中病灶真实的信息,一直是MRI神经导航普遍存在的问题。
国内尚未有对颅内小体积病灶进行MRI神经导航脑漂移的研究,杨丽新等[8]对脑漂移概念进行了初步介绍,但未详细阐明漂移机制以及意义。国外已开 展 相 关 临 床 研 究[9], 一 些 学 者 , 如Prada等[10],Ohue等[11]意识到脑漂移的重要性,并以此为依据进行术前定位和脑切除范围制订。本研究发现超声融合导航对于颅内相对较小病灶(肿块最大径≤脑漂移距离)的意义尤为重要。其中试验组有5例(14.7%,5/34),患者硬脑膜打开后,MRI神经导航指定的手术位置不能探及病灶,必须使用超声重新定位。操作中应用融合成像Fune Tuning功能,将术中实时超声图像与术前MRI增强图像再次校正,对准确定位手术切口有很大帮助。
理论上,由于重力作用及周围脑组织缓冲作用,不同深度病灶的脑漂移距离不同:病灶越深,漂移距离越小;病灶越浅,漂移距离越大。本研究中,试验组34例患者均有不同程度脑漂移,回归分析结果显示病灶距表面距离与病灶深度呈负相关(r=-0.918)。试验组中有3例(8.8%,3/34)患者结果出现较大偏差,其原因可能为:①病灶大小和形态不同,对于压力的降低其所产生的漂移有所不同;②研究中取病灶中心为参照点,对于形态不规则病灶,各部位漂移程度和方向亦不同;③对于深度不同病灶,压力的降低其脑组织缓冲代偿亦有所不同。研究发现,术前正确认识脑漂移重要性及漂移距离,及时纠正脑移位将明显减少术中对正常脑组织的损伤。超声-MRI融合导航不仅能纠正脑漂移,准确地定位病灶,而且还能实时地进行术中导航,对残余病灶进行评估。国外文献[12-14]有应用超声-MRI融合导航技术对术后切缘进行良好评估的报道,国内亦有对该应用进行研究的报道。不过多数研究还是停留在静态的体表标记,倘若患者体位改变,或者需要变动头架,原先的术前定位就不再适用。本研究中,我们尝试动态融合定位病灶的方法,以消除手术过程中因变动患者和磁体相对位置的影响,取得了较好的效果。
2.超声-MRI融合成像在病灶切除中的价值
对本研究中的试验组和对照组进行对比分析发现,试验组的病灶完全切除率、对所有病灶的术后切缘判断准确率均明显高于对照组,二者间的差异均有统计学意义(P<0.05)。其中,对良性病灶的术后切缘判断准确率在试验组和对照组之间差异无统计学意义(P>0.05);而对恶性病灶的术后切缘判断准确率,试验组高于对照组,二者差异有统计学意义(P<0.05)。因此,超声-MRI融合导航对边界不清的恶性肿瘤,更有临床价值。通过超声-MRI融合导航,可提高恶性肿瘤的全切除率,与文献[7.12]报道一致。
本研究中,试验组有3例(3/34)患者CT显示有肿瘤残余,超声-MRI融合图像漏诊。究其原因可能为:①3例患者均为恶性胶质瘤,肿瘤对周边脑组织浸润,单从切缘并不能诊断肿瘤是否有残留;②术前MRI增强能够对肿瘤主体显影,对于恶性肿瘤波及周边脑组织显示有限,因此与术前就显示不全面的图像融合,术后残留概率本身就大;③对于形态不规则肿块,术后瘤腔与术前肿块不能完全重叠,这对于一些低度恶性肿瘤,虽然肿瘤边界较清晰,但由于挖除肿块后瘤腔已不能和术前影像重叠。
综上所述,超声-MRI融合导航对于手术完整切除病灶及判断术后切缘病灶是否残留,进一步确定治疗方案有较大指导作用。同时为避免漏诊,需多角度、多方位对比观察以提高诊断准确性。
3.结论
超声-MRI融合导航可实时纠正脑漂移,对发生移位的病灶进行重新定位。术后超声图像与术前MRI融合成像,可对比分析瘤腔边缘性质,辅助病灶的完整切除,能提高病灶尤其是恶性病灶的全切除率。

