小儿心脏术后体外膜氧合支持预后分析
陈 曦,张明杰,王丽平,庞亚昌,刘佳琪,王 伟,杨寅愉,徐卓明
体外膜氧合(extracorporeal membrane oxygena⁃tion,ECMO)是一种支持难治性心源性休克的有效技术[1]。 最常见的适应证包括暴发性心肌炎[2]、心脏移植后[3]或心脏手术后[4]。 尽管在设备的质量和ICU 的整体管理方面取得了显著进步,但由于缺乏成熟的经验,ECMO 后的严重并发症或死亡仍较多[5-8]。 目前我国关于 ECMO 在儿童中应用的总结尚较少,因此本文的目的是描述在本中心儿童心脏术后使用ECMO 的趋势,并总结不同适应证下生存情况的变化。
1 对象与方法
1.1 研究对象 回顾性分析上海儿童医学中心心胸外科数据库,选择2016 年1 月至2019 年12 月先天性心脏病(congenital heart disease,CHD)术后进行静脉-动脉(veno-artery, V-A)ECMO 辅助患者117 例。 2016 年安置 16 例,2017 年安置 30 例,2018年安置36 例,2019 年安置39 例。 根据体外生命支持组织在2018 年所发布的儿科心力衰竭指南中所提出的适应证[9],将患者分为三组。 组1:心脏术后综合征,包括心脏手术后未能脱离心肺转流(car⁃diopulmonary bypass, CPB)、术后低心排血量综合征(低心排)等;组2:心肺衰竭,包括肺动脉高压、心肌病、顽固性心律失常及脓毒血症等;组3:心脏骤停,心脏骤停经传统心肺复苏(cardiopulmonary resusci⁃tation,CPR)无效者。
1.2 V-A ECMO 辅助方法及患者管理 根据本科既往经验[10],ECMO 的辅助和管理均由心外科医师、ICU 医师、体外循环医师共同决定。 所有V-A ECMO 建立均受专业培训的ECMO 小组成员进行置管安装。 患儿ECMO 期间的辅助流量、血管活性药物、血流动力学的维持、容量管理、抗凝管理、抗菌药物的应用及撤机时机均由三方医师共同决定。
1.3 相关定义
1.3.1 手术分期 Ⅰ期手术指首次进行心胸外科手术;Ⅱ期及以上手术指因同一疾病进行的二次手术,包括因残余解剖问题及术后远期并发症所进行的手术。
1.3.2 起始时间 指手术结束后至ECMO 安置的间隔时间。
1.3.3 持续时间 指 ECMO 安置至 ECMO 撤离的间隔时间。
1.4 统计学方法 采用 Excel 表格绘图及 SPSS 25.0 统计学软件进行数据处理。 呈正态分布的计量资料采用均数±标准差()表示,组间比较采用单因素方差检验;非正态分布的计量资料采用中位数和四分位间距[Q(Q1,Q3)]表示,组间比较采用秩和检验;计数资料以例数百分比[n(%)]表示,组间比较采用卡方分析。
2 结 果
2.1 一般临床资料 心脏术后接受ECMO 支持一共有117 名患儿,其中因发生心脏术后综合征63 例(53.8%),因心肺衰竭 30 例(25.6%),因心脏骤停行 CPR 后无效 24 例(20.6%)。 因心脏术后综合征接受的患者中包括32 例术中脱离CPB 困难和31 例术后发生低心排的患者。 因心肺衰竭接受的患者中包括6 例肺高压危象、19 例心律失常、4例呼吸衰竭及1 例代谢紊乱者。 表1 为按适应证分组进行的患者人口学资料统计。 结果显示,因心脏术后综合征接受ECMO 支持的患者CPB时间长(P<0.001),手术分期为Ⅱ期及以上的比例高(P=0.002)。 患者年龄略大,但未见统计学差异(P=0.129)。
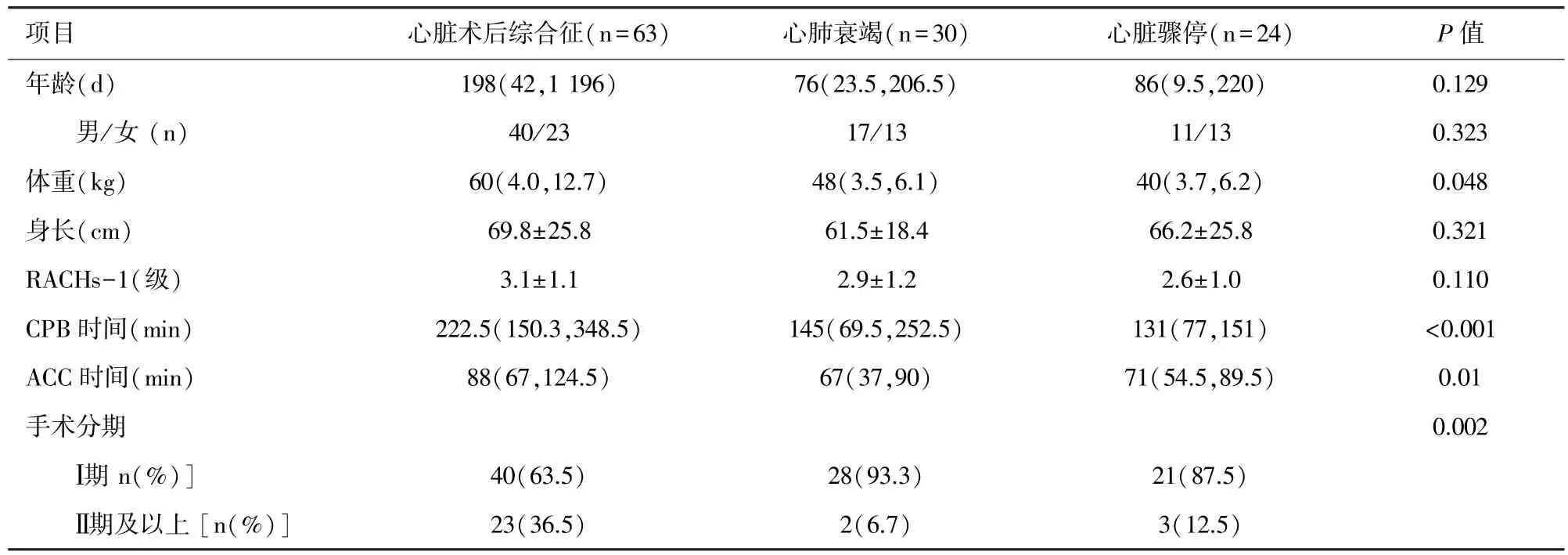
表1 按适应证分组的患者人口学资料统计
2.2 ECMO 使用情况 从 2016 年到 2019 年 ECMO的使用人数增长了225%,而死亡率降低28.8%(图1)。 在所有适应证中,因心脏骤停接受ECMO 安置的增幅最大,而因心脏术后综合征和心肺衰竭接受安置的患者分别增加144.4%和133.3%。 反观各适应证所对应的死亡率趋势,因心肺衰竭接受ECMO 者的死亡率下降最明显,从2016 年的100%下降至2019年的14.3%(P=0.021);而因心脏术后综合征和心脏骤停ECMO 安置的死亡率波动不明显(图2)。
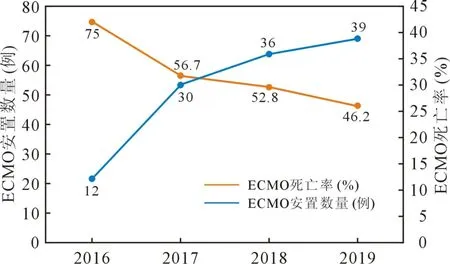
图1 ECMO 使用和死亡率的总体趋势
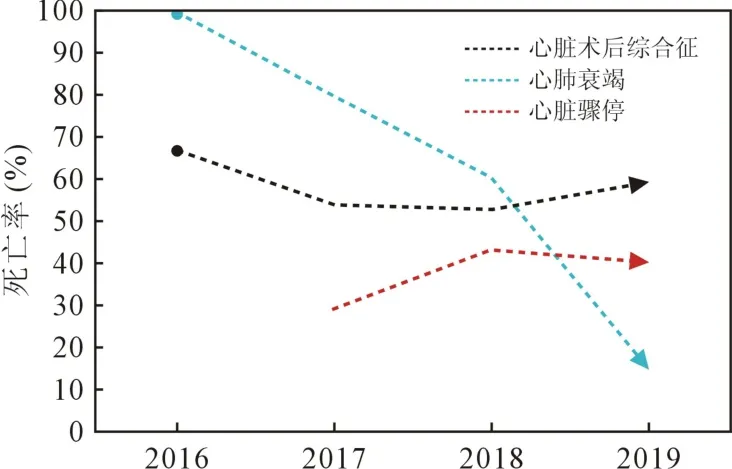
图2 按适应证分类的死亡率趋势
2.3 ECMO 安置情况 表2 为 ECMO 安置的预后情况分析。 是否在手术室中安置ECMO、ECMO 开始时间、以及持续时间对死亡率无影响(P>0.05)。 死亡组中持续肾替代治疗(continuous renal replacement therapy,CRRT)上机率较高、成功撤机率较低,而ICU时间、住院时间均低于存活组(P<0.05)。
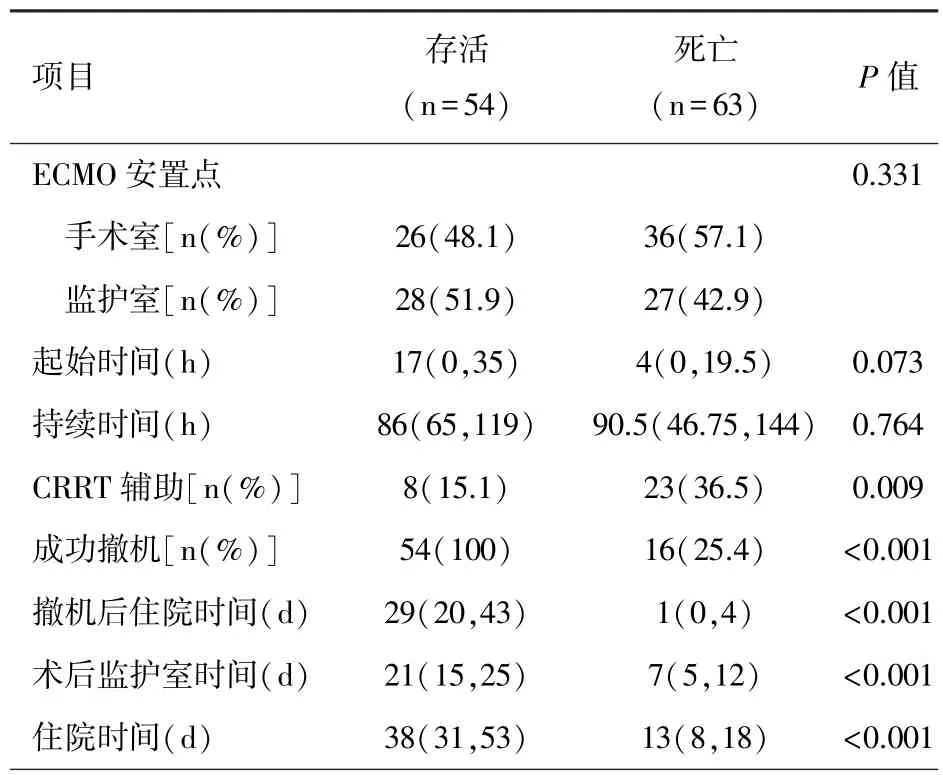
表2 ECMO 安置的预后情况
3 讨 论
在过去的几十年里,ECMO 技术在成年人中的应用有了显著的增长,并且取得了令人鼓舞的结果。ECMO 早期较多使用在新生儿呼吸衰竭病例,由于泵和氧合器的发展,加上围手术期管理的改进,ECMO在小儿的使用不仅仅局限于新生儿[11-13]。 本研究中回顾总结了2016 年至2019 年上海儿童医学中心心胸外科因CHD 术后安置ECMO 的情况,并分析不同适应证下的变化趋势。 总的来说,因心脏术后综合征接受ECMO 支持的患者CPB 时间长,手术分期为Ⅱ期及以上的手术比例高;从2016 年到2019 年EC⁃MO 的使用数增加了225%,而死亡率降低28.8%,其中因心肺衰竭接受者的死亡率下降最明显。
根据文献报道[8],ECMO 在 CHD 患者中最常见的是用于术后各种原因造成的心输出量下降,其中以心脏手术后未能脱离CPB、术后低心排血量综合征最多。 通常复杂CHD 手术需要长时间的CPB 支持,而长时间的CPB 暴露,促使心肌损伤的加重,心功能通过简单的强心治疗并不能恢复,最终导致脱机失败。 然而,ECMO 可以使心室有时间恢复功能,维持适当的器官灌注,得以改善患者临床预后。 因此,术中难以脱机的患者及时的ECMO 辅助有益于术后的恢复。 既往研究表明,缺血再灌注的心肌损伤在再灌注后8 h 后达高峰,因此长时间CPB 术后低心排血量综合征发生率高,较轻的低心排血量综合征通过适当的正性肌力药物治疗后可恢复。 但若予以正性肌力药物治疗后患者仍表现为尿少、代谢性酸中毒和低混合静脉饱和度,这些患儿可以选择性地进行 ECMO 支持循环。 因此,对于 CPB 时间长、术后正性肌力药物效果不佳者应及时判断患儿病情,及时予以ECMO 治疗。
虽然ECMO 用于心脏支持在儿童人群中的应用越来越多,但是其死亡率仍较高。 文献中报道的出院总死亡率基本保持不变,平均约为 60%[8,13-16]。本研究中整体死亡率(53.8%)与文献相仿。 但根据ECMO 使用和死亡率的年度趋势可以看出,在使用情况每年递增的情况下,本中心的死亡率呈不断下降的趋势,2016 年至 2019 年死亡率降低 28.8%。 从图2 的变化曲线可以发现,心肺衰竭后接受ECMO治疗的死亡率下降最为明显,而因心脏术后综合征及心脏骤停接受治疗的死亡率波动不明显。 心肺衰竭组的使用数量增加反映了该技术在各种导致心脏衰竭及呼吸衰竭疾病中的广泛应用。 同时,2016 年心肺衰竭组100%的死亡率与2016 年该组病例少有关。 但至2019 年死亡率已降至14.3%,明显低于体外生命支持组织数据中的37.2%[8]。 本研究中该组病例主要包括术后肺动脉高压和顽固性心律失常。一些复杂CHD 的患儿,容易在术后出现肺血管阻力的突然和严重升高,加上CPB、低温和缺血期的代谢应激导致进一步恶化,最终表现为肺高压危象。 虽然大多数患者可以通过适当的镇静和肺血管扩张使用吸入性一氧化氮或其他药物成功维持[17],但一些有持续的肺高压危象和右心衰竭的患者可受益于ECMO 支持。
自1992 年,首次发表了ECMO 应用于儿科CPR的报告后,小儿体外CPR(ECMO CPR, ECPR)呈指数增长[18]。 同时,与传统 CPR 相比,ECPR 已被证明与改善儿童住院心脏骤停的存活率有关[11]。 据文献报道,ECPR 支持后存活率为 34% ~ 73%[19-20]。本结果与文献报道一致,随着时间推移报告的ECPR病例数量增加,但出院前的总存活率稳定为60%。2018 年体外生命支持组织的指南中表明,ECPR 比选择性安装V-A ECMO 的患者预后差,并且由于潜在心脏病理导致的心脏骤停患者的预后优于非心脏原因导致的心脏骤停患者[9]。 同时,ECPR 的成功需要团队的配合、插管位置、ECPR 开始的时间及持续的时间的把握和 ECMO 的及时启动[18]。 因此,识别潜在的存有心脏病理的患者,并且加强团队的培训,形成一个能够快速部署的ECMO 团队有助于ECPR 的成功率。
总之,随着技术的发展及经验的积累,ECMO 后死亡率逐年下降。 由于ECMO 的成本很高,需要有经验的技术支持,因此,CHD 患儿术后应用ECMO辅助时要把握好适应证。 针对不同适应证的儿童建立相适应的指导方针进行ECMO,能最大限度地发挥该技术的效益。

