博舒替尼对缺氧损伤血管内皮细胞迁移能力的影响
马梦尧,张 冉,钟文华,刘 云,张 艺,吴 超,苏欣宇,王 林,胡泽波,李 曙
(皖南医学院 病理生理学教研室,安徽 芜湖 241002)
缺血性脑卒中是一种严重损害健康的临床常见疾病[1],血管内皮细胞缺氧是缺血性脑卒中发病的首发事件[2]。通过促进缺血区域的血管再生,可有效减少缺血区域血脑屏障的破坏,减轻缺血区组织损伤,延长溶栓疗法的治疗时间窗。
博舒替尼是酪氨酸酶抑制剂中的一种,在临床上常被用来治疗慢性髓性白血病。有研究表明,博舒替尼可以抑制盐诱导激酶2(salt-inducible kinase 2,SIK2)的表达[3]。我们前期的研究表明,SIK2可以抑制血管生成[4]。本研究采用博舒替尼作用于CoCl2诱导的人脐静脉血管内皮细胞(human umbilical rein endothelial cells,HUVECs)缺氧损伤模型[5],探讨其对HUVEC损伤后迁移能力的影响及可能的作用机制,以期为延长缺血性脑卒中的溶栓治疗时间窗提供新的思路和靶点。
1 材料与方法
1.1 材料与仪器 HUVECs(南京凯基生物公司);DMEM高糖的培养基(HyClone,USA);胎牛血清(CLARK,USA);磷酸盐缓冲液PBS(HyClone,USA);CoCl2(sigma,USA);博舒替尼(Beyotime,China);Transwell Corning 3422(Corning,USA);CCK-8(DOJINDO,China);SIK2兔多克隆抗体(Thermo,USA);β-actin鼠多克隆抗体(Beyotime,China);HRP山羊抗兔抗体(Beyotime,China);山羊抗鼠抗体(Beyotime,China);细胞的程序冻存盒(Thermo,USA);化学发光凝胶成像系统(BIO-RAD,USA);酶标仪(SpectraMax M2,USA)。
1.2 方法
1.2.1 细胞培养 将HUVECs用含10%胎牛血清(FBS)的DMEM培养基培养,放置在37℃、5%CO2培养箱中,每隔两天换液,取对数生长期细胞实验。
1.2.2 建立CoCl2缺氧损伤模型 将HUVECs细胞种入96孔板(1×104个/mL),24 h后更换成100 μL终浓度分别为350、300、250、200、150、100、50、0 μmol/L的含CoCl2的无血清培养基,每组设6个复孔,24 h后加入10 μL CCK-8,2 h后在酶标仪450 nm波长(600 nm波长参比)下测各组光密度(OD)值。取100 μL 250 μmol/L CoCl2分别作用于HUVECs 0、3、6、12、24、48 h,通过CCK-8法进一步筛取最佳时间。
1.2.3 测定细胞培养上清中的乳酸脱氢酶(LDH)含量 将HUVECs细胞制成悬液,用移液枪种入96孔板内(1×104个/mL),待细胞长满孔底后弃去培养基,加入LDH释放试剂孵育1 h后,离心取上清并随即进行样品测定。
1.2.4 划痕实验法测定细胞迁移率 6孔板背面用Marker笔做辅助线,接种HUVECs细胞悬液并加入含丝裂原霉素C(1 μg/mL)铺满孔底后待过夜,用200 μL枪头垂直横线划痕。PBS清洗3次,加入含2%胎牛血清的培养基。按对照组、CoCl2缺氧损伤组、博舒替尼治疗组分别以0、24 h为时间点取样拍照。随机选取40×视野拍照比较细胞迁移程度,迁移程度=(0 h两侧平均距离-24 h两侧平均距离)/0 h两侧平均距离。
1.2.5 Transwell实验法测定细胞迁移率 实验分为对照组、CoCl2缺氧损伤组、博舒替尼治疗组3组。将饥饿处理后的HUVECs制成1×105个/mL浓度的混悬液,取200 μL 2% FBS细胞悬液置于Transwell上室,在Transwell下室加入800 μL含有20% FBS的DMEM高糖完全培养基。待孵育24 h后,镊子去除小室,用棉签伸进上室轻轻旋转擦拭,接着PBS清洗,100%甲醇固定下室面细胞30 min,再用0.5%结晶紫染色20 min,擦净上室后镜检,随机选取5个200×视野拍照,比较细胞数量。
1.2.6 Western blot法检测SIK2蛋白的相对表达 冰上裂解提取6孔板中细胞的蛋白,BCA法测浓度。以每泳道35 μg蛋白上样,通过电泳分离蛋白后,将蛋白转移到NC膜上,再封闭80 min,洗净,一抗过夜。次日待体系温度恢复室温后回收一抗,TBST每次5 min洗涤3次,加入1∶1 000二抗孵育2 h,再次用TBST每次5 min洗涤3次,ECL试剂盒曝光显色。采用Image J对蛋白条带进行分析。
1.2.7 蛋白互作(protein-protein interaction,PPI)分析SIK2相关蛋白 使用STRING数据库(https://string-db.org)找到SIK2及其上下游蛋白,通过京都基因和基因组百科全书比较相关蛋白通路并进行富集分析。
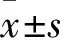
2 结果
2.1 CoCl2的有效作用浓度与作用时间 CCK-8结果表明,低浓度的CoCl2(250 μmol/L以下)不影响HUVECs的增殖(P>0.05);当CoCl2的浓度达到250 μmol/L时,细胞增殖率(0.743 0±0.028 1)与对照组(0.968 1±0.027 6)相比开始出现抑制(P<0.05);时间梯度实验结果表明,当CoCl2作用时间延长到24 h时,抑制效果(0.396 3±0.036 1)最为明显(P<0.05)。见图1。
2.2 CoCl2对内皮细胞凋亡的影响 LDH结果表明,对照组[(14.638 9±0.820 8)mU/μL]和CoCl2缺氧损伤组[(15.362 1±0.613 8)mU/μL]的LDH含量差异无统计学意义(P>0.05),细胞未出现大量凋亡、坏死。见图2。

LDH含量(n=6,t=1.728,P=0.115)。
2.3 博舒替尼对细胞迁移能力的影响 划痕实验结果显示,与对照组(38.47±2.81)%相比CoCl2缺氧损伤组迁移率(13.10±1.11)%下降(P<0.05);联用博舒替尼治疗组(19.37±2.14)%与CoCl2缺氧损伤组相比迁移率有所升高(P<0.05);Transwell的结果表明,各组穿孔细胞数差异明显。取CoCl2缺氧损伤组、联用博舒替尼治疗组同对照组穿孔细胞数目的比值并进行统计,CoCl2缺氧损伤组迁移率(57.87±8.20)%下降(P<0.05),联用博舒替尼治疗组迁移率(80.64±10.81)%有所升高(P<0.05)。见图3。

A.划痕实验;B.划痕实验细胞迁移率(n=3,F=114.269,P=0.000;vs.对照组,**P<0.01;vs.博舒替尼组,*P<0.05);C.Transwell实验;D.Transwell实验细胞迁移率(n=3,F=18.550,P=0.000;vs.对照组,**P<0.01;vs. 博舒替尼组,*P<0.05)。标尺=50 μm。
2.4 博舒替尼对SIK2蛋白表达的影响 各组细胞SIK2蛋白表达及水平检测如下。与CoCl2损伤组相比,博舒替尼治疗组SIK2蛋白表达下降(P<0.05)。见图4。

A.Western blot检测结果;B.SIK2在各组中蛋白的表达(n=3,F=114.269,P=0.000;vs. CoCl2缺氧损伤组,**P<0.01)。
2.5 SIK2相关蛋白PPI及KEGG分析 在STRING数据库(https://string-db.org)中找出与之相关的蛋白(CRTC、CREB、HIF-1、COX-2、TGF、ANG、PDGF、AKT、PI3K、MAPK、FAK、MEK、PKC、ERK、FAK、mTOR、PLC、P38)同SIK2之间的互作关系,见图5。富集分析上述蛋白,结果匹配106条KEGG通路,取显著的前10条通路,见表1。

图5 SIK2相关蛋白相互作用网络分析

表1 KEGG途径富集分析
3 讨论
博舒替尼是酪氨酸酶抑制剂中的一种[6],常被用来治疗正处于慢性、加速期或急变期(既往治疗无效)的慢性髓性白血病患者。有研究表明,博舒替尼可以抑制小鼠体内SIK2的表达[3]。SIK2是一种丝/苏氨酸蛋白激酶[7],隶属于AMP活化蛋白激酶家族。对SIK2最初的研究集中在糖脂代谢、肿瘤预后、细胞周期调控、黑色素合成等方面[8-14]。最近的研究表明,SIK2在缺血性脑卒中的发病中也具有重要作用,其可以维持神经元中cAMP调控的转录共激活因子1(CREB-regulated transcription coactivator-1,CRTC1)的磷酸化及游离状态,避免CRTC1进入胞核与环磷腺苷效应元件结合蛋白(CRE response element-binding protein,CREB)相结合发挥作用。脑缺血损伤发生后,大量SIK2 降解并解除对CRTC1的抑制,继而导致神经元存活率明显增加[7]。我们的前期研究表明,在缺血再灌注损伤中SIK2可通过促血管生成的方式来减轻机体损伤[4]。这些结果提示SIK2可能不仅通过维持CRTC1的磷酸化来保护神经元,还可通过促进血管生成来减轻缺血区的损伤,但其发挥作用的具体机制仍然需要探索。
本研究成功建立HUVECs缺氧损伤模型,通过CCK-8法测定细胞增殖率,筛选CoCl2最佳浓度与作用时间并最终选用250 μmol/L CoCl2作用24 h建立模型,该模型能在体外准确模拟脑缺血损伤初期。LDH在胞浆内广泛存在,细胞发生凋亡时,胞浆内的高浓度LDH可以顺浓度梯度渗透入培养液中,因而可测量上清LDH来评价损伤情况。通过检测该模型上清液中的LDH含量,发现无明显变化,细胞未发生大量死亡,可较准确的判断细胞迁移情况。且Hoechst荧光结果也证明了这个结论。将博舒替尼作用于HUVECs缺氧损伤模型,结果表明博舒替尼治疗可以有效地改善缺氧HUVECs的迁移能力,与CoCl2缺氧损伤组相比,博舒替尼治疗组降低了SIK2蛋白的表达,这表明SIK2可能与HUVECs迁移能力相关。通过对SIK2及相关蛋白作PPI及KEGG分析,表明SIK2可能通过CREB调控来实现其迁移能力的抑制作用。
血管生成是缺血性脑卒中预后的重要指标[15]。细胞增殖、迁移是血管生成最早的标志之一[16-17],也是血管生成级联反应的早期步骤之一[18-19]。本研究结果表明,在HUVECs建立的缺氧损伤模型里,博舒替尼有可能通过抑制SIK2促进HUVECs迁移进而发挥促进血管生成的作用。但是是否通过SIK2-CRTC1-CREB这一相互作用链实现进而促进HUVECs迁移,这一点还需要进行免疫共沉淀等进一步的试验进行验证,后续我们将进一步扩大对相关蛋白指标的测定,为进一步探究SIK2在脑卒中发病中的作用,进而为患者寻找新型早期有效的诊断及预后标志物奠定基础。

