制备方法对乳清分离蛋白-绿原酸共价接枝物结构和功能性质的影响
陈卫军,刘东红,李云成,孟凡冰,刘达玉
(1.成都大学食品与生物工程学院,四川 成都 610106;2.浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
乳清分离蛋白(whey protein isolate,WPI)是生产干酪、酪蛋白等产品的副产物,主要成分为β-乳球蛋白(β-lactoglobulin,β-Lg)、α-乳白蛋白(α-lactalbumin,α-La)、免疫球蛋白(immunoglobulin,Ig)和牛血清白蛋白(bovine serum albumin,BSA)等[1]。WPI营养价值高且具有优良的乳化性、凝胶性、起泡性和配体结合性等多种功能性质,不仅常作为一种功能性和活性成分广泛应用于食品中[2],也越来越多地作为载体材料用于构建生物活性物质的传递体系[3]。基于WPI可以构建乳液、纳米复合物、凝胶等多种传递体系,但以单一蛋白质构建的传递体系通常存在化学稳定性较差、被包埋的生物活性物质容易发生氧化降解等不足[4]。研究证实,多酚的共价接枝可以赋予蛋白质优良的抗氧化活性,形成的蛋白质-多酚共价接枝物可作为一种抗氧化性载体材料,其构建的传递体系能够有效提高被包埋生物活性物质的稳定性[5]。
多酚可以通过非酶促和酶促反应与蛋白质发生共价接枝,常用的方法有碱法、自由基法和酶法,不同方法所涉及的反应机理不同。其中,碱法和酶法是指在有氧条件下,多酚分别在碱性条件或酶的催化作用下首先被氧化成相应的醌,然后与蛋白质分子中的亲核试剂(如赖氨酸、蛋氨酸、半胱氨酸和色氨酸等)结合,形成蛋白质-多酚共价接枝物。自由基法则是指通过自由基引发剂产生的自由基使蛋白质分子活化,活化的蛋白质分子再与多酚结合形成共价接枝物[6]。蛋白质和多酚的接枝反应过程十分复杂,反应底物和接枝方法都会影响产物结构和功能性质,进而影响其在传递体系构建中的应用。因此,需要系统研究底物种类、结构、分子大小等在不同条件下接枝对接枝物结构和功能性质的影响,以进一步明确其构效关系,为定向制备功能性专一的接枝物提供依据。
绿原酸(chlorogenic acid,CA)是一种广泛分布于食用植物中的膳食多酚,具有优良的抗氧化活性和多种生物学特性[7]。据报道,CA的共价接枝能够显著改善蛋清蛋白、乳铁蛋白、β-Lg等蛋白质的抗氧化活性,进而增强其构建传递体系的化学稳定性[4,6,8]。但是,关于CA与蛋白质的共价接枝多采用单一方法进行,不同方法之间的系统比较尚鲜见报道。因此,本实验以WPI和CA为原料,分别采用碱法、自由基法和酶法诱导其共价接枝,系统比较不同方法制备的WPI-CA共价接枝物在接枝效率、结构和功能性质上的差异,以期为制备理想的抗氧化性载体材料以用于传递体系的构建提供依据。
1 材料与方法
1.1 材料与试剂
乳清分离蛋白(蛋白质质量分数93%、水分质量分数4.5%、乳糖质量分数0.2%、脂肪质量分数1%、灰分质量分数2%) 美国Hilmar公司;CA(纯度98%)、多酚氧化酶(活力≥500 U/mg干质量)、水溶性VE(Trolox)、三吡啶基三嗪(2,4,6-tri(2-pyridyl)-1,3,5-triazine,TPTZ)、2,2’-偶氮-二(2-甲基丙基咪)二盐酸盐(2,2’-azobis(2-methylpropionamidine)dihydrochloride,AAPH)(纯度98%) 上海市阿拉丁试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH)、福林-酚(H+浓度2 mol/L)、5,5’-二硫硝基苯甲酸(5,5’-dithiobis(2-nitrobenzoic acid),DTNB)、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonate,ABTS)、8-苯氨基萘-1-磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 美国Sigma-Aldrich公司;o-邻苯二甲醛(o-phthaldialdehyde,OPA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、过硫酸钾、H2O2溶液(体积分数30%)、硝酸、Tris、甘氨酸、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、脲、碳酸钠、乙酸、甲醇、三氯化铁(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
Nicolet 5700傅里叶变换红外光谱仪 美国尼高力仪器公司;J1500圆二色光谱仪 日本Jasco公司;Cary Eclipse荧光分光光度计 美国瓦里安公司;ZCEC-130263F差示扫描量热仪、FE20K pH计、GB204电子天平瑞士Mettler Toledo公司;UV-2550紫外-可见分光光度计日本岛津公司;MultiskanTMGO酶标仪 美国Thermo Scientific公司;磁力搅拌器 金坛市富华电器有限公司。
1.3 方法
1.3.1 WPI-CA共价接枝物的制备
碱法和自由基法接枝均参考刘夫国[6]的方法,酶法接枝参考Prigent等[9]的方法。
碱法接枝:以超纯水溶解制备质量浓度20 mg/mL的WPI溶液,加入质量分数0.02%叠氮化钠溶液抑制微生物生长。采用0.2 mol/L NaOH溶液将WPI溶液pH值调节至9.0,4 ℃下溶胀过夜。取pH 9.0 WPI溶液与0.70 mmol/L CA溶液(超纯水配制)等体积混合,再次调节pH值至9.0。该混合液于室温下敞口搅拌反应24 h,然后转移至透析袋(截留分子质量3 500 Da)内,4 ℃下于超纯水中透析48 h(每隔6 h换一次超纯水)。透析后的溶液冷冻干燥即得WPI-CA共价接枝物。
自由基法接枝:以超纯水溶解制备质量浓度10 mg/mL的WPI溶液,加入质量分数0.02%叠氮化钠溶液抑制微生物生长,4 ℃下溶胀过夜。向100 mL上述溶液中依次加入1 mL 5 mol/L H2O2溶液和0.25 g VC,室温下反应2 h。然后向反应液中加入一定量CA使其终浓度为0.35 mmol/L,继续反应24 h。反应结束后将溶液转移至透析袋(截留分子质量3 500 Da)内,4 ℃下于超纯水中透析48 h(每隔6 h换一次水),透析后的溶液冷冻干燥即得WPI-CA共价接枝物。
酶法接枝:以超纯水溶解制备质量浓度10 mg/mL的WPI溶液,加入质量分数0.02%叠氮化钠抑制微生物生长,于4 ℃下溶胀过夜。向WPI溶液中加入一定量的多酚氧化酶(10 U/mL),用0.2 mol/L NaOH溶液调节pH值至7.0,室温下搅拌2 h。向反应液中加入一定量CA使其终浓度为0.35 mmol/L,继续反应24 h后加入5 μmol/L NaHSO3终止反应。然后将溶液转移至透析袋(截留分子质量3 500 Da)内,4 ℃下于超纯水中透析48 h(每隔6 h换一次水),透析后的溶液冷冻干燥即得WPI-CA共价接枝物。
所得3 种WPI-CA共价接枝物均通过凯氏定氮法测定其中的WPI含量,用于后续实验样品溶液配制。
1.3.2 自由氨基含量的测定
参考文献[10]报道的OPA法测定样品自由氨基含量。OPA试剂的配制(现配现用):将40 mg OPA溶于1 mL甲醇,与25 mL 10 mmol/L四硼酸钠溶液、2.5 mL质量分数20% SDS溶液和0.1 mLβ-巯基乙醇混合后用超纯水定容至50 mL。将4 mL OPA试剂与0.2 mL样品溶液(WPI质量浓度0.2 mg/mL)混合后于35 ℃下反应2 min,然后测定其在340 nm波长处的吸光度。以L-赖氨酸绘制标准曲线,计算样品中自由氨基含量。
1.3.3 巯基含量的测定
参考Chen Weijun等[11]的方法测定样品中巯基含量。用Tris-甘氨酸缓冲液(86 mmol/L Tris、90 mmol/L甘氨酸、4 mmol/L EDTA、8 mol/L尿素和0.5 g/100 mL SDS,pH 8.0)配制WPI质量浓度为2 mg/mL的样品溶液。将5 mL样品溶液与0.05 mL Ellman试剂(含4 mg/mL DTNB的Tris-甘氨酸缓冲液)混合,室温下避光反应1 h后测定其在412 nm波长处的吸光度(A412nm)。巯基含量按式(1)计算。

式中:ρ为样品溶液中WPI质量浓度/(mg/mL)。
1.3.4 游离色氨酸含量的测定
向0.9 mL 1 mg/mL样品溶液中加入1 mL 16 mol/L硝酸溶液,混合后于50 ℃下水浴加热15 min,快速冷却后依次加入4 mL 5 mol/L氢氧化钠溶液和4 mL无水乙醇,充分混合后分别于360 nm和430 nm波长处测定吸光度。色氨酸质量浓度按式(2)计算。
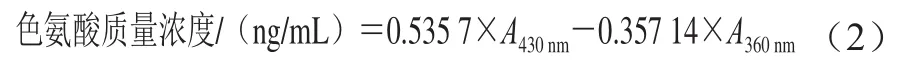
1.3.5 CA接枝量的测定
采用福林-酚法测定接枝物中CA接枝量。将0.5 mL 1 mg/mL样品溶液与2.5 mL福林-酚试剂混合后于室温下避光反应5 min,向混合液中加入2 mL 7.5 g/100 mL碳酸钠溶液,漩涡混匀后继续避光反应2 h,然后测定反应液在760 nm波长处的吸光度。样品溶液吸光度需扣除相同质量浓度WPI溶液在相同反应条件下的吸光度。通过CA标准曲线计算样品中CA含量,结果用每克样品所含CA物质的量表示,单位为μmol/g。
1.3.6 傅里叶变换红外光谱分析
将2 mg样品与0.5 g溴化钾充分混匀、研磨、压片,用傅里叶变换红外光谱仪在4 000~400 cm-1范围内进行扫描。分辨率设置为4 cm-1,结果采用OMNIC软件导出。
1.3.7 SDS-聚丙烯酰胺凝胶电泳分析
参考Chen Weijun等[12]的方法,采用SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)分析接枝对蛋白分子质量的影响。采用质量分数5%浓缩胶和12%分离胶,以Tris-甘氨酸缓冲液(pH 8.3)作为电泳液。样品溶液(2 mg/mL)经上样缓冲液稀释5 倍后于沸水中加热5 min,冰浴冷却后取适量样品上样。电泳结束后,用考马斯亮蓝R-250染色凝胶,以脱色液(V(甲醇)∶V(冰乙酸)∶V(水)=5∶4∶1)进行脱色。
1.3.8 圆二色光谱分析
参考Yin Zhucheng等[13]的方法分析样品二级结构,并做适当调整。取适量样品溶于pH 7.0 10 mmol/L磷酸盐缓冲液(phosphate buffered saline,PBS)中得到WPI质量浓度为0.25 mg/mL的样品溶液,室温下用圆二色光谱仪在190~260 nm波长范围内进行扫描,扫描速率50 nm/min,比色皿光程1 mm。以PBS作为空白,WPI二级结构组成采用DichroWeb数据库分析。
1.3.9 内源荧光光谱分析
取适量样品溶于pH 7.0 10 mmol/L PBS中得到WPI质量浓度为0.25 mg/mL的样品溶液,室温下用荧光分光光度计分析其内源荧光光谱。激发波长280 nm,发射波长范围300~450 nm,狭缝宽度均设置为5 nm。
1.3.10 表面疏水性测定
采用ANS荧光探针法分析[14]。用10 mmol/L PBS(pH 7.0)配制WPI质量浓度为0.005~0.5 mg/mL的样品溶液。向4 mL样品溶液中加入50 μL 8 mmol/L ANS溶液,混匀后在激发荧光波长365 nm下测定发射波长484 nm处的荧光强度。以荧光强度对WPI质量浓度作图,所得曲线初始段斜率即为WPI表面疏水性指数(H0)。
1.3.11 热学特性分析
参考文献[6]的方法采用差示扫描量热仪测定样品的热学特性。称取约6.0 mg样品置于铝盘中并密封,铝盖中央扎孔,以空盘作为对照。氮气流速30 mL/min,升温范围3~160 ℃,升温速率10 ℃/min。利用TA60软件分析样品的变性温度。
1.3.12 抗氧化活性分析
样品抗氧化活性的测定参考支梓鉴[15]的方法,并作适当修改。
DPPH自由基清除能力:将0.5 mg/mL样品溶液与0.2 mol/L DPPH-乙醇溶液等体积混合,室温下避光反应30 min后测定其在517 nm波长处吸光度。
铁离子还原/抗氧化能力(ferric ion reducing antioxidant power,FRAP):将0.1 μmol/L乙酸缓冲液(pH 3.6)、0.02 μmol/L三氯化铁和0.01 μmol/L TPTZ溶液(用0.04 μmol/L盐酸配制)按体积比10∶1∶1混合制备Fe3+-TPTZ试剂,现配现用。将0.5 mg/mL样品溶液与Fe3+-TPTZ试剂等体积混合,37 ℃下振荡反应10 min后测定其在593 nm波长处的吸光度。
ABTS阳离子自由基清除能力:将18 mg ABTS和4 mg过硫酸钾分别溶于4 mL超纯水中,二者混合摇匀后避光反应16 h得ABTS储备液。取3 mL ABTS储备液用无水乙醇定容至100 mL得到ABTS工作液。将1 mL 0.5 mg/mL样品溶液与3 mL ABTS工作液混合,室温下反应1 h后测定混合溶液在734 nm波长处的吸光度。
氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC):用75 mmol/L PBS(pH 7.4)配制质量浓度0.2 mg/mL样品溶液和40 mg/mL AAPH溶液。将50 μL样品溶液和50 μL 0.5 μmol/L荧光素钠盐溶液混合于黑色96 孔板中,37 ℃下孵育15 min后迅速加入100 μL AAPH溶液,振荡5 s,用酶标仪于激发波长485 nm、发射波长538 nm下每2 min测定一次荧光强度,共测定2 h。通过软件计算荧光素钠盐荧光衰变曲线下积分面积。
4 种方法分别建立Trolox标准曲线,所有结果均以每克样品所含Trolox物质的量表示,单位为μmol/g。
1.3.13 乳化特性分析
参考文献[11]报道的方法测定接枝物乳化性质。用10 mmol/L PBS(pH 7.0)溶解样品,制备WPI质量浓度2.0 mg/mL的样品溶液。取15 mL样品溶液加入5 mL大豆油,13 500 r/min均质2 min后分别于0 min和10 min从底部取100 μL乳液,用质量浓度0.1 g/100 mL SDS溶液稀释100 倍后于500 nm波长处测定其吸光度。分别根据式(3)、(4)计算其乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsion stability index,ESI)。
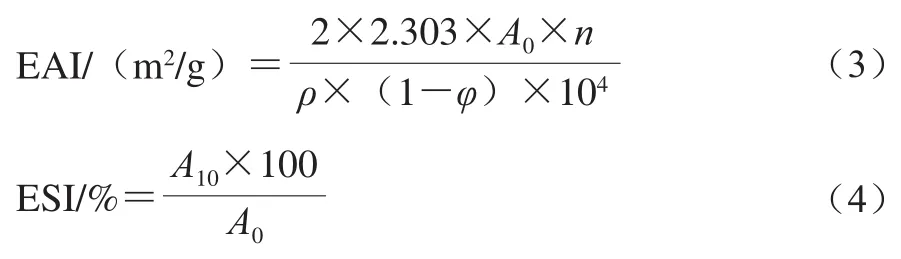
式中:A0和A10分别为均质后0 min和10 min时的吸光度;ρ为WPI质量浓度/(g/mL);φ为油相体积分数/%;n为稀释倍数。
1.4 数据处理与分析
所有实验均设置3 组平行,所得数据采用SPSS 22软件以邓肯新复极差法进行显著性分析,显著水平为5%,运用Origin 9.0软件作图。
2 结果与分析
2.1 WPI和WPI-CA接枝物中反应基团含量和接枝量分析结果
据报道,多酚可与蛋白分子中的自由氨基、色氨酸和游离巯基等发生共价结合而形成蛋白质-多酚共价接枝物[16]。因此,本实验测定反应前后这3 种反应基团含量的变化。由表1可知,与WPI相比,接枝物的自由氨基、色氨酸和游离巯基含量均显著降低(P<0.05)。自由氨基含量测定中使用的SDS会破坏蛋白分子间的非共价相互作用,而在游离巯基分析中使用的尿素可以抑制巯基向二硫键的转换。因此,共价接枝物中自由氨基、色氨酸和游离巯基含量的降低表明这些基团与CA发生了共价结合。这3 种反应基团中自由氨基参与共价结合的量最多,这可能是因为其在WPI中的含量最高。本实验结果与文献[5,17]报道的结果一致。与WPI相比,不同方法制备的接枝物中各反应基团的减少量从高到低依次为酶法接枝物>碱法接枝物>自由基法接枝物。刘夫国[6]发现,在制备乳铁蛋白-CA接枝物时碱法的接枝率明显高于自由基法。这可能是因为不同制备方法的反应原理和反应条件不同。
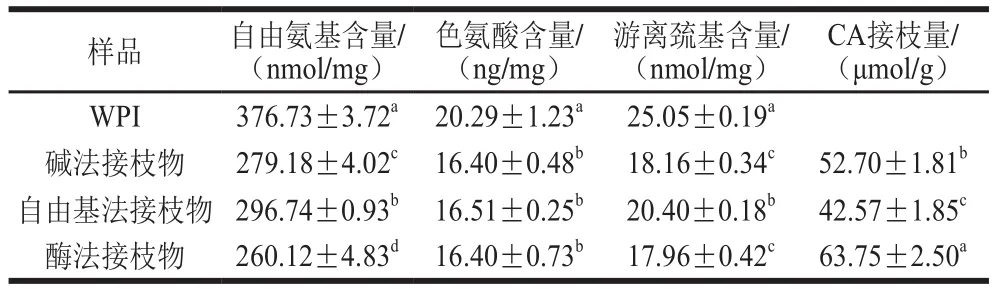
表1 WPI和WPI-CA接枝物中自由氨基、色氨酸、游离巯基含量和CA接枝量Table 1 Free amino, tyrosine and thiol group and CA contents of WPI and WPI-CA conjugates
由表1可知,WPI-CA接枝物中CA接枝量与反应基团含量变化趋势相反,即参与反应的氨基酸基团越多,CA接枝量越高。以碱法、自由基法和酶法制备的接枝物中CA接枝量分别为(52.70±1.81)、(42.57±1.85)μmol/g和(63.75±2.50)μmol/g。表明酶法在诱导WPI与CA的共价接枝反应中效率最高,其次为碱法和自由基法。
2.2 WPI和WPI-CA接枝物的傅里叶变换红外光谱分析结果
由图1可知,WPI光谱中在3 289、2 928、1 651 cm-1和1 532 cm-1处的主要吸收峰分别代表其中存在的酰胺A带(N—H伸缩)、酰胺B带(C—H伸缩)、酰胺I带(C=O伸缩)和酰胺II带(N—H弯曲和C—N伸缩)[18]。与WPI相比,采用碱法、自由基法和酶法制备的WPI-CA共价接枝物位于3 289 cm-1处的吸收峰分别发生了10、4 cm-1和15 cm-1的红移,而位于1 532 cm-1处的吸收峰均发生了6 cm-1的红移,说明WPI的氨基参与了接枝反应。这与文献[6]报道的结果一致。
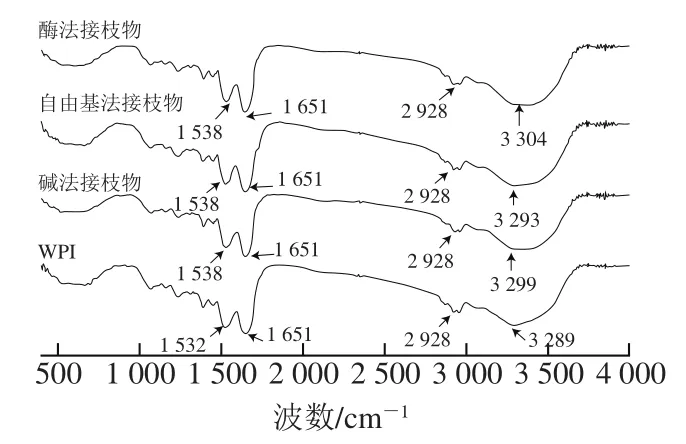
图1 WPI和WPI-CA接枝物的傅里叶变换红外光谱Fig. 1 Fourier transform infrared spectra of WPI and WPI-CA conjugates
2.3 WPI和WPI-CA接枝物的SDS-PAGE分析结果
由图2可知,WPI主要存在α-La和β-Lg两种蛋白条带。与WPI相比,WPI-CA接枝物中α-La和β-Lg的条带均轻微向上迁移,说明CA的接枝使WPI分子质量增大,且每个蛋白分子共价连接的CA数量有限。这些高分子质量的接枝物并未被电泳过程中使用的SDS或β-巯基乙醇所分解,说明WPI-CA接枝物是由WPI与CA通过共价键结合而形成[19]。相关研究指出,α-La/溶菌酶/BSA/乳铁蛋白-CA接枝物中约共价结合有2~4 个CA分子[9,17],与本实验结果类似。
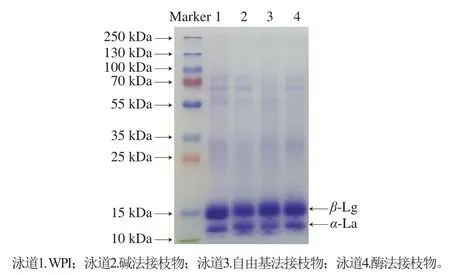
图2 WPI和WPI-CA接枝物的电泳图谱Fig. 2 SDS-PAGE profiles of WPI and WPI-CA conjugates
2.4 WPI和WPI-CA接枝物的圆二色光谱分析结果
采用圆二色光谱分析CA的共价接枝对WPI二级结构的影响,并通过DichroWeb数据库分析WPI和WPI-CA接枝物的二级结构含量。由表2可知,与WPI相比,WPI-CA接枝物的α-螺旋相对含量明显降低,而无规卷曲相对含量明显增加,说明CA的共价接枝导致WPI分子结构的解聚。魏子淏[5]和Wu Xuli等[19]分别在β-Lg-表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)和β-Lg-EGCG/CA接枝物的相关研究中证实了这一现象。此外,不同方法制备的WPI-CA接枝物二级结构含量变化程度也不同。碱法和自由基法制备的WPI-CA接枝物二级结构含量变化程度较大,而酶法制备WPI-CA接枝物二级结构含量变化程度较小。这可能是不同接枝方法的反应条件不同导致。碱法接枝过程中,由于反应体系pH值长时间偏离WPI等电点,导致WPI分子产生部分不可逆的伸展,破坏其α-螺旋结构,增加分子无序程度[20]。自由基法接枝体系中高活性羟自由基(·OH)进攻蛋白质分子则可能会引起α-螺旋向β-折叠和无规卷曲的转变[21]。而酶法反应条件温和,pH值接近中性,所以其接枝物二级结构含量变化最小。
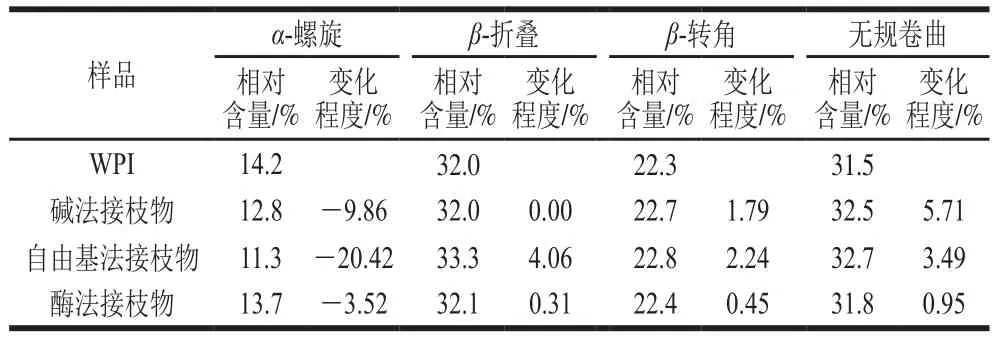
表2 WPI和WPI-CA接枝物的二级结构相对含量Table 2 Secondary structure contents of WPI and WPI-CA conjugates
2.5 WPI和WPI-CA接枝物的内源荧光光谱分析结果
通过内源荧光光谱分析蛋白质荧光基团周围微环境的变化研究其三级结构变化。蛋白质内源荧光主要来自色氨酸和酪氨酸,这两种氨基酸在280 nm激发波长下均能发射荧光[22]。由图3可知,与WPI相比,WPI-CA接枝物的荧光强度明显降低,其中酶法接枝物降低程度最大,其次为碱法接枝物。荧光强度的降低一方面是因为部分色氨酸参与了接枝反应;另一方面则是因为CA的苯环与WPI荧光基团相互作用对荧光产生猝灭作用[6]。虽然3 种接枝物中参与反应的色氨酸残基量没有显著差异(P>0.05),但酶法接枝物中的CA接枝量最大(表1),因此对WPI荧光的猝灭作用也最强。此外,由图3还可发现,CA的共价接枝使WPI的最大荧光发射波长红移4~5 nm,该结果与Feng Jin等[23]的研究结果一致。说明与CA的接枝反应改变了WPI的分子结构,导致其荧光基团微环境极性增加[24]。
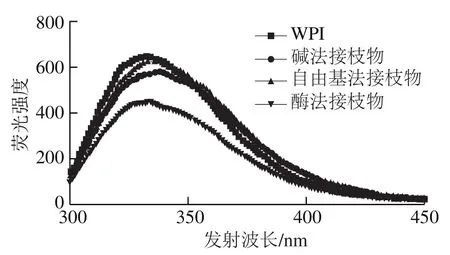
图3 WPI和WPI-CA接枝物的内源荧光光谱图Fig. 3 Intrinsic fluorescence spectra of WPI and WPI-CA conjugates
2.6 WPI和WPI-CA接枝物的表面疏水性分析结果
采用ANS荧光探针法分析CA的共价接枝对WPI表面疏水性的影响。由图4可知,碱法和酶法接枝会显著降低WPI的H0(P<0.05),而自由基法接枝则显著提高WPI的H0(P<0.05)。多酚的共价接枝对蛋白质表面疏水性的影响主要有两方面[25]:一是由于含有亲水性羟基,多酚的共价接枝会增加蛋白质的亲水性;二是接枝过程中蛋白分子内部的一些疏水性基团可能会暴露,导致H0增加。因此,由于反应条件不同,不同方法制备的WPI-CA接枝物H0变化趋势不同。魏子淏[5]报道,采用碱法诱导EGCG的共价接枝会显著降低乳蛋白的H0(P<0.05)。Feng Jin等[23]研究则发现,与卵白蛋白相比,采用自由基法制备的卵白蛋白-儿茶素接枝物H0显著升高(P<0.05)。这可能是因为自由基法接枝过程中·OH的氧化作用会促进蛋白质分子解折叠,使分子内部一些疏水性氨基酸暴露,导致其H0增加[26]。
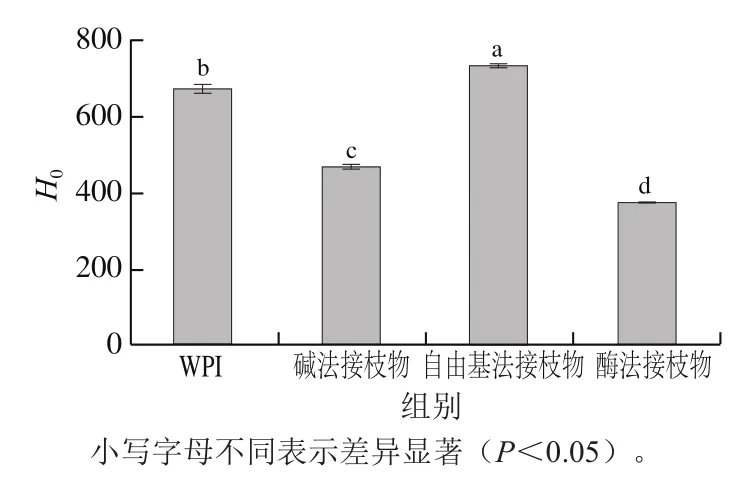
图4 WPI和WPI-CA接枝物的表面疏水性Fig. 4 Surface hydrophobicity of WPI and WPI-CA conjugates
2.7 WPI和WPI-CA接枝物的热稳定性分析结果
采用差示扫描量热法分析CA共价接枝对WPI热稳定性的影响,由图5可知,WPI的热变性温度为94.00 ℃,而碱法接枝物、自由基法接枝物和酶法接枝物的热变性温度分别为96.67、93.17 ℃和97.67 ℃,说明接枝方法会影响WPI-CA接枝物的热稳定性,这可能是因为不同接枝方法制备的接枝物结构存在差异。Ali等[27]研究发现,采用酶法和碱法诱导5-咖啡酰奎尼酸的共价接枝会显著提高β-Lg的热变性温度,但会导致其变性焓(ΔH)降低,推测这可能是因为5-咖啡酰奎尼酸的共价结合使β-Lg的某些区域部分展开,使得ΔH降低并提高其他区域的稳定性,从而导致更高的热变性温度。刘夫国[6]在采用自由基法和碱法制备乳铁蛋白-CA/EGCG/没食子酸接枝物时也得出相似结论。但也有研究指出,碱法制备的BSA-CA接枝物[28]和自由基法制备的卵白蛋白-儿茶素接枝物[23]的热变性温度和ΔH均低于对照蛋白。综上,蛋白质-多酚共价接枝物的热稳定性不仅受制备方法的影响,还可能与底物种类相关。

图5 WPI和WPI-CA接枝物的差示扫描量热图谱Fig. 5 Differential scanning calorimetric analyses of WPI and WPI-CA conjugates
2.8 WPI和WPI-CA接枝物的抗氧化活性分析结果
蛋白质-多酚共价接枝物由于多酚的接入而具有优良的抗氧化活性。由表3可知,WPI的抗氧化活性较弱,而CA的共价接枝可以将其抗氧化活性提高至1.29~27.79 倍,表明CA的共价接枝可以显著增强WPI的抗氧化活性(P<0.05)。不同方法所制备WPI-CA共价接枝物的抗氧化活性由大到小依次为酶法接枝物>碱法接枝物>自由基法接枝物,这与WPI-CA接枝物中的CA接枝量分析结果(表1)一致,表明蛋白质-多酚接枝物的抗氧化活性取决于其多酚接枝量,这与文献[6]的结果一致。
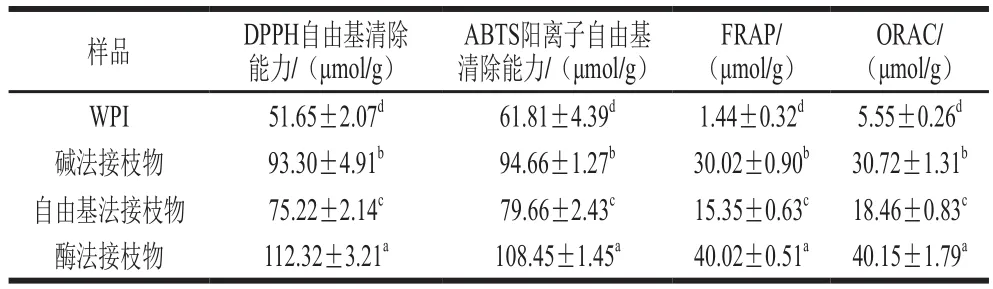
表3 WPI和WPI-CA接枝物的抗氧化活性Table 3 Antioxidant activities of WPI and WPI-CA conjugates
2.9 WPI和WPI-CA接枝物的乳化性分析结果
由图6可知,与WPI相比,WPI-CA共价接枝物的EAI和ESI均显著提高(P<0.05),说明CA的共价接枝改善了WPI的乳化性质。这与Sui Xiaonan等[29]关于大豆分离蛋白-花青素接枝物的研究结果一致。对于接枝物乳化性能的提高,一方面,可能是因为多酚的共价接枝增强了蛋白质在油-水界面的表面张力,使其形成的乳液粒径更小;另一方面,多酚的共价接枝提高了蛋白质分子Zeta电势,从而增强乳液液滴间的排斥力,提高乳液稳定性[30]。此外,共价接枝物结构更为松散,这也有利于其乳化性能的改善。
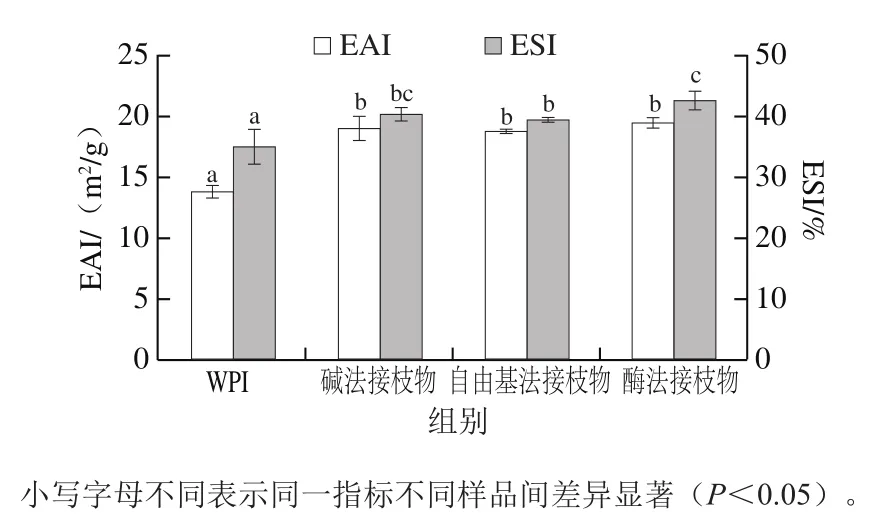
图6 WPI和WPI-CA接枝物的乳化性质Fig. 6 Emulsifying properties of WPI and WPI-CA conjugates
3 结 论
本研究以碱法、自由基法和酶法制备WPI-CA共价接枝物,系统比较了不同方法的接枝效率及其对接枝物结构和功能性质的影响。结果表明:3 种方法均能诱导WPI-CA接枝物的形成,但酶法接枝效率最高,其次为碱法;CA的接枝会改变WPI的二级结构、三级结构和表面亲疏水性,其中酶法接枝对WPI二级结构影响最小;自由基法接枝能够提高WPI的表面疏水性,其他2 种方法则相反;碱法和酶法接枝能够提高WPI的热稳定性,而自由基法则相反。与WPI相比,接枝物的抗氧化活性和乳化性质均显著增强,且抗氧化活性与CA接枝量成正比。酶法接枝物的热稳定性和抗氧化活性最好。

