康复训练介导NGF/VEGF/CD34表达对脑缺血再灌注大鼠血管再生的影响
何文娟,尹伟英,魏妮,谢辉
脑卒中与神经运动功能障碍密切相关,是世界范围内与四肢残疾相关的重要疾病。脑卒中后神经功能障碍严重影响了患者的生活质量,对国家、社会和家庭都带来了沉重的经济、生活和精神负担。脑卒中会伴随多种病理变化,包括血管损伤,脑水肿,神经元丢失和突触功能障碍,血脑屏障破坏并最终会造成四肢运动能力下降[1-2]。临床前研究显示,MCAO后48h开始的早期运动训练能够升高梗死区周围半影区巨噬细胞迁移抑制因子(Macrophage migration inhibitory, MIF)与脑源性神经营养因子(Brain-derived neurotrophic factor, BDNF),改善缺血性中风后的神经元恢复[3]。此外,持续的康复性训练能够帮助缺血后大鼠脑中神经再生与轴突再生,促进脑缺血后认知功能的恢复[4]。然而,这些研究尚不足以完全阐明康复训练对缺血性脑卒中大鼠神经运动功能改善的机制,因此,本研究拟探究康复训练对于脑缺血再灌注大鼠脑中神经血管再生的影响,为康复训练在脑卒中患者中的应用提供更多的理论支持,为后期脑卒中患者辅助运动器械的开发提供思路。
1 资料与方法
1.1 实验动物与方案设计 SPF级雄性健康SD大鼠,7周龄,体重(180±10)g,由上海斯莱克实验动物有限责任公司提供,生产许可证号:SCXK(沪)2014-0002。所有大鼠饲养于SPF级动物房内,自由饮食及饮水,适应性喂养1周后,进行脑缺血再灌注动物模型制备。动物模型制备结束后24h选取神经行为学评分2~3分的大鼠进行随机分组,分为脑缺血组(24只),康复组(16只),假手术组(8只),共48只大鼠。如图1所示,康复组每天进行2次跑步训练,跑步速率为5~10m/min递增,每次30 min。

图1 大鼠跑步训练图
1.2 实验试剂与仪器 圆头尼龙线栓由广州佳灵生物科技公司提供;CD34鼠源单克隆抗体(1∶200)由武汉博士德生物制剂公司提供,血管内皮生长因子(Vascular endothelial growth factor, VEGF)兔源多克隆抗体(1∶1000)、神经生长因子(Nerve growth factor, NGF)兔源多克隆抗体(1∶1000)、β-肌动蛋白(β-actin)鼠源单克隆抗体(1∶1000)均由北京博奥森生物公司提供;HRP标记Goat anti-rabbit 二抗(1∶2000)与HRP标记rat anti-mouse 二抗(1∶2000)均由CST公司提供;2, 3, 5-氯化三苯四唑溶液由美国Thermo公司提供,BCA试剂盒由上海碧云天生物公司提供。
1.3 脑缺血再灌注模型制备 参考改良的Zea Longa法制备左侧颈动脉栓塞再灌注模型[5]。术前大鼠禁食不禁水,术中完全麻醉大鼠(3%戊巴比妥钠,剂量30mg/kg),颈前正中位置开口,充分暴露组织并钝性分离出左侧颈总动脉,颈内动脉与颈外动脉,结扎颈外动脉远心端,血管夹封闭颈内动脉与颈总动脉。在颈外动脉分叉部位开口,使用圆头尼龙线栓插入颈总动脉,撤去颈内动脉血管夹,推动线栓进入颅脑中,以圆头远端距离分叉处约为15mm,固定线栓,缝合伤口。动物置于28℃温室中苏醒,待缺血2h后取出线栓。假手术大鼠仅打开皮肤,暴露血管,不进行插线栓操作。
1.4 评定标准 脑缺血24h后在缺血组中随机挑选8只大鼠取脑组织用于检测。康复训练7d后对动物进行神经功能评分并在脑缺血组与康复组中随机各选取8只大鼠取脑组织用于检测。14d后,完整取出剩余大鼠脑组织用于检测。
1.4.1 神经行为学评分 根据Zea Longa评分法对大鼠神经行为学进行评分[5]。评分标准如下:0分,大鼠四肢正常,可以直线行走;1分,大鼠可直线行走,但右侧前爪蜷缩;2分,大鼠不能直线行走,仅能向左对侧转圈;3分,大鼠运动呆滞,并易向左侧倾倒;4分,大鼠意识丧失,完全瘫痪;5分,大鼠死亡。
1.4.2 脑梗死体积的检测 大鼠康复训练1周后,大鼠深度麻醉(3%戊巴比妥钠,剂量40mg/kg),冰上迅速开颅取脑,-20℃冰箱中冰冻10min,用锋利刀片将脑组织切成6片薄片并置于2%的2, 3, 5-氯化三苯四唑(5-triphenyltetrazole chloride,TTC)溶液中,37℃温箱中避光孵育30min,每5 分钟翻动一次脑片,保证组织切片完全接触到染液。
1.4.3 免疫组化 大鼠深度麻醉后(3%戊巴比妥钠,剂量40mg/kg),经左心室使用生理盐水冲洗血液,再以4%多聚甲醛灌注,取出脑组织使用梯度酒精进行脱水。脱水后,将脑组织置于乙醇和二甲苯混合溶液中透化,再经石蜡包埋后切成5μm切片并进行下一步操作。取切片脱蜡至水,高压、高温条件下抗原修复15min,取4% BSA溶液封闭2h。洗去BSA溶液,滴加CD34抗体稀释液(1∶200),4℃孵育过夜,冲洗一抗,滴加碱性磷酸酶标记的二抗,室温孵育1h后,洗去二抗后使用二氨基联苯胺显色30s,再次冲去二氨基联苯胺后使用苏木精复染20s,蒸馏水分化,最后在梯度酒精脱水,二甲苯透明,中性树胶封片。在显微镜下观察并拍摄照片,应用Image Pro Plus软件对CD34阳性染色区域进行光密度分析统计,以脑缺血再灌注后24h脑组织中CD34阳性染色区域光密度为基础进行归一化统计分析。
1.4.4 免疫印迹 大鼠深度麻醉后,冰上迅速取脑,分离出海马组织,将裂解液按体积质量比5:1加入海马组织中,冰上研磨匀浆,4℃再静置裂解30min。高速冰冻离心机在4℃条件下12000rpm/min离心10min。取上清液,使用BCA试剂盒进行蛋白浓度定量,加入上样缓冲液,沸水浴中使蛋白变性,以20μg组织蛋白量进行等量上样,采用SDS-PAGE凝胶电泳法,浓缩胶为4%,分离胶为12%,调节电压30min/60V,90min/90V进行凝胶电泳,以上样缓冲液跑至胶底为终点。湿法转膜法进行电泳转膜,结束后使用脱脂奶粉封闭2h,再使用一抗稀释液(1:1000)孵育过夜。次日,使用HRP标记的二抗稀释液(1:2000)进行孵育,洗净多余二抗后,均匀添加ECL发光液,显影仪显影后使用Image J软件进行灰度值分析。
2 结果
2.1 3组大鼠神经功能比较 无论何时,假手术组大鼠神经功能评分均为0分。脑缺血24d后,脑缺血组和康复组神经行为学评分差异无统计学意义,脑缺血7d及14d时,康复组神经行为学评分明显低于脑缺血组(P<0.05)。见表1。

表1 3组大鼠脑缺血24h、7d及14d后神经行为学评分比较 分,
2.2 3组大鼠缺血侧脑区梗死面积比较 如图2A所示,假手术组大鼠TTC染色脑组织为红色,脑缺血组大鼠冠状切片左侧均能看见不同程度白色的梗死区域且与周围正常的脑组织界限清晰。随着时间的推移,虽然大鼠出现一定程度的自愈,但脑缺血组各个时间点大鼠缺血侧组织梗死仍然很严重。与脑缺血组相比,康复组在脑缺血7d、14d时大鼠缺血区梗死面积显著减少(P<0.05)。见图2B。
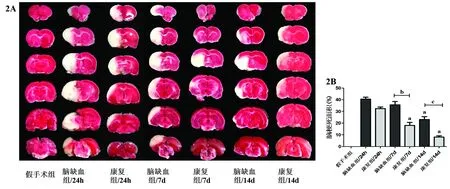
图2A 各组大鼠脑组织TTC染色(红色代表非梗死区,白色代表梗死区域)
2.3 3组大鼠缺血侧脑区血管新生情况比较 CD34是血管新生的标志性抗原,CD34阳性染色呈棕色条状分布。如图3所示,假手术组新生血管极少,脑缺血组诱导了血管新生,且与脑缺血组相比,无论是术后7d还是14d,康复组大鼠脑中新生血管都显著多于脑缺血组大鼠(P<0.05)。
2.4 3组大鼠缺血侧脑区NGF/VEGF蛋白量比较 如图4所示,与脑缺血组相比,康复组脑缺血7d,14d时大鼠脑中NGF与VEGF表达均显著升高(P<0.05)。

图3A 3组大鼠缺血区CD34染色(黑色箭头代表CD34阳性染色区域)

图4 3组大鼠缺血区NGF/VEGF表达与量化统计(与脑缺血组/24h比较,aP<0.05;与脑缺血组/7d比较,bP<0.05;与脑缺血组/14d比较,cP<0.05)
3 讨论
脑卒中损伤涉及病理生理机制复杂,主要有炎症反应,氧化应激反应,血脑屏障损伤,离子动态平衡紊乱等[6]。此外,脑组织结构复杂,但对缺血缺氧耐受性低,修复性差,临床上不仅需要使用药物干预帮助患者康复,而且增加患者自身的自愈能力也是治疗脑卒中的重点[7]。本研究中,脑缺血再灌注模型成功造成大鼠四肢运动障碍,与临床患者缺血对侧身体部分或完全瘫痪一致,因此本研究中脑缺血再灌注介导大鼠运动功能损伤模型造模成功。虽然随着时间推移,大鼠行为功能也会出现了部分缓解,但持续的康复训练更显著加速了大鼠的恢复速率,改善了大鼠的运动功能。
近年来,缺血区血管微循环再生对于神经系统的改善作用正逐渐引起关注。陆方等[8]研究显示针刺能够促进脑缺后亚急性期侧支循环微血管的再生,改善大鼠局灶性脑缺血区的血供。血管内皮生长因子(Vascular endothelial growth factor, VEGF)是目前发现可作用于血管内皮细胞的生长因子,是一种特异性的有丝分裂原,在血管生成过程中起重要调节作用,并发挥着营养神经,刺激轴突生长,延长神经元存活时间的作用。VEGF主要作用机制是与其受体结合,增加微血管通透性,提高微血管增殖和迁移水平,促进完全阻塞的血管中侧支血管循环形成,改变内皮细胞基因表达,促进再生的毛细血管穿透组织内,发挥神经营养作用[9]。生理状态下VEGF及其受体表达较低,对血管的密度及整体的渗透功能仅起到一个基本的维持作用,诱导VEGF及其受体表达的主要因素为脑组织的缺血缺氧[10]。Falk等[11]研究显示,外源性VEGF可促进脑组织中VEGF受体的表达增加,减少帕金森患者脑中运动神经元的退化,发挥神经性保护作用。此外,Chen等[12]研究表明,VEGF抑制剂PD173074能够显著逆转运动训练对脑缺血大鼠认知功能和运动功能的改善作用。与文献中报道一致,本研究中,脑缺血再灌注介导的缺血缺氧诱导VEGF表达增加,而康复训练对脑中VEGF表达也是正向调节。
与VEGF协同发挥作用的神经生长因子(Nerve Growth Factor, NGF)是一类支持神经元存活并延长其生物活性,促进神经突触生长的营养因子。生理状态下,NGF是维持神经生长的重要因子,病理状态下,NGF是促进神经元再生与神经元修复必不可少的促进物质[13]。NGF本身具有促进神经细胞存活及延长其生物活性,促进神经突触生长的生物效应。在缺血损伤时,NGF在缺血区表达会明显增加,促进血管再生及炎症的趋化作用,增强神经元的修复功能,发挥神经保护作用,甚至有学者认为NGF在诱导血管再生的作用比其神经保护作用更显著[14]。刘鹏等[15]研究脑缺血再灌注过程中,应用免疫组化检测缺血区NGF表达,结果显示缺血半暗影带区NGF阳性细胞数显著增加,证实NGF表达的上调由脑缺血诱导调控。而Chen等[16]在NGF对缺血性损伤的研究中也证实了NGF能上调VEGF表达,促进血管再生作用从而改善脑部血液微循环。本研究中脑缺血再灌注造成脑中缺血半影区NGF表达增加,而长期康复训练则进一步升高脑卒中大鼠脑中NGF表达,且呈时间依赖性。
此外,CD34是一种高度糖基化的Ⅰ型跨膜糖蛋白,主要表达于骨髓中造血干细胞和血管内皮祖细胞表面,是血管新生标志性抗原。脑缺血后,体内内源性保护机制启动,骨髓中CD34+内皮祖细胞快速转运至外周血中,在趋化因子作用下聚集于损伤部位,参与新生血管的形成。Tsuji等[17]研究显示,外源性脐血CD34+细胞静脉注射可以减少新生小鼠脑卒中后组织缺血性脑损伤,增加神经生长因子和血管内皮生长表达,减少梗死区域。因此,应用免疫组化对应脑缺血部位CD34+细胞染色能够有效反应大鼠脑缺血后神经血管新生的情况。本研究中,假手术组大鼠脑中基本不表达CD34+,而脑缺血有效激活了机体内神经血管的修复再生功能,快速转运CD34+内皮细胞至脑组织部位,促进血管微循环再生。
综上所述,本研究从分子水平结合行为学测试探讨了康复训练对脑缺血再灌注大鼠认知功能改善的作用及可能的作用机制。证实了持续的康复训练可以显著改善脑缺血再灌注后运动功能障碍,其机制可能是通过增加VEGF与NGF表达,促进缺血区血管微循环的建立,改善脑缺血再灌注后大鼠运动功能障碍。

