肺孤立性病变的ADC直方图的比较研究
邓颖诗 魏新华
广州市第一人民医院放射科(广州 510180)
肺孤立性病变是目前肺部CT检查中最为常见的病变类型之一,对其性质的判断有助于临床治疗方式的选择。然而基于CT形态学评估有时仍难以完全将肺良恶性病变进行区分。据报道约30%肺内良性病变术前曾被误诊为恶性肿瘤[1]。
近年来,MRI在胸部病变的应用逐渐增多,其中扩散加权成像(diffusion-weighted imaging,DWI)是目前唯一可无创、实时监控肿瘤异质性的存在及变化。表观扩散系数(apparent diffusion coefficient,ADC)可量化水分子运动并从分子水平反映病变组织微观变化,基于此进行直方图分析,可以更好地反映目标组织内的异质性。ADC直方图在脑部、乳腺病变的应用已有较多研究报道,并已运用于各种肿瘤的分级[2-3]、预测生存时间及化疗后的疗效评估[4- 6],有关肺部良恶性病变鉴别的ADC直方图分析报道仍较少。因此,本研究将对肺部孤立性实性良恶性病变分别进行病灶最大截面(2D ROI)及体积(3D ROI)的测量、对照研究,分析不同病变的最大截面(2D ROI)及体积(3D ROI)ADC特征参数值的差异,筛选出最佳影像学标志物。
1 资料与方法
1.1 研究对象
回顾性搜集2020年1月—2021年1月本院进行肺部MR检查的肺内孤立性实性病变患者69例,其中男46例,女23例,年龄23~77岁,平均(56.12±11.78)岁。69例患者均经病理确诊,恶性病变56例:包括浸润性腺癌(n=33)、鳞癌(n=11)、小细胞肺癌(n=5)、腺鳞癌(n=3)、转移瘤(n=2)、滑膜肉瘤(n=1)、间叶来源恶性肿瘤(n=1);良性病变13例:包括结核(n=5),硬化性肺泡瘤(n=2)、慢性感染性病变(n=2)、错构瘤(n=2),机化性肺炎(n=1)、曲霉菌感染(n=1)。纳入标准:①MR上病灶可显示,且病灶最大径≥1 cm。② 病灶内空洞或钙化大小<同层病变径线的1/3。
1.2 MRI检查设备、扫描序列及方法
应用3.0 T(Philip Achieva TX) 双源双梯度MRI检查设备对所有患者进行胸部检查,扫描使用SENSE XL-TORSO 16 通道相控阵线圈。扫描序列及参数如下:轴位T1WI/TFE:TR/TE=10/2.3 ms, FOV=340 mm×430 mm,NSA=1,矩阵448×448,层厚/层间=5.0/0.5mm。T2WI/TSE:TR/TE=998/80 ms, FOV=340 mm×430 mm,NSA=1,矩阵=640×640,层厚/层间=5.0/0.5mm。DWI:采用单次激发平面回波成像,TR/TE=1 087/55 ms,b值0,600 s/mm2,FOV= 300 mm×375 mm, NSA=4,矩阵=256×256,层厚/层间=3.0/0.3 mm。
1.3 方法
ADC直方图参数测量 原始DWI图像传至飞利浦工作站,生成相应ADC图像,再导入由GE公司提供的Omni-Kinetics软件(OK软件)进行分析,由两名有8年及4年肺部MRI诊断经验的影像诊断医生共同分析,沿病灶边界内缘勾画感兴趣区域(ROI)分别进行病变最大截面2D ROI(图1、图2)及病变所有层面3D ROI(图3、图4)放置,画取范围包括瘤体实性成分及内部液化坏死、出血等,尽量避开病灶边缘伪影及周围组织结构(如血管、气道、邻近正常肺组织),软件自动计算并获得ADC直方图及各参数值。

图1 右中肺内侧段浸润性腺癌注:(A~B):肿瘤在横断位T2WI及冠状位T2WI呈稍高信号。(C):b=600 s/mm2时ADC图,病灶呈稍低信号,ADC值为1.208×10- 3 mm2/s,低于阈值1.57×10- 3 mm2/s。(D):肿瘤横断位最大层面2D ROI画取后使用OK软件计算得到的ADC直方图,高峰较陡峭,曲线右边的尾部较左边略长。
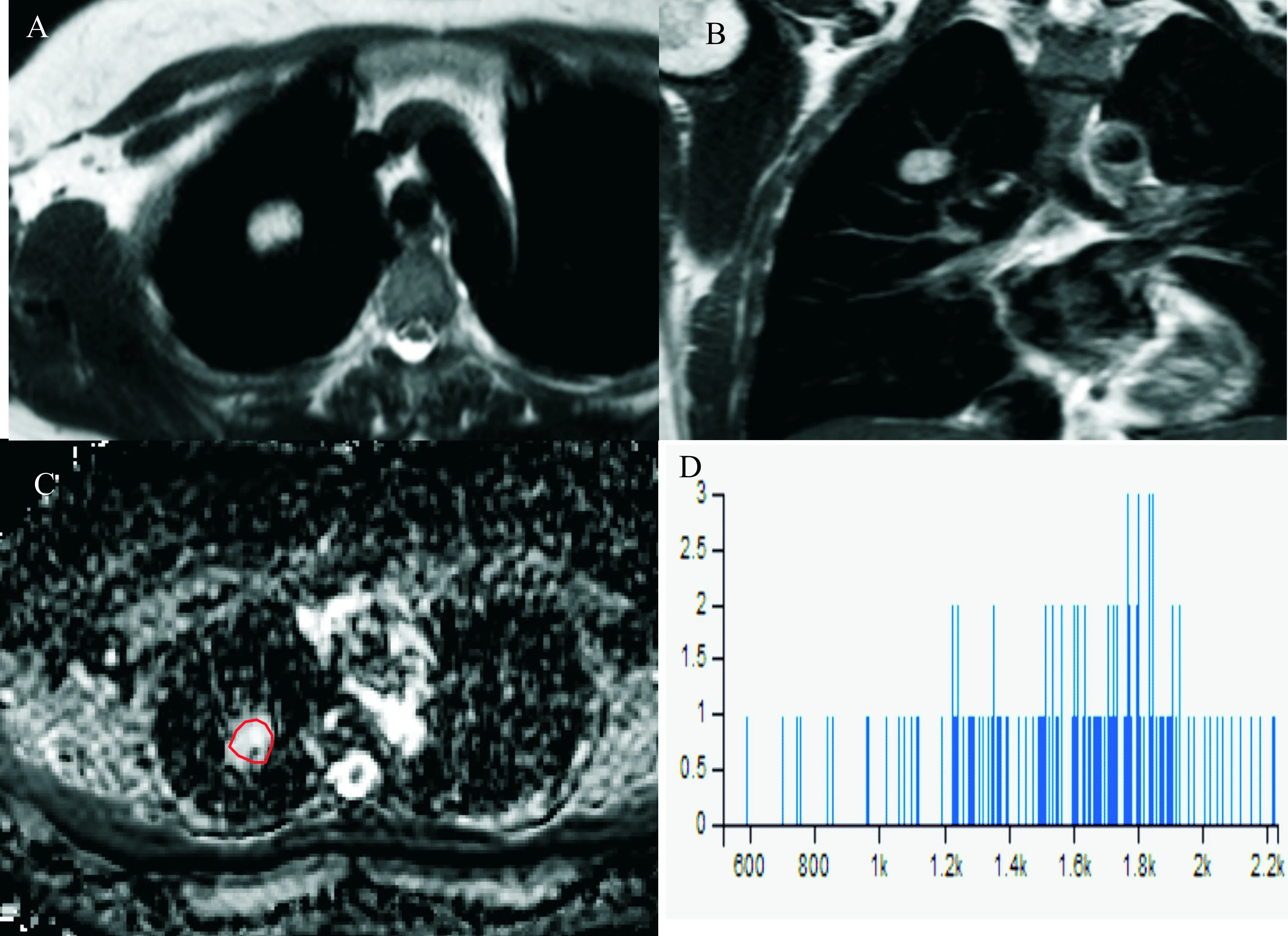
图2 右上肺尖段硬化性肺泡瘤注:(A~B):肿瘤在T2WI上呈高信号;(C):b=600 s/mm2时的ADC图,病灶呈高信号,相应ADC值为1.844×10- 3 mm2/s,高于阈值1.57×10- 3 mm2/s;(D):肿瘤横断位最大层面2D ROI画取后应用OK软件计算所得的ADC直方图,高峰较平缓,曲线右边的尾部长于左边的尾部。

图3 右中肺浸润性腺癌注:(A~G):b=600 s/mm2时各层肿瘤的ADC图,病灶部分呈低信号,部分呈稍高信号。(H):3D ROI放置于肿瘤各层面,用OK软件计算出的ADC直方图,部分高峰较陡峭,曲线右边的尾部相对于左边的尾部要短。
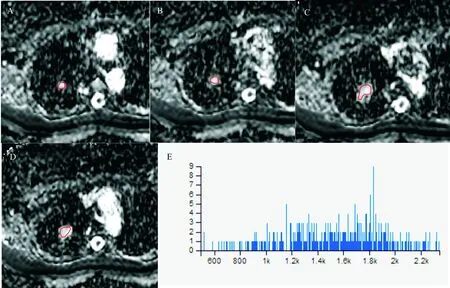
图4 右上肺尖段硬化性肺泡瘤注:(A~D):b=600 s/mm2时各层肿瘤的ADC图,病灶呈高信号。(E):3D ROI放置于肿瘤各层面,用OK软件计算出的ADC直方图,高峰较平缓,曲线右边的尾部长于左边的尾部。
1.4 统计学分析
计量参数用均值±标准差表示。统计分析基于SPSS 22.0进行,组间对比使用Mann-WhitneyU检验,对统计学有意义的参数使用ROC曲线分析,以P<0.05认为有统计学意义。
2 结 果
2.1 ADC直方图各特征参数值比较
3D直方图组中ADC最大值、ADC 25分位数(25th)在鉴别肺内良恶性病变不具有统计学意义(P>0.05)。余2D、3D组中肺恶性病变(图1、图3)的ADC最小值、中位数、最大值、平均值均低于良性组(P值均<0.05)(图2、图4),差异有统计学意义(表1、表2),以ADC 50分位数(50th)、75分位数(75th)、90分位数(90th)差异有统计学意义(P<0.001)。
2D、3D组中恶性病变的偏度(P2D=0.01、P3D=0.044)较良性病变高,而峰度在组间比较无差异(P2D=0.071、P3D=0.083)(表1、表2)。
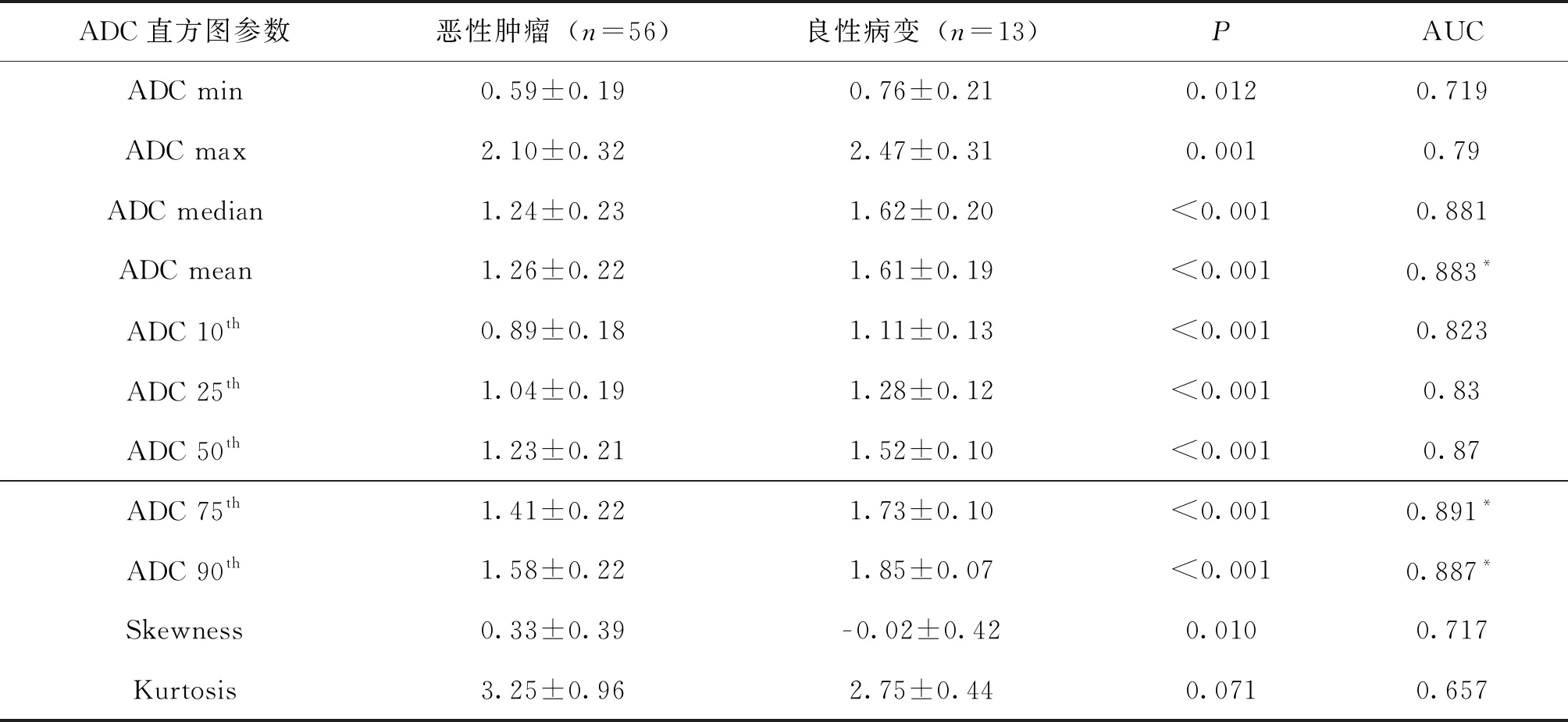
表1 肺部良恶性实性病变2D ROI的ADC直方图参数值 (×10- 3 mm2/s)

表2 肺部良恶性实性病变 3D ROI的ADC直方图参数值 (×10- 3 mm2/s)
2.2 2D与3D ROI诊断效能对比
3D ROI中诊断效能最佳依次为ADC 50分位数(50th)、ADC中位数(ADC median)及ADC 75分位数(75th),对应AUC为0.894、0.887及0.881;2D ROI中对于肺内良恶性病变诊断效能最高前三者依次为ADC 75th、ADC 90th及ADC平均值(ADC mean),对应AUC依次为0.891、0.887及0.883,以3D的ADC 50th及2D的ADC 75th(AUC=0.894、0.891)有较高的诊断效能。当3D ADC 50th取1.41×10- 3mm2/s时,其诊断准确性最高,敏感度为80.00%,特异度为92.86%(表3)。再者为2D ADC 75th取1.57×10- 3mm2/s时,诊断效能亦较高,AUC为0.891,敏感度和特异度分别为72.70%、92.86%(表3)。

表3 肺部良恶性孤立性实性病变2D及3D ROI的AUC比较
3 讨 论
由于恶性肿瘤细胞异常增生,水分子扩散空间有限,故在DWI上多呈高信号,相反大部分良性肿瘤由于细胞密度较低,在DWI上多呈低信号。然而肺部炎性病变中炎性细胞浸润、细胞脓性渗出以及纤维、小血管成分的增生,使得部分病灶内水分子扩散也会受到一定程度的限制,在DWI上亦可呈高信号[7]。因此,文献报道肺恶性肿瘤与炎性肉芽肿依据DWI的信号难以鉴别;然而,仍有文献报道两者之间存在ADC值的差异[8]。ADC值的测量方法主要包括以下两种:①在病灶最大截面或实性部分放置ROI测量获得2D ADC平均值;②测量病灶体积获得3D ADC直方图。文献报道肺癌是异质性明显的肿瘤,因此,仅凭借某一层面实性部分测量的ADC平均值难以反映肿瘤整体的异质性,而体积ROI的ADC直方图则可以一定程度上降低取样偏倚,病变内所有异质的区域均可从直方图反映,从而有望更准确评估病变组织的特征。与2D ADC直方图相比较,3D ADC直方图可以获得病灶体积的全部信息。
本研究发现恶性病变的2D及3D ROI中ADC最小值、最大值、均值及各百分位数均低于良性病变,这与较多其他部位的ADC直方图的研究结果相仿[9-11]。本组2D ADC直方图参数中诊断效能最高的前三者依次为ADC 75th、ADC 90th及ADC mean(AUC分别为0.891、0.883、0.883),3D ADC直方图组中诊断效能最高前三依次为ADC 50th、ADC median及ADC 75th(AUC分别为0.894、0.887、0.881),AUC均大于0.88,提示上述参数值在区分肺良恶性病变中均有较好的价值;其中以3D ADC 50th诊断效能最高,提示体积(3D)ROI可能优于单层ROI,但与2D ADC直方图参数差异没有统计学意义,表明病灶最大截面的2D ADC直方图测量同样具有较好的鉴别价值,且能大大节省测量时间,更方便于临床应用。
较多文献表示低分位ADC值用于良恶性鉴别以及肿瘤分级效果更佳,因为小ADC值代表病变细胞的高密集程度。而本研究结果表明在鉴别肺良恶性病变中,ADC值中高百分位数的诊断效能优于低百分位数的高,与Tsuchiya N[12-13]等少数研究结果类似。因此考虑可能与以下因素有关:①病种不同,病理类型不同,本组浸润性肺癌占比例最高,易分泌黏液;②各研究中使用MRI机器、扫描参数及软件等的不同可影响结果;③恶性肿瘤组织容易出现出血、坏死,导致病灶内的存在ADC值较高的部分;④良性组存在部分炎性病变,使得部分良性组病变的ADC值相对降低。
本研究表明偏度值对于肺内病灶良恶性的鉴别有一定价值,本组2D和3D 的ADC直方图恶性组均呈正偏度分布,这是由于恶性病变ADC值较小,较多分布于ADC直方图的左侧,良性病变则相反;本组结果与大多数研究相符。本研究中2D及3D ADC直方图中恶性组峰度值比良性组高,但无统计学意义,两组标准差较大,这可能与良性病变病例较少、病种复杂有关,使得恶性病变与良性病变的峰度值部分重叠有关。关于肺部病变的ADC直方图分析报道仍较少,尚需进一步扩大数据容量。
本研究有以下不足之处:①本组中良性病变组数量较少,可能会造成统计偏倚;②部分病灶由于磁敏感伪影导致变形,为减少伪影影响,故笔者将ROI放置在病灶边界以内,可能会使得部分病灶未包含在测量之内;③本研究ROI放置并未区分病灶内实性成分与坏死区。因此,今后研究中,将进一步扩大样本量及排除坏死及出血区,对比单纯病灶实性区域的放置ROI与病灶体积ROI放置的ADC直方图参数值的差异。

