鼠李糖乳杆菌对河豚毒素的免疫活性消减作用方式
叶精勤,肖 叶,阎 俊,许长华,汪立平,卢 瑛
(上海海洋大学食品学院,农业农村部水产品贮藏保鲜质量安全风险评估实验室,上海水产品加工及贮藏工程技术研究中心,上海 201306)
河豚鱼肉味腴美、鲜嫩可口,我国东南沿海地区、越南、韩国、日本和美国等许多地区和国家均有吃河豚的习惯,但由于河豚鱼的肝脏、卵巢、血液等[1]内脏含有大量的河豚毒素,食用河豚鱼导致的中毒事故屡次发生[2]。为了保证消费者的食用安全,我国从1990年开始禁止食用河豚,原卫生部在1990年11月20日公布《水产品卫生管理办法》中的第3条明确规定:“河豚鱼有剧毒,不得流入市场”[1]。2016年9月7日农业部办公厅与国家食品药品监督管理总局联合发布了《关于有条件放开养殖红鳍东方鲀和养殖暗纹东方鲀加工经营》的通知,通知称“按照先行先试、逐步开放的原则,先行有条件地放开养殖红鳍东方鲀和养殖暗纹东方鲀2 个品种产品的加工经营”[1]。通知中对养殖红鳍东方鲀和养殖暗纹东方鲀中河豚毒素(tetrodotoxin,TTX)含量仍有明确规定,其含量不得超过2.2 mg/kg。随着河豚鱼的市场化程度逐步加深,消费量逐年上升,其食用的安全性也成为关注的重点,有效地控制河豚鱼中的TTX可推进河豚鱼市场的健康发展。
乳酸菌是一类无芽孢的革兰氏阳性菌,以单糖和双糖为基质,发酵产物为乳酸[3],主要有球菌和杆菌两大类,属兼性厌氧菌,目前自然界已发现18 个乳酸菌属。乳酸菌是一类重要的益生菌,主要分布在肠道中,可平衡动物肠道内微生物及其相关代谢产物,(例如消减贝类毒素、黄曲霉毒素等多种有毒有害物质),还可抑制有害菌在肠道的繁殖,以此增加机体免疫功能[4]。Vasama等[5]发现活性和非活性鼠李糖乳杆菌Lactobacillus rhamnosus均可脱除麻痹性贝毒素,消除率为77.0%~97.2%。Bovo等[6]评估了7 株乳酸菌去除脱脂牛奶中黄曲霉毒素M1的能力,发现二者混合后,在相同的接触时间,热灭活乳酸菌细胞对黄曲霉毒素M1的去除率明显高于活细胞,热灭活乳酸菌细胞对黄曲霉毒素M1的去除率明显高于活细胞,且鼠李糖乳杆菌、保加利亚乳杆菌和乳双歧杆菌的热灭活细胞对黄曲霉毒素M1的去除率最高,其均大于33%。Serrano-Niño等[7]研究了5 种益生菌菌株结合黄曲霉毒素M1的能力,在第0小时乳酸菌对黄曲霉毒素的结合效率介于19.95%~25.43%之间,随着时间的变化,黄曲霉毒素M1的吸附效果并没有明显的变化。Ismail等[8]也发现黄曲霉毒素和乳酸菌可在刚接触的几分钟内迅速结合。Sarlak等[9]发现嗜酸乳杆菌是降低游离黄曲霉毒素M1中效果最优的益生菌菌株。当益生菌的菌株接种量为7(lg(CFU/mL)),反应pH值为4.5时,吸附脱脂奶中游离黄曲霉毒素M1效果最优,安全性、经济性最好。Zhao Hongfei等[10]发现乳杆菌L.plantarumB7和L.pentosusX8对伏马毒素有很高的去除效率。葛娜等[11]发现短乳杆菌CICC20023菌粉对橙汁中细交链孢菌酮酸的去除率达86.98%。Endo等[12]发现干酪乳杆菌JCM1134对7 种金属离子有明显吸附消除作用。徐颖等[13]发现双歧杆菌和鼠李糖乳杆菌对铅的耐受性较好,当吸附pH值为6、初始湿菌添加质量浓度为1 g/L时,双歧杆菌、鼠李糖乳杆菌对铅的吸附率分别为97.44%、96.87%。赵思佳等[14]发现5 株高压灭活组的乳酸菌对丙烯酰胺有很强的吸附能力,吸附能力最强的是植物乳杆菌ATCC8014,其对丙烯酰胺吸附率高达96.53%。根据现有的乳酸菌消减有毒、有害物质的报道,可以发现乳酸菌能够消减贝类毒素、黄曲霉毒素等多种有毒有害物质,具有效率高、特异性强、绿色无污染等优势,是毒素消减的有效方法。丁婕等[15]发现鼠李糖乳杆菌对TTX毒性有明显的消减效果。
为进一步探明消减的作用方式,实验首先对鼠李糖乳杆菌进行活化、热灭活、破碎共3 种方式处理并消减TTX,初步判断鼠李糖乳杆菌与TTX的作用方式后,再对鼠李糖乳杆菌进行组分分离探究不同组分对TTX免疫活性的影响,并进一步通过化学掩蔽菌体表面的氨基和羧基并结合傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析鼠李糖乳杆菌的作用位点和作用基团,探讨鼠李糖乳杆菌对TTX的消减作用方式,以期为河豚鱼加工后的高值化利用及副产物的无害化处理提供理论支撑,也为研究海洋生物毒素的去除机理提供参考。
1 材料与方法
1.1 材料与试剂
牛血清白蛋白(bovine serum albumin,BSA)标准品美国Sigma公司;6F7河豚毒素单克隆抗体由上海海洋大学水产品加工与储藏实验室制备;TTX标准品(纯度>99%) 上海诺冉生物科技有限公司;三羟甲基氨基甲烷(tris (hydroxymethyl) methyl aminomethane,Tris)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(均为分析纯) 生工生物工程(上海)股份有限公司;三氯乙酸(trichloroacetic,TCA)、酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法显色剂、NaCl、KCl、KH2PO4、Na2HPO4、HCl溶液(4 mol/L)、MgCl2(0.02 mol/L)、蔗糖溶液(0.5 mol/L)(均为分析纯) 国药集团化学试剂有限公司;吐温-20 上海阿拉丁生化科技有限公司;硒化锌窗口片天津博天胜达公司;鼠李糖乳杆菌由上海海洋大学分子生物学实验室保藏。
1.2 仪器与设备
HH-4数显恒温水浴锅 国华电器有限公司;高速冷冻离心机 日本日立公司;HS-3垂直混合器 宁波新芝生物科技股份有限公司;PL2002电子天平 瑞士梅特勒-托利多仪器(上海)有限公司;TS-8脱色摇床江苏海门其林贝尔仪器制造有限公司;Spotlight 400傅里叶变换红外光谱仪(DTGS检测器及Spectrum 100通用ATR UATR附件) 德国Perkin Elmer公司。
1.3 方法
1.3.1 鼠李糖乳杆菌的活化培养
将冻存于-80 ℃的鼠李糖乳杆菌接入MRS培养基中,37 ℃培养18 h,连续活化3 代后用于后续实验。
1.3.2 河豚毒素检测抗原的制备
根据刘敏慧等[16]的抗原制备方法进行部分修改。向2 mL离心管中加入630 μL质量浓度为1 mg/mL TTX标准品和410 μL BSA标准品,再逐滴加入10 μL体积分数为37%的甲醇溶液后旋涡振荡15 s直至加满126 μL便停止滴液,将制备溶液置于垂直混合器上避光混合72 h。
1.3.3 鼠李糖乳杆菌不同处理样品的制备
1.3.3.1 热灭活菌体的制备
根据Ge Na等[17]的热灭活菌体制备方法进行部分修改。鼠李糖乳杆菌菌落数生长至108CFU/mL时,取1 mL菌液,以4 ℃、12 000 r/min离心10 min后收集沉淀,再用磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗沉淀2 次后重悬,置于98 ℃恒温水浴锅中热灭活1 h后,以4 ℃、12 000 r/min离心10 min后收集沉淀,PBS清洗3 次后离心、收集沉淀,于4 ℃保存以供后续实验使用。
1.3.3.2 活化菌体的制备
鼠李糖乳杆菌的菌落数生长至108CFU/mL时,取1 mL菌液,以4 ℃、12 000 r/min离心10 min后收集菌体沉淀,PBS清洗3 次后离心、收集沉淀,于4 ℃保存以供后续实验使用。
1.3.3.3 菌体碎片的制备
按照活化菌体制备方的法得到菌体重悬液,添加溶菌酶至终质量浓度为1 mg/mL,于30 ℃恒温反应2 h,再用提前设置功率为400 W的超声波破碎仪持续超声破碎样品20 min[18]。以4 ℃、12 000 r/min离心10 min后收集沉淀,PBS清洗3 次后离心、收集沉淀,于4 ℃保存以供后续实验使用。
1.3.4 鼠李糖乳杆菌菌体不同组分的分离
1.3.4.1 去除胞外多糖
参照Chaabane等[19]去除胞外多糖(extracellular polysaccharide,EPS)的方法进行部分修改。调整鼠李糖乳杆菌的菌落数为108CFU/mL时,取1 mL菌液,以4 ℃、12 000 r/min离心10 min后收集沉淀,用灭菌PBS清洗2 次菌体后重悬,置于沸水浴中加热30 min后,快速冷却至室温,以4 ℃、12 000 r/min离心15 min后收集沉淀,4 ℃保存以供后续实验使用。
1.3.4.2 制备原生质体
将0.01 mol/L Tris-HCl溶液、0.02 mol/L MgCl2溶液和0.5 mol/L蔗糖溶液混匀后,用浓度4 mol/L的HCl溶液调pH值至7.6,过0.22 μm膜以配制乳杆菌原生质体高渗稳定液(Lactobacillusprotoplast high osmotic buffer,LPB),4 ℃保存待用。
调整鼠李糖乳杆菌的菌落数为108CFU/mL时,取1 mL菌液,菌液置于4 ℃冰箱中冷藏30 min,以4 ℃、6 000 r/min离心10 min后收集沉淀,PBS清洗沉淀2 次后重悬,添加溶菌酶至终质量浓度为20 mg/mL,37 ℃恒温水浴2 h,约1.5 h时取样,运用革兰氏染色法染色菌体并观察原生质体的形成情况,待80%菌株数目的菌体呈圆球形后停止酶解。以4 ℃、2 000 r/min离心15 min后收集沉淀,再用LPB溶液清洗2 次后重悬,4 ℃保存以供后续实验使用[20],使用前以4 ℃、2 000 r/min离心15 min后收集沉淀中的原生质体。
1.3.4.3 制备细胞壁和肽聚糖
调整鼠李糖乳杆菌菌落数为108CFU/mL时,取1 mL菌液,菌液离心后收集沉淀,PBS清洗3 次后收集沉淀,以400 W、30 min的条件超声破碎样品,以4 ℃、12 000 r/min离心15 min后收集沉淀,加入体积分数为8%的SDS溶液并沸水浴10 min后快速冷却至室温,离心后收集沉淀,用去离子水清洗沉淀至无泡沫,再加入质量浓度为3 mg/mL的胰蛋白酶溶液,并溶于浓度为0.10 mol/L Tris-HCl溶液(pH 7.6)后于设置37 ℃、200 r/min的摇床过夜8 h,以4 ℃、12 000 r/min离心20 min后收集沉淀,沉淀用去离子水清洗3 次以得到细胞壁。向沉淀中添加体积分数为10%的TCA溶液重悬,以4 ℃、16 h的条件垂直混合,以4 ℃、15 000 r/min离心20 min后收集沉淀,沉淀重悬于体积分数为10%的TCA溶液后沸水浴10 min,快速冷却至室温后以4 ℃、15 000 r/min离心20 min,收集沉淀,用去离子水清洗沉淀3 次以得到肽聚糖[19]。
1.3.5 鼠李糖乳杆菌的表面基团掩蔽
1.3.5.1 羧基的化学处理
通过化学处理掩蔽鼠李糖乳杆菌表面的羧基,测定掩蔽前后菌体消减TTX免疫活性的能力变化。按照活化菌体的制备方法得到菌体重悬液,调整菌落数至108CFU/mL,菌悬液以4 ℃、12 000 r/min离心10 min后收集沉淀,沉淀用超纯水清洗3 次,加入1 mL 0.1 mol/L HCl-无水甲醇(1∶1,V/V)于4 ℃垂直混合24 h后用超纯水清洗3 次,收集沉淀,于4 ℃保存以供后续实验使用[21]。
1.3.5.2 氨基的化学处理
通过化学处理掩蔽鼠李糖乳杆菌表面的氨基,测定掩蔽前后菌体消减TTX免疫活性的能力变化。按照活化菌体的制备方法得到菌体重悬液,调整菌落数至108CFU/mL,菌悬液以4 ℃、12 000 r/min 离心10 min后收集沉淀,沉淀用超纯水清洗3 次,加入1 mL甲醛-甲酸(1∶2,V/V)溶液,于4 ℃垂直混合6 h后用超纯水清洗3 次,收集沉淀,于4 ℃保存以供后续实验使用[21]。
1.3.6 TTX-BSA抗原偶联物的制备
为了得到用于ELISA检测的抗原,利用载体蛋白BSA和TTX标准品以1.3.2节的方法制备。
实验参考Kamath等[22]评价鼠李糖乳杆菌消减TTX免疫活性的方法进行部分修改。取KCl∶NaCl∶KH2PO4∶Na2PO4质量比为4∶160∶4∶23的混合液溶于去离子水中,用浓度为4 mol/L的HCl溶液调pH值为7.2,定容至1 L,加入500 μL吐温-20溶液混匀以配制PBST溶液。完全抗原TTX-BSA用50 mmol/L碳酸盐缓冲液(pH 9.6)稀释至质量浓度为10 μg/mL,于4 ℃包被过夜8 h后,用PBST溶液洗涤。用质量分数5%的脱脂奶粉37 ℃封闭2 h后洗涤。将各菌体样品消减TTX后的上清液与特异性单克隆抗体6F7等体积混合,37 ℃孵育1 h后加入酶标板孵育1 h,洗涤。加入辣根过氧化物酶-羊抗小鼠单克隆抗体(用抗体稀释液稀释2 500 倍)37 ℃孵育1 h,洗涤。然后加入ELISA显色试剂,室温反应15 min,最后加入终止液终止反应,并立即用酶标仪测定450 nm波长的OD值。以质量浓度为10 μg/mL的TTX-BSA与分别不加一抗单克隆抗体6F7、二抗羊抗鼠抗体作为阴性对照,以加一抗、二抗作为阳性对照,以50 μg TTX标准品作为样品竞争为对照组,每个样品做3 个平行组实验。样品中TTX消减率计算如式(1)、(2)所示:

式中:OD阳性、OD样品、OD阴性分别为阳性孔、样品孔、阴性孔的OD值。
1.3.7 鼠李糖乳杆菌表面的官能团变化分析
参考王静等[23]方法。用1.3.3节制备的菌体样品与1.3.6节方法消减TTX,得到消减前后的菌体重新用超纯水悬浮,用微量移液器分别吸取10 μL菌悬液于硒化锌窗片中心位置,45 ℃烘干至无水分的干燥菌斑。将载有样品的硒化锌窗片置于傅里叶红外变换光谱仪上进行光谱采集。参数设置为分辨率4 cm-1、扫描次数32 次。
将原始的红外谱图用处理软件Perkin Elmer Spectrum(Version 10.4.3)进行基线校正、多项式最小二乘法平滑处理得到样品的红外谱图。
1.4 数据处理
应用SPSS Statistics 23.0软件分析不同不同实验组之间消减率的显著性差异,Graphpad Prism 8.0.2软件绘制鼠李糖乳杆菌不同处理方式、不同组分、化学掩蔽基团分别与TTX消减率的关系图。
2 结果与分析
2.1 TTX-BSA抗原偶联物的制备
如图1所示,相较于TTX和对照载体蛋白BSA,偶联物TTX-BSA在200~220 nm处的吸收明显增强,其与丛蕾[1]和刘燕婷[24]等的发现一致,表明合成的抗原TTXBSA可用于后续ELISA分析。

图1 BSA、TTX和TTX-BSA的紫外光谱Fig.1 UV absorption spectra of BSA, TTX and TTX-BSA
2.2 鼠李糖乳杆菌与TTX的作用方式分析
2.2.1 不同处理方式的鼠李糖乳杆菌对TTX免疫活性的消减效果
如图2所示,活化菌体、灭活菌体和碎菌体均对样品溶液中TTX免疫活性有不同程度的消减作用,消减率越高则说明样品消减TTX效果越好,反之亦然。活化菌体、灭活菌体、碎菌体消减后消减率的均值分别为80%、79%、94%,活菌和灭活菌的消减率无显著性差异(P>0.05),碎菌体消减率有明显提高(P<0.05),表明鼠李糖乳杆菌对TTX的消减作用和菌体活性无关。Zhao Hongfei等[10]发现乳杆菌L.plantarumB7和L.pentosusX8对伏马毒素有很高的去除效率,毒素与菌株细胞的结合能力与细胞活力无必要关系。Yousefi等[25]研究指出乳酸菌对苯并芘、苯并蒽、䓛和苯并(b)荧蒽共4 种多环芳烃有去除能力,但是乳酸菌和这4 种多环芳烃的结合能力与细胞活力无关,酸处理、热处理和超声处理的细菌与多环芳烃的结合能力更强。Corassin等[26]也同样证明乳酸菌吸附黄曲霉毒素的能力与菌体活性无关。曾东等[27]研究发现非活性的植物乳杆菌F22能够更好地吸附黄曲霉毒素B1,说明植物乳杆菌F22对黄曲霉毒素B1的排除作用是物理吸附,而不是生物代谢。因此,实验推测鼠李糖乳杆菌对TTX免疫活性的消减很可能是源于TTX和菌体结构的结合作用。破碎菌体具有更理想消减效果的原因可能为其破碎的状态增加了菌体与TTX在结合时的接触表面积,因此细胞表面暴露更多的结合位点,增加结合效率。
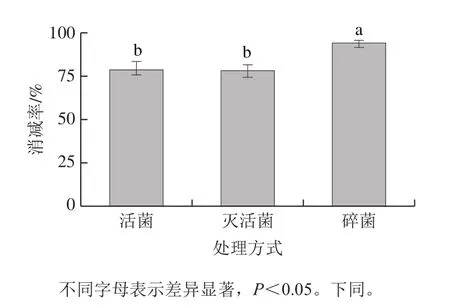
图2 鼠李糖乳杆菌活菌、灭活菌和碎菌消减TTX消减率Fig.2 Reduction percentage of TTX immunological activity by activated, inactivated and broken L.rhamnosus cells
2.2.2 鼠李糖乳酸菌不同组分对TTX免疫活性的消减效果
为进一步探究鼠李糖乳酸菌对TTX的消减作用部位,实验分离鼠李糖乳酸菌的不同组分,组分分离法是评价菌体内各组分对毒素吸附能力的主要方法[28]。通过不同处理方法制备鼠李糖乳酸菌的不同组分,分别与TTX作用后通过ELISA检测样品溶液中TTX的免疫活性,其结果如图3所示,完整鼠李糖乳酸菌、无EPS、鼠李糖乳酸菌细胞壁、鼠李糖乳酸菌原生质体、鼠李糖乳酸菌肽聚糖对TTX单克隆抗体的消减率平均值分别为33%、21%、14%、5%、47%。其中,鼠李糖乳酸菌原生质体对TTX免疫活性几乎没有消减作用,此结果与翟齐啸[21]发现乳酸菌原生质体在吸附镉离子过程中没有明显作用的结论相吻合。除原生质体样品外的其他4 种组分中,鼠李糖乳杆菌肽聚糖对TTX的毒性消减作用最强,比完整菌体的消减率增加14%(P<0.01)。Zhang Dan等[29]分析了4 种乳酸菌肽聚糖与丙烯酰胺的结合能力,发现植物乳杆菌1.0065的肽聚糖与丙烯酰胺的结合率最高。实验结果与Zhao Hongfei等[10]研究得出的乳酸菌肽聚糖为吸附、消除伏马毒素的主要菌体组分的结论大体一致。

图3 鼠李糖乳杆菌不同组分消减TTX消减率Fig.3 Percentage reduction of different component in L.rhamnosus
2.2.3 鼠李糖乳杆菌对TTX的消减作用位点分析
FTIR技术可读取微生物菌体细胞壁、细胞膜及细胞内肽聚糖、脂多糖、磷脂双分子层、蛋白质、水、脂肪、多糖以及核酸等物质结构的化学键振动情况,从而提供整个微生物菌体生化组成成分的光谱定量信息[30]。实验对鼠李糖乳杆菌的活菌、灭活菌和碎菌共3 种不同样品消减TTX前后的菌体样品进行FTIR光谱分析,结果如图4所示,结合其他研究发现消减处理前后光谱的变化[31-33]主要集中在以下4 点:1)1 660~1 535 cm-1是酰胺I、II带的吸收区域,1 652 cm-1和1 542cm-1处明显尖峰为-NH2的变形振动吸收峰;2)1 396~1 389 cm-1是氨基酸侧链的羧基对称拉伸吸收域; 3)1 452 cm-1处为氨基酸C-N伸缩振动;4)1 240~900 cm-1是多糖的吸收区域,1 147 cm-1处为CO-O-C的伸缩振动,1 078 cm-1处为C-O的伸缩振动。活菌和灭活菌在结合TTX前后的谱图变化相似,酰胺带和蛋白质羧基区域的吸收峰在结合TTX前后均发生明显位移,多糖区域的峰形有所变化,但位移变化不明显。碎菌体结合TTX前后的谱图变化更明显,酰胺II带、蛋白质C-N、多糖C-O和COO-C区域的峰位移发生明显变化,蛋白质的COO-峰形有明显变化。Shen Yu等[34]通过FTIR和能量色散X射线光谱分析发现,C=O、C-O和N-H组是乳酸菌吸附丙烯酰胺的主要官能团。李畅[35]通过探究戊糖片球菌菌株9-b-1与铅的作用,证明-COOH、-NH2、-OH、-H2PO4和-CO等官能团参与铅的吸附过程。由此可见,3 种处理方式与TTX结合前后的主要基团变化集中在蛋白质和多糖区域,其对应的峰值变化区域与肽聚糖的特征峰吻合[36],同时印证鼠李糖乳杆菌组分分离的肽聚糖是与TTX的主要结合位点,肽聚糖上N-H和COO-可能是鼠李糖乳杆菌对TTX起消减作用的主要官能团。

图4 鼠李糖乳杆菌活菌、灭活菌和碎菌消减TTX前后的FTIR图谱Fig.4 FTIR spectra of activated, inactivated and broken L.rhamnosus before and after incubation with TTX
为进一步探究鼠李糖乳杆菌表面官能团对TTX消减作用的参与,利用化学反应掩蔽鼠李糖乳杆菌表面的羧基和氨基,通过ELISA检测TTX消减后的免疫活性变化。如图5所示,发现未处理菌体、掩蔽羧基样品、掩蔽氨基样品对TTX单克隆抗体的消减率均值分别是33%、18%、38%,表明掩蔽羧基会使鼠李糖乳杆菌对TTX免疫活性的消减率明显降低(P<0.05),而掩蔽氨基对TTX免疫活性消减率基本无影响(P>0.05)。对比未处理菌体,掩蔽羧基样品的消减率降低说明消减后样品中残留TTX的免疫活性更强,TTX的消减更少。由此可见,鼠李糖乳杆菌表面羧基被掩蔽后,鼠李糖乳杆菌对TTX的消减效果会降低。Chakravarty等[37]发现掩蔽嗜酸细菌表面的氨基和羧基后,菌体对镉离子的吸附能力显著下降[37];Endo等[12]报道了通过化学修饰中和羧基中的负电荷,会降低发酵乳杆菌对镉和铅的结合。李畅[35]证明了细胞组成成分参与铅离子与乳酸菌的相互作用,羧基等活性官能团参与铅的吸附过程;Zhang Dan等[29]研究了植物乳杆菌1.006 5的肽聚糖在和丙烯酰胺结合过程中起到重要作用,肽聚糖中包含C-O的羧基、多糖和芳烃共3 种基团参与丙烯酰胺的结合。TTX因为其化学结构的特殊性,胍基是主要的正电中心[38],使得TTX整体带正电荷,而羧基带负电,化学修饰中和羧基会使菌体表面负电荷减少,降低鼠李糖乳杆菌与TTX结合的概率,因而掩蔽羧基会使得消减率下降。而掩蔽氨基样品的TTX免疫活性消减率没有明显变化,则表明鼠李糖乳杆菌表面氨基对TTX的免疫活性消减作用的影响不大,其原因可能为化学修饰掩蔽氨基减少鼠李糖乳杆菌表面的部分正电荷,破坏菌体和TTX之间的静电平衡,增加鼠李糖乳杆菌与TTX的结合概率,因而掩蔽氨基会使得消减率有所增加,但变化不明显。因此,鼠李糖乳杆菌表面的羧基为结合TTX的主要位点。

图5 鼠李糖乳杆菌的不同化学掩蔽基团消减TTX的消减率Fig.5 Reduction percentage of TTX immunological activity by L.rhamnosus with masking of different chemical groups
3 结 论
实验通过研究活菌、灭活菌和破碎状态的鼠李糖乳杆菌对TTX免疫活性的消减作用,发现鼠李糖乳杆菌与TTX的结合和鼠李糖乳杆菌的活性无关,可能是由鼠李糖乳杆菌与TTX间的相互作用所致。通过分析鼠李糖乳杆菌的不同组分对TTX的消减作用,发现菌体表面的肽聚糖是TTX的主要结合部位,因此对菌体表面的氨基和羧基官能团进行化学掩蔽,结合FTIR分析发现TTX与菌体表面肽聚糖的结合位点是肽聚糖上的羧基。因此鼠李糖乳杆菌与TTX通过肽聚糖的羧基而结合是消减TTX免疫活的关键。本实验为河豚鱼加工副产物的无害化处理提供理论支撑,为海洋生物毒素的去除机理探究提供参考。

