应用傅里叶红外光谱对干燥综合症伴龋齿患者口腔特征微生物的初步鉴别
周爽 蔡叶 袁志瑶 王旻
人体口腔内存在数以亿计的微生物,这些寄居在口腔各个部位的微生物,其组成和结构变化与口腔健康和疾病息息相关。口腔内微生物群落的变化,会引发许多口腔疾病,如龋齿、牙周病、牙髓炎、念珠菌感染、种植体感染及正畸体周围炎等[1]。因此,检测并判断口腔内微生物组成和群落的变化尤为重要。傅里叶红外变换光谱(FT-IR)技术具有灵敏度高、操作方便快捷、采样量少等优点,可以很好地应用于口腔特征微生物的研究,该方法还有一个重要的特征是不必对样品进行化学处理,只须对微生物进行简单的干燥压片,检测过程简单且无损。本文应用傅里叶红外变换光谱法(FT-IR)结合统计学对口腔内特征微生物进行研究。目前,傅里叶红外光谱应用于临床医学细菌和真菌的鉴别国内已有报道[2]。
干燥综合征(Sjögren syndrome,SS)是自身免疫性疾病,又称外分泌腺上皮细胞炎,自身免疫细胞对泪腺、唾液腺等外分泌腺体的进行性破坏导致患者主要表现眼干、口干、皮肤干燥等症状,并引起机体其它器官受累,甚至影响中枢神经系统[3]。目前干燥综合征的发病机制和病理机制仍不明确,患者在患病初期常常被误诊,从而耽误治疗,目前干燥综合症无法根治,患者极其痛苦。由于干燥综合症患者口腔唾液分泌量降低,唾液的润滑和抗菌作用减少使得口腔内微生物群落发生明显改变,临床上SS患者较正常人群更易患牙龈炎、牙周炎、猖獗龋等微生物感染性疾病[4]。
鉴于干燥综合症患者对猖獗性龋的易感性以及林场的难治性,很多医药领域学者都投入了相当多的关注,本文选取 5株特征菌株作为对照菌[5-10],采用傅里叶红外变换光谱对原发性干燥综合症伴有龋齿患者口腔微生物进行聚类鉴别,为今后椅旁快速检测干燥综合症猖獗性龋患者口腔内微生物提供一种简便快捷的操作方法。
1 材料与方法
1.1 仪器
数显恒温培养箱BluePard(上海一恒科技有限公司);电热恒温鼓风干燥箱RW-30(上海精宏实验设备有限公司);TENSOR-27-HTS-XT傅立叶红外微生物测量系统、微生物FT-IR图谱测量专用的B-module附件、DTGS检测器、ZnSe载样窗片、电动接种环、OPUS6.5分析软件(Bruke公司,德国);超纯水仪(Milipore公司,美国)。
1.2 培养基
PYG液体培养基基础;氯化血红素;微生物K1;胰酪大豆胨液体培养基(tryptic soy broth medium,TSB);胰酪大豆胨琼脂培养基(tryptic soy agar culture medi-um,TSA);沙氏葡萄糖液体培养基(sabouraud dextrose broth,SDB);沙氏葡萄糖琼脂培养基(sabouraud dex-troseagar culture medium,SDA);乳酸杆菌肉汤培养基;乳酸杆菌选择性琼脂;轻唾杆菌肽琼脂(mitis sali-varius bacitracinagar culture medium,MSBA)培养基;MRS琼脂培养基;巧克力平板培养基;念珠菌显色培养基;莫匹罗星锂盐。
1.3 标准菌株
白色念珠菌 (Candida albicans)[CMCC(F)98001];发酵 乳 杆 菌 (Lactobacillus fermentum);[ATCC 11739];变异链球菌 (Streptococcu mutans Clarke)[ATCC 25175];干燥奈瑟菌(Neisseia sicca)[ATCC 9913];短双歧杆菌(Bifidobacterium breve)[ATCC 15700]。以上菌种由中国医学细菌管理保藏中心和中国微生物菌种保藏中心提供,实验中均使用第3代。
1.4 待测菌株
纳入2017年6~12月于南京市鼓楼医院风湿免疫科就诊的伴有龋齿SS患者20例,患者均签署知情同意书。SS的临床诊断依据是美国风湿病学会(ACR)于 2012年提出的[11]:RF(+)伴 ANA>1:320,血清SSA和/或SSB抗体(+),角结膜染色评分>/=3分,唇腺病理活检示淋巴细胞灶≥1个/4 mm2,患者均符合上述标准中的2项。20例SS患者系经问卷调查及临床检查后确诊,均为女性,年龄45~55岁,首次确诊SS,患者自觉眼干,口干后发现口内多颗牙变色、缺损,伴冷刺激敏感,无治疗史,病程6个月以上,无其他系统性疾病,如糖尿病、肝炎、结核等。患者口腔样本采集前,嘱饮用水漱口,并于取样前30 min内禁止饮食、吸烟、咀嚼口香糖等[12]。采用无菌棉签刮拭患者龈上近龈缘处菌斑[13-14],将棉签立即置于无菌10 mL生理盐水中,4℃冰箱保存,12 h内转种。
1.5 实验方法
1.5.1 标准菌株的纯培养 5株标准菌株冻干菌粉经过复溶、转种复舒后均采用第3代菌种。根据菌株不同的生长条件选择适宜的培养基和培养条件,白念接种于平板培养基中,35℃培养24 h;变异链球菌和干燥奈瑟菌于TSA平皿上35℃培养24 h;发酵乳杆菌于MRS琼脂平皿中35℃厌氧培养48~72 h;短双歧杆菌接种于莫匹罗星锂盐改良的MRS琼脂平皿上,35℃厌氧培养48~72 h。
1.5.2 待测菌株的纯培养 分别取20例pSS患者唾液样本各1 mL接种于TSB、SDB、PYG液体培养基和乳酸杆菌肉汤培养基中,将TSB和SDB置于35℃,培养24 h,PYG液体培养基和乳酸杆菌肉汤培养基置于35℃厌氧培养72 h。TSB培养物分别划线于MSBA琼脂平板和巧克力琼脂平板上,35℃培养24 h;SDB培养物划线于SDA琼脂平板和念珠菌显色培养基平板上,35℃培养24 h;PYG培养物划线接种于莫匹罗星锂盐改良MRS琼脂平板上,35℃厌氧培养24 h;乳酸杆菌肉汤培养物接种于乳酸杆菌选择性琼脂平板上,35℃厌氧培养24 h。
挑取各分离平板上生长的疑似菌落,20例SS患者唾液样本共分离培养出9株白色念珠菌疑似菌,12株发酵乳杆菌疑似菌,9株变异链球菌疑似菌,1株干燥奈瑟菌疑似菌,9株短双歧杆菌疑似菌。挑取典型菌落接种于相应的斜面培养基中进行纯培养。
1.5.3 样品制备 20例pSS患者口腔的提取样本经过增菌、分离培养后,于相应的平板培养基上35℃需氧或厌氧培养24 h,标准菌株划线接种于相应的平板培养基中35℃需氧或厌氧培养24 h。采用校准过的电动铂金接种环,从斜面培养基上挑取1~2环菌苔,置于100μL超纯水中制成均匀的菌悬液,取15μL置于ZnSe载样窗口上,于35℃恒温干燥培养箱中干燥,直至成透明的菌膜。
1.5.4 傅立叶红外变换光谱的采集 载有样品的ZnSe充分干燥后置于样品仓中,测定傅里叶红外吸收光谱,光谱范围选择:3 000~9 00 cm-1,光谱分辨率为4 cm-1,自动平滑处理。光谱扫描时扣除噪声、CO2和H2O的干扰。
1.5.5 傅里叶红外图谱的处理和分析 按照FT-IR光谱采集SOP的要求,对待测菌株和标准菌株在相应的相同条件下培养后,进行光谱采集,每株菌采集3张图谱,最终取平均得到平均图谱。不同种类的微生物的FT-IR图是不同的,真菌的特征区域光谱范围根据各个生物大分子红外特征谱对于真菌分类的贡献大小,选定 1 800~1 485、1 485~1 185、1 185~900 cm-1(蛋白质、脂类,磷酸盐化合物、和多糖),细菌的分类主要体现在细胞壁多聚糖,细胞质中蛋白质、类脂和细胞膜脂肪酸的吸收上,选择1 200~900、1 500~1 400、3 000~2 800 cm-13个谱段进行为光谱分析灵敏区,用于分类和聚类分析[15-16]。
采用聚类分析法对图谱进行分析,OPUS 6.5分析软件对图谱进行归一化和一阶导数处理,并进行极限校准,透光率转化,采用离差平方和法(Ward's)计算距离,距离越近,两株菌具有相似性越高[17]。
将上述各菌的3 000~900 cm-1波数的图谱进行聚类分析,得到试验菌和标准菌的聚类分析树形图。
2 结 果
将标准菌株白色念珠菌、发酵乳杆菌、变异链球菌、干燥奈瑟菌和短双歧杆菌5株标准菌株按照SOP的要求培养后,每株菌采集3张图谱,剔出掉溢出光谱,从图1可见(红色、绿色、紫色、深蓝、浅蓝分别代表白念、干燥奈瑟菌、短双歧杆菌、发酵乳杆菌和变异链球菌标准菌的FT-IR红外吸收图谱),它们的傅里叶红外图谱各不一样。将5株菌的FT-IR图谱经过矢量归一化,一阶求导后,特定谱段进行聚类分析,得到树形图(图2),5株菌的差异距离都比较大。

图1 5株标准菌的傅里叶红外光谱图Fig 1 FTIR spectrum of 5 standard bacteria

图2 5株菌的傅里叶红外光谱聚类分析距离Fig 2 Cluster analysis distance of 5 strains by FTIR
将患者口腔分离出来的白色念珠菌疑似菌、变异链球菌疑似菌、发酵乳杆菌疑似菌、干燥奈瑟菌疑似菌和短双歧杆菌疑似菌分别与标准菌株进行比对,红外图谱经过矢量归一化,一阶求导后进行聚类分析,结果见图3~7。
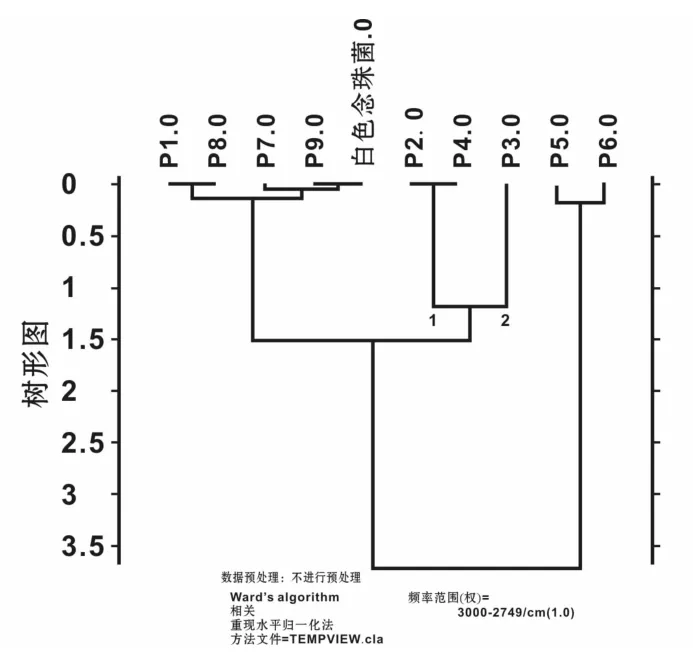
图3 9株白念疑似菌与白念标准菌聚类分析结果Fig 3 Cluster analysis results of 9 suspected and standard Candida albicans

图4 9株变链疑似菌与变链标准菌聚类分析结果Fig 4 Cluster analysis results of 9 suspected and standard Streptococcus mutans

图5 12株发酵乳杆菌疑似菌与标准菌株聚类分析结果Fig 5 Cluster analysis results of 12 suspected and standard strains of Lactobacillus fermentans

图6 干燥奈瑟菌疑似菌与标准菌株聚类分析结果Fig 6 Cluster analysis results of suspected and standard strains of Neisseria sicca

图7 短双歧杆菌疑似菌与标准菌株 聚类分析结果 Fig 7 Cluster analysis results of suspected and standard Bifidobacterium brevis
3 讨 论
SS患者最重要的临床表现是唾液腺受损,唾液减少,因此唾液的润滑、清洁和抗菌作用减弱或消失,正常口腔环境的改变使得口腔内菌群失调,某些条件致病菌转化为致病菌,引起口腔感染性疾病。本实验选择的是五株临床较为常见的菌株,本研究认为在口腔环境改变下,这些条件致病菌可能转化为致病菌,造成SS患者口腔菌群失调,并与猖獗龋、黏膜炎症等疾病存在相关性。
从SS患者口腔中分离到的疑似菌中,发酵乳杆菌、变异链球菌和白色念珠菌的比例最高,在与标准菌株进行聚类分析之后,变异链球菌和白色念珠菌分别有4株和2株与标准菌聚为一类,在选择性平板上疑似菌生长的大小、颜色形态和生理特征都与标准菌株相似,因此可以推断,这些疑似菌可能与标准菌株属于同一属,在种水平上存在差异。发酵乳杆菌、变异链球菌和白色念珠菌的检出率高,我们推测,与干燥综合症患者易发龋病有一定的关系。
这5株标准菌株与20例SS伴龋齿患者口腔提取物进行红外光谱比对,能够快速的鉴别出患者口腔内是否含有目标菌株,对临床微生物的快速鉴别有一定的指导意义。
傅里叶红外变换光谱技术作为一个全细胞红外图谱信息,能够快速的鉴定菌株的类别,对于临床疾病临床快速检测具有一定的意义,它利用不同种微生物之间蛋白质、磷脂、多糖等结构红外吸收的不同,光谱存在差异,以此对微生物进行鉴别。光谱的差异性主要表现在吸收峰的位置、强度和峰形上。它的优点是操作简便,成本低,时间短。其局限性在于,利用微生物中所含物质的不同来判别光谱的差异性,会受到微生物生长阶段、生长环境等不同因素的影响,影响结果判断;另外微生物的鉴别受到对照菌选择的限制,在今后的研究中,将进一步收集病例,扩大样本量,不断地增加傅里叶红外光谱菌库范围,有望实现临床致病微生物的快速鉴别。

