马兜铃酸和缺血再灌注所致急性肾损伤后慢性肾脏病小鼠模型的比较*
谭 微,邓军辉,吴志芬,郑卢权,杨聚荣
(重庆医科大学附属第三医院肾内科 401120)
急性肾损伤(AKI)是一个全球性的公共健康问题,每年约1 330万人受累,死亡170万人[1]。幸存者中仅少部分患者可完全恢复,部分直接进展为慢性肾脏病(CKD),甚至终末期肾病(ESRD)。据报道,需透析支持的AKI患者大部分都直接进展为CKD[2],总体来说约20%的AKI患者在3年后会发展为CKD[3-4],AKI是CKD的独立危险因素[5]。但是AKI过渡为CKD的确切机制尚不完全清楚,亦无有效治疗手段。揭示AKI-CKD的重要机制,将为其治疗提供新的靶点,有望改善远期预后。动物模型是研究机制和开发潜在治疗靶点的工具,目前用于研究AKI后CKD的动物模型最常见的为缺血再灌注损伤(IRI)、肾毒性药物损伤,尽管临床上马兜铃酸损伤(AAI)的发病率不高,但HONARPISHEH等[6]的研究认为马兜铃酸优于顺铂和叶酸,因此,选择马兜铃酸为药物损伤代表。本研究比较马兜铃酸及缺血再灌注所致AKI-CKD模型的差异。
1 材料与方法
1.1 材料
1.1.1实验动物
本实验采用SPF级雄性BALB/c小鼠,8周龄,体重20~23 g,购于重庆医科大学实验动物中心,饲养于重庆医科大学实验动物中心,环境温度为(25±2)℃,湿度为50%~70%,12 h光照阴暗交替。
1.1.2实验试剂
Schiff染液、苏木素染液购自中杉金桥生物有限公司。Regaud苏木精:苏木精1 g,95%乙醇10 mL,甘油10 mL,蒸馏水80 mL。Masson丽春红酸性复红液:丽春红0.7 g,酸性复红0.3 g,蒸馏水99 mL,冰醋酸1 mL。1%冰醋酸水溶液:冰醋酸0.2 mL,蒸馏水100 mL。1%磷钼酸水溶液:磷钼酸1 g,蒸馏水100 mL。1%苯胺蓝水溶液:苯胺蓝2 g,蒸馏水98 mL,冰醋酸2 mL。1%光绿水溶液:光绿1 g,蒸馏水100 mL。
1.2 方法
1.2.1AAI模型
雄性BALB/c小鼠60只,分为假手术组和AAI组,每组30只。马兜铃酸5 mg以生理盐水稀释为1 mg/mL,AAI组以5 mg/kg剂量腹腔内注射,对照组注射等量生理盐水。两组均于给药后第1、3、7、14、28、42天处死动物,AAI组分别以AAI组-1 d、AAI组-3 d、AAI组-7 d、AAI组-14 d、AAI组-28 d、AAI组-42 d命名,腹腔注射水合氯醛麻醉,经小鼠眼眶采血,并打开胸腔行心脏灌注后,取双侧肾组织标本,去除肾脏包膜,部分肾脏固定于4%多聚甲醛,用于肾脏病理组织染色。
1.2.2IRI模型
雄性BALB/c小鼠60只,分为假手术组和IRI组,每组30只。小鼠予以腹腔注射5%水合氯醛溶液0.1 mL/10 g剂量麻醉,IRI组做背部两侧切口,游离双侧肾蒂,使用血管夹夹闭双侧肾蒂,观察肾脏颜色变黑后计时,小鼠置于37 ℃恒温台保持温度,伤口用生理盐水纱布覆盖,32 min后移去血管夹,确认肾脏颜色变鲜红后,缝合两侧切口;假手术组小鼠做背部两侧切口,游离双侧肾蒂后缝合切口。术后分别于再灌注后第1、3、7、14、28、42天处死动物,IRI组分别以IRI组-1 d、IRI组-3 d、IRI组-7 d、IRI组-14 d、IRI组-28 d、IRI组-42 d命名,再次腹腔注射水合氯醛麻醉,经小鼠眼眶采血,并打开胸腔行心脏灌注后,取双侧肾组织标本,去除肾脏包膜,部分肾脏固定于4%多聚甲醛,用于肾脏病理组织染色。
1.2.3肾功能检测
采集的血液于离心机离心(3 000 r/min,10 min)后取上清液,采用自动分析仪(德国Beckman 5800)检测小鼠血清肌酐、尿素氮水平。
1.2.4肾组织PAS染色
肾组织用4%多聚甲醛固定过夜,冲洗、脱水、石蜡包埋后切片,行PAS染色观察肾脏病理损伤程度。将切片浸入高碘酸氧化液中10~20 min,蒸馏水洗2次;Schiff液染色10~30 min,流水冲洗5 min;苏木素染细胞核3~5 min,在盐酸乙醇中分化,自来水洗至细胞核变蓝;然后脱水、透明、封固。双盲情况下由2名肾脏病理医师在200倍光学显微镜下观察并评分,每个标本至少随机观察10个不重复视野。肾小管损伤的严重程度由组织学评分系统量化:0分代表没有损伤;1分(0%~10%)和2分(>10%~20%)为轻度损伤;3分(>20%~40%)、4分(>40%~60%)为中度损伤;5分(>60%~75%)、6分(>75%)为重度损伤。
1.2.5肾组织Masson染色
肾组织用4%多聚甲醛固定过夜,冲洗、脱水、石蜡包埋后切片,行Masson染色。石蜡切片脱蜡至水,依次自来水和蒸馏水洗,Regaud苏木精染液染核5~10 min,充分水洗,温水返蓝,Masson丽春红酸性复红液5~10 min,1%磷钼酸水溶液分化3~5 min,1%苯胺蓝或光绿液染5 min,1%冰醋酸水溶液分化30 s,95%乙醇、无水乙醇、二甲苯透明,中性树胶封固。
1.3 统计学处理
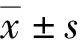
2 结 果
2.1 造模后小鼠死亡率
对照组均无小鼠死亡。AAI组腹腔注射马兜铃酸后,第7天死亡2只,死亡率6.7%。IRI组术后第1天死亡4只,第2天死亡2只,共死亡6只,死亡率20.0%。两组比较IRI组死亡率更高,差异有统计学意义(P<0.05)。
2.2 小鼠体重变化情况
两对照组小鼠体重随时间逐渐增加。IRI组和AAI组小鼠出现不同程度体重下降,AAI组小鼠体重下降更显著(P<0.05)。IRI组小鼠体重轻度下降,术后第7天恢复,AAI组小鼠体重给药后第7天最轻,后逐渐恢复,至第42天AAI组和IRI组体重均低于各自对照组(P<0.05),见图1。

图1 小鼠造模后体重变化
2.3 小鼠血清尿素、肌酐水平
造模后IRI组和AAI组小鼠均出现不同程度血肌酐、尿素升高,但达峰时间存在差异,IRI组术后第1天最高,AAI组术后第7天最高,至造模后42 d均高于各自对照组。两组间峰值亦存在差异,IRI组的峰值血肌酐、尿素高于AAI组(P<0.05,图2)。

图2 小鼠血清尿素、肌酐水平
2.4 小鼠肾脏纤维化情况
Masson三色染色后肾组织中的胶原纤维呈蓝色,是检测器官纤维化的常用染色方法之一。两个对照组肾小管-间质几乎未见阳性的胶原组织(图3A),造模后第7天IRI和AAI组仍无明显蓝色胶原纤维,14 d开始至42 d肾脏组织中可见蓝色染色阳性(图3B、3C),AAI组阳性面积多于IRI组,差异有统计学意义(P<0.05,图3D),并伴有肾小管萎缩、间质炎性细胞浸润。

A:AAI对照组-42 d、IRI对照组-42 d Masson染色(×400);B:AAI组不同时间点小鼠肾组织Masson染色(×400);C:IRI组不同时间小鼠肾组织Masson染色(×400);D:AAI组、IRI组不同时间点Masson阳性表达面积。
2.5 肾组织PAS染色及肾小管损伤评分
两个对照组小鼠肾小球和肾小管结构正常。肾小管细胞上皮细胞连接紧密、形态规则、排列整齐、边缘完整,细胞间隙未见水肿和炎症浸润(图4A)。AAI和IRI组损伤后表现为不同程度的肾小管上皮细胞大量坏死、脱落,基底膜裸露,管腔内管型形成,肾间质水肿,并伴有炎性细胞浸润等病理表现(图4C、D)。IRI组以第1天损伤最重。AAI组以第7天组织损伤最重,可见大量管型,至第42天部分肾小管仍无完整结构。肾小管-间质损伤评分结果显示,IRI组第1天高于AAI组,而AAI组第7天明显高于IRI组(P<0.05,图4B)。

A:AAI对照组-7 d、IRI对照组-1 d PAS染色(×400);B:AAI组、IRI组小鼠不同时间点肾小管损伤评分;C:AAI组不同时间点小鼠肾组织PAS染色(×400);D:IRI组不同时间点小鼠肾组织PAS染色(×400)。
3 讨 论
AKI的发病率和病死率均较高,其严重程度及频率决定了CKD的进展[7]。轻度损伤时肾脏可完全恢复,损伤较重或反复损伤后可能导致不恰当修复,最终发生不可逆的纤维化,进展为CKD。寻找稳定且可再现的AKI-CKD模型对于揭示其病理生理机制至关重要。
尽管当前认为IRI模型缺乏稳定性,但因其较好的临床相关性,被作为经典模型广泛应用。IRI是临床AKI的主要原因,特别是双侧IRI模型可较好模拟人体内AKI的病理生理过程,因为人体内的缺血再灌注以双侧肾脏为主。已报道的IRI模型用于研究AKI-CKD进程中内质网的应激、补体的激活、巨噬细胞的浸润等[8-10],以及抗凝血酶Ⅲ减轻AKI后CKD的进展[11]。但IRI模型对实验者操作技术要求更高,且因其创伤更大,术后死亡率更高,还存在造模不稳定、模型参数变化大等瓶颈。报道的缺血时间为30、32、35 min不等[12-14],本研究采用中间时间32 min,通常情况小鼠肾脏缺血时间越长,急性期肾损伤程度越重,后期更易进展为CKD,但这也意味着更高的死亡率。缺血过程中夹闭双侧肾动脉的动脉夹亦至关重要,若血流阻断不完全,即使相同的缺血时间,肾脏受损的程度亦不一致。此外,缺血过程中小鼠的体温也影响IRI后的转归,相同的缺血时间,体温相差0.5 ℃也可能导致完全不同的转归,偏低的体温更有利于实验动物耐受IRI[15-16]。因此,造模过程中肾动脉血流完全阻断、严格稳定的温度控制、娴熟的手术技巧,均是保证IRI模型稳定和可靠的关键因素。
既往研究认为,AAI模型可能会导致急性期近端小管细胞损伤和坏死、氧化应激,以及慢性期进行性间质性肾纤维化[12,17],给药方法包括一次性腹腔注射或连续注射。马兜铃酸肾病的临床病理特点表现为近端小管上皮细胞萎缩伴间质纤维化。而小鼠给予马兜铃酸腹腔给药后,急性期表现为急性肾小管损伤,后期出现细胞外基质沉积,并伴炎性反应,与本研究的结果一致。当然,不同的小鼠品系在造模过程中可能表现并不完全一致,这需要在实验过程中进一步摸索条件,而其他的诸如麻醉剂量、小鼠年龄、性别和喂养条件等均可以得到较好地控制。
本研究中AAI和IRI均可成功诱导AKI-CKD模型,急性期小鼠肾功能部分丢失,肾小管上皮细胞坏死、脱落、管型形成,慢性期小管萎缩、间质纤维沉积。与AAI组比较,IRI组死亡率更高,肾脏损伤出现更早,纤维化程度较轻。综合评估AAI模型简单、稳定,组织学特征与临床病理改变相似,且动物存活率更高,更能完整全面地评估肾脏的远期预后,是研究AKI-CKD的较好模型。但AKI-CKD的不同模型在机制上是否存在差异,尚有待后续的深入研究,如果实验设计是证实AKI-CKD 转归的共性机制,可以纳入两种以上的动物模型。
——凹脉马兜铃

