镉对渤海本地种的急性毒性效应及其海水水质基准推导*
陈 莉, 蔡文倩, 韩雪萌, 雷 坤
(1. 天津科技大学海洋与环境学院, 天津 300457; 2. 中国环境科学研究院环境基准与风险评估国家重点实验室, 北京 100012)
随着人类活动的增多,近海重金属污染愈发严重,已成为世界关注的环境问题[1]。重金属是指密度大于4.0 g/cm3、强毒性、不易还原、不易降解的金属[2]。研究证实,重金属污染严重危害近岸海域水生态系统健康,并且经由食物链威胁人类健康[3]。镉是最常见的重金属之一,在全世界近岸海域普遍存在[4],包括环渤海地区[5]。镉对水生动物具有广泛的毒性[6],高浓度的镉能影响水生生物的生理生化过程,不仅对水生生物的酶活性产生影响,还可能破坏膜系统,改变细胞形态结构,从而影响组织细胞结构,并能对虾蟹类的卵巢发育产生抑制作用,降低受精卵孵化率,导致胚胎畸形[7]。胚胎-早期幼体阶段的生物对镉的反应最敏感表现为胚胎中ATP的合成和酶的活性受到抑制,导致胚胎发育畸形[8]。即使是水体中沉积的镉,也会在一定条件下重新释放出来危及水生生物的生长发育[9]。
为保护水生生物,世界各地开展了重金属基准制定理论和方法的研究。美国于1980年开始重金属基准研究[10],于1985年发布《推导保护水生生物及其用途的数值型国家水质基准的技术指南》(USEPA,1985),由此建立了双值基准体系,现已成为全世界普遍使用的方法。该方法要求受试生物至少来自3门8科,基准推荐值由基准最大浓度和基准连续浓度组成。随后,美国又于1999年[11]、2002年[12]、2004年[13]、2006年[14]和2009年[15]修订了《国家推荐的水质基准》文件。目前,最新的美国国家基准文件于2016年颁布实施,给出了包括铅、镉、铬、汞、铜、铁、锌、硼、镍、硒和银等金属离子的淡水和海水基准最大浓度推荐值和基准连续浓度推荐值[16]。澳大利亚和新西兰在美国的研究基础上[17],于2000年提出了《澳大利亚和新西兰淡水和海水水质指南》,并提出了采用“指导性触发值(Trigger values,TVs))”制定保护水生生物的水质基准[18-19],而欧盟则是提出根据无效应浓度 (Predicted environmental concentration, PNEC) 来制定污染物水质基准[20]。目前,水质基准推导方法主要有物种敏感度分布曲线法(Species sensitivity distribution, SSD)、物种敏感度排序法(Species sensitivity rank,SSR)和评价因子法(Assessment factor, AF)等[21]。近年来,仅由评价因子法推导的水质基准因缺乏科学有效的验证,用的较少,而糅合评价因子法的SSD[22]和SSR[23]都使用的较为广泛。其中,当污染物物种敏感度分布连续且呈正态分布时[24-25],推荐采用SSR法[23]。
渤海作为京津冀发展一体化陆源排放受污染的主要区域,海洋环境保护成效关系到京津冀地区的经济发展活力。该区域每年接受大量的污染物,其污染效应已导致该区域生态系统服务功能下降,生物多样性降低[26]。研究证实,重金属,包括铅和镉污染,是该区域最典型的污染类型之一[27],尤其是渤海湾西部和辽东湾北部海域,水体、沉积物和生物体内的重金属含量均较高[5],严重影响栖居于此的水生生物,进而威胁人体健康[28]。因此,亟需制定相应水环境标准来支撑该区域海洋环境污染防治工作。然而,我国在基准研究方面还处于借鉴国外水质基准和摸索理论方法阶段[21]。近年来国内学者对水质基准进行了一些有益的探索,相继推导出了适用于中国及部分水域的淡水环境基准阈值,如重金属、有机物和无机物等的淡水水质基准[29-35]。然而,关于区域性的海洋环境基准阈值研究尚处于探索阶段。考虑到区域差异,本研究以渤海本地种进行毒性实验,同时结合收集的镉对海洋生物的毒性数据,利用基于Log-triangular模型的物种敏感度排序法推导了镉的海水水质基准,以期为制定符合该区域特征的重金属海水环境基准值提供科学依据。
1 材料与方法
1.1 数据获取与筛选
收集筛选镉对渤海海洋生物的急性毒理数据LC50(半致死浓度)及补充急性毒性实验。数据主要来源于USEPA的生态毒理学数据库ECOTOX(http://cfpub.epa.gov/ecotox/)、TOXNET毒性数据库(http://toxnet.nlm.nih.gov)和GEO数据库(www.ncbi.nlm.nih.gov/geo)等以及Springer、Elsewier、中国知网(https://www.cnki.net/)和维普数据库(http://www.cqvip.com/)等。筛选出栖居于渤海的海洋生物,剔除不符合毒理学实验设计要求及不适合渤海水环境基准计算的数据,如只在实验室养殖的生物数据等。数据筛选完成后对毒性数据进行整理,对同一物种不同生命阶段(例如卵、幼体和成熟体)的毒性数据,选择该物种最敏感生命阶段的数据,同一个物种有多个毒性数据时,舍弃具有量级差异的数据,取其几何平均值作为种平均值(Species mean acute values,SMAV),对同一属的物种则计算其属平均值(Genus mean acute values,GMAV)。
1.2 急性毒性实验
1.2.1 实验试剂 氯化镉(CdCl2,AR)为国产分析纯试剂,采购自天津市大茂化学试剂厂。用去离子水配制成含镉离子的母液,再根据需要用人工海水稀释成所需的重金属质量浓度梯度。
1.2.2 受试生物与驯养条件 分析筛选整理后的毒理数据,根据渤海海洋生物分布特征,室内补充了6种海洋生物的急性毒性实验,分别为以海洋污染环境中的敏感物种为代表的:青岛大扁藻(Platymonashelgolandicatsingtaoensis)、褶皱臂尾轮虫(Brachionusplicatilis)、日本虎斑猛水蚤(Tigriopusjaponicus),渤海海域代表种-许氏平鲉(Sebastesschlegeli)及褐牙鲆(Paralichthysolivaceus)和渤海海域经济种-天津厚蟹(Helicetridenstientsinensis)。所有生物均在实验室内驯养一周,室内自然死亡率控制在5%以内,选择活力良好的个体进行毒性试验,在试验前24 h内不喂食。
藻类 青岛大扁藻属绿藻门,团藻纲,团藻目,衣藻科,扁藻属[36]是我国渤海海域内广泛分布的海洋微藻类,其个体小、结构简单,对水生态环境的变化极为敏感,作为海洋食物链的基础和海洋生态系统中最主要的初级生产者,青岛大扁藻是受污环境中十分理想的指示生物[37]。大扁藻由中国海洋大学生态毒理学实验室提供,预先采用f/2培养基,以盐度为15的灭菌人工海水为基础介质,在室内光照培养箱中恒温培养4 d,光照为3 000 Lux,光暗比为12 h∶12 h,温度为(22±1) ℃,培养过程中定时摇动。采用两个周期活化、扩大培养后的藻种,镜检无异常的藻液用于实验。
浮游动物 褶皱臂尾轮虫属轮虫门,单巢纲,游泳目,臂尾轮虫科,臂尾轮虫属[38],适应能力强,对污染毒物具有较高的灵敏度,是海洋生态毒理学研究中重要的研究生物[39]。褶皱臂尾轮虫由中国海洋大学生态毒理学实验室提供,置于光照培养箱内培养,温度为(22±1) ℃,光照为3 000 Lux,光暗比为16 h∶8 h,盐度为15,灭菌人工海水。驯养期间,每天喂食蛋白核小球藻(Chlorellapyrenoidosa)一次,喂食前进行吸底清理,每5天进行换缸以保障轮虫保持孤雌生殖,培养所用的器皿均经过高压灭菌处理。挑选挂卵的轮虫置于6孔板中培养,6 h之后挑取轮虫幼虫用于实验。
甲壳动物 日本虎斑猛水蚤为节肢动物门,甲壳纲,桡足亚纲,猛水蚤目,虎斑猛水蚤属,对环境变化适应性强,繁殖快,是小型底栖生物的重要组成部分,处于海洋底栖食物网的中间环节,是海洋环境变化指示生物的重要类群之一[40]。日本虎斑猛水蚤由中国海洋大学生态毒理学实验室提供,驯养期间,每日用青岛大扁藻、三角褐指藻(PhaeodactylumtricornutumBohlin)和活性酵母的等比混合物饲喂1次。置于光照培养箱内培养,温度为(22±1) ℃,光照为3 000 Lux,光暗比为12 h∶12 h,盐度为15的灭菌人工海水,定期更换海水。选用实验条件下同一母体培养3代以上、出生6~24 h的幼蚤为实验蚤。
天津厚蟹为节肢动物门,甲壳纲,十足目,方蟹科,厚蟹属,是广泛分布于渤海高潮带、潮上带及河口附近的一种经济蟹类[41]。实验所用天津厚蟹于2019年4月27日至5月8日期间在天津北塘永定新河入海口潮间带(39°06′5.17″N, 117°43′39.96″E)所采。在铺设小粒径砾石的避光鱼缸中用盐度为20的灭菌人工海水进行驯养,每日饲喂双齿围沙蚕(Perinereisaibuhitensis)及卤虫(Artemiasalina)一次,定期更换人工海水,室内驯养一周挑选活力良好的厚蟹进行实验。
鱼类 褐牙鲆为脊索动物门,硬骨鱼纲,鲽形目,牙鲆科,牙鲆属。许氏平鲉为脊索动物门,硬骨鱼纲,鲉形目,平鲉科、平鲉属。褐牙鲆、许氏平鲉购自青岛市贝宝海洋科技有限公司,实验用鱼为1个月左右的幼鱼,买回实验室后,用200 L的缸在黑暗条件下驯养7 d,加曝气以保证水中溶解氧在8.00 mg/L左右,每日换140 L盐度为30的灭菌人工海水,温度控制在(22±1) ℃,pH为8.00±0.20。驯养期间,许氏平鲉喂食丰年虾,牙鲆喂食饲料,每天定时定量喂两次,用于进行急性毒性试验的褐牙鲆幼鱼的平均体长为2.40 cm,平均体重为0.20 g;许氏平鲉幼鱼平均体长为1.10 cm,平均体重为0.09 g。
1.2.3 急性毒性实验方法 急性毒性实验方法参照美国环境保护署(USEPA)、经济合作与发展组织(OECD)和我国国家标准如(ASTM《臂尾轮虫属急性毒性实验指南》、《GB/T 13267—91 水质 物质对淡水鱼(斑马鱼)急性毒性测定方法》、《GB/T 27861—2011 化学品 鱼类急性毒性试验》)等的标准试验方法进行。根据预实验确定暴露实验浓度梯度范围,每种生物设置不同浓度梯度镉暴露组(见表1)和无镉的人工海水空白对照组,每个浓度组设置3个平行样。采用半静态试验方法,实验期间不喂食,每4 h观察记录受试生物存活情况,根据每种生物死亡判别方法,确定死亡个体并及时取出。根据实验参照方法要求,受试生物日本虎斑猛水蚤、褶皱臂尾轮虫进行48 h的暴露实验,大扁藻进行96 h的抑制实验,其余物种均进行96 h的致死效应实验。急性毒性试验各项参数见表1。采用SPSS 19.0软件中probit概率-浓度回归法计算半致死浓度LC50。

表1 6种渤海本土海洋生物毒性实验浓度Table 1 The exposure concentration gradients for 6 native marine organisms in the Bohai Sea
1.3 海水基准推导方法
根据渤海海洋生物的种类及本研究毒性数据获取情况,参考刘征涛等[42]对于推导水质基准数据的要求,本研究采用美国环保署水质基准制定技术指南中推荐的物种敏感度排序法(SSR)推导渤海的“双值基准”,即基准最大浓度(Criteria Maximum Concentration, CMC)及基准连续浓度(Criteira Continuous Concentration, CCC)。CMC考虑的是污染物对水生动物的急性毒性效应,它等于最终急性值(Final Acute Value, FAV)的1/2;CCC考虑的是污染物对水生动物的慢性毒性效应,本研究采用最终急慢性比率(Final Acute Chronic Ratio, FACR)推慢性值。最终急慢性比率为所获物种急慢性比率的几何均值,计算急慢性比率的急性值和慢性值可以是不同的毒性终点,但必须是相同的物种,且是同一文章或至少是相同实验室报道[17]。CMC的计算依赖搜集的急性毒性数据,计算每个物种的SMAV和每个属的 GMAV;将 GMAV从小到大进行排序,并且将其分配等级R,最小GMAV的等级为 1,最大GMAV的等级为N(N为属的个数);按公式P=R/(N+1)计算每个属平均急性值的累积概率P;选择P最小的4个GMAV,用这4个GMAV和它们的P计算FAV。其中CMC由经验公示推导得出,公式[10]如下:

(1)
式中:S、L、A为计算中采用的无特殊含义符号;P为选择4个属毒性数据的排序百分数(也称累积概率)。
由于慢性毒性数据收集的较少,本研究参考以往的研究经验[10],采用急慢性毒性比的方式推导最终慢性值(Finad Chronic Value,FCV),推导公式[33]如下:
(2)
式中:FACR为急慢性比终值,本研究中该值是指鱼类、无脊椎动物和另一敏感海洋生物的急慢性毒性比值的几何均值[43]。
2 结果
2.1 急性毒性效应
6种生物中,镉的半致死浓度值(Lethal Concentration 50, LC50)、半数有效浓度值(Median Effective Concentration,EC50)介于4.46~50.0 mg/L之间。其中,青岛大扁藻的半致死浓度最低,代表该物种对镉暴露最敏感;天津厚蟹的半致死浓度最高,代表该物种对镉暴露最不敏感(见表2)。由表2可知,镉对6种渤海本土生物的毒性大小为:青岛大扁藻>褐牙鲆>许氏平鲉>日本虎斑猛水蚤>褶皱臂尾轮虫>天津厚蟹。

表2 镉对6种渤海本土海洋生物的急性毒性LC50实验结果Table 2 Acute toxicity LC50 test results of cadmium on 6 native marine organisms in Bohai Sea
2.2 毒性数据筛选
根据公开发表的资料,本研究共筛选出共计6门21科23属共24种渤海生物的镉急性毒性数据(见表3)。其中,对镉暴露最敏感的生物是对虾属,其属平均急性值为0.03 mg/L,最不敏感的是厚蟹属,其属平均急性值为50.0 mg/L。

表3 渤海海洋生物分布与镉的属平均急性毒性排序Table.3 Distribution of marine life and genus mean acute toxicity rank of cadmium in the Bohai Sea
将同一门类的生物急性毒性数据作箱体图(见图1),结果发现本研究中原腔动物种间对镉毒性耐受性差异较大,软体动物门对镉毒性较为敏感。根据USEPA“推导保护水生生物及其用途的国家水质基准的技术指南”要求,符合正态分布的毒性数据方可进行水质基准推导[10],将搜集筛选的急性毒性数据对数化后,经K-S检验,其分布符合均值为0.53,标准差为0.84,在0.05水平下,P值为0.84的显著正态分布(见图2)。

图1 金属镉生物毒性的敏感性比较Fig.1 Comparison of toxicity sensitivity of different taxonomic categories to Cd

图2 金属镉生物毒性的对数正态分布Fig.2 Log-normal distribution of cadmium toxicity with Logarithmic converter
2.3 镉基准值推导
对所有筛选出的生物毒性数据(见表3)进行敏感度排序,结果表明(见表4),GMAV值最小的4个属依次为1.对虾属、2.新糠虾属、3.舌鳎属和4.巨蛎属,FAV值为46.8 μg/L。根据式1计算得出镉在渤海海域的CMC值为23.4 μg/L。本研究选取栉孔扇贝、长牡蛎、半滑舌鳎等3种水生生物急慢性数据比的几何平均值为FACR值,即8.36。由此,根据式2推导得出镉在渤海海域的CCC值为5.60 μg/L。
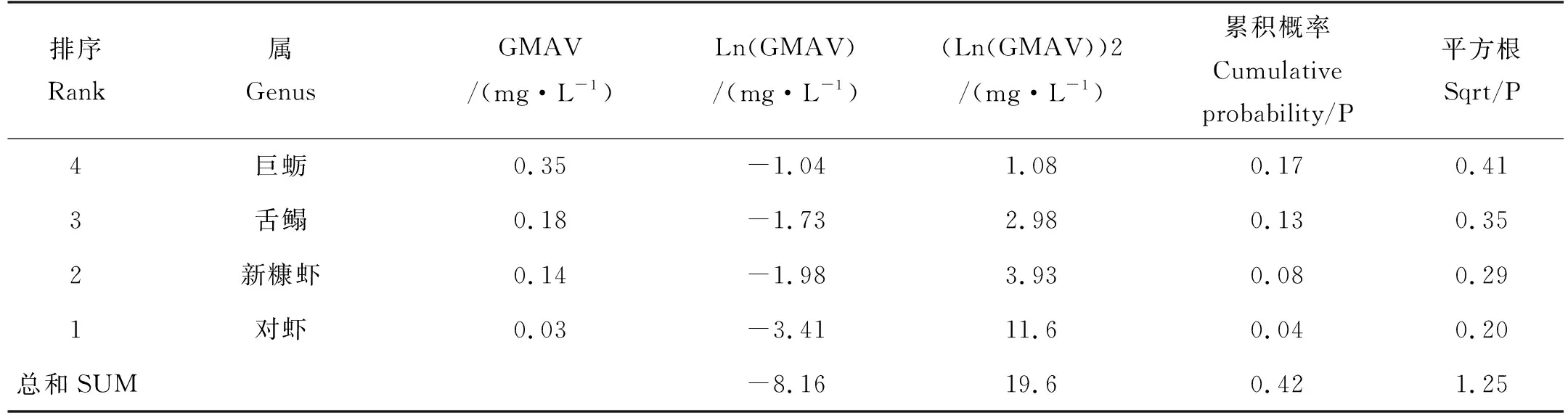
表4 镉的基准最大浓度计算结果Table 4 Criteria maximum concentration calculation results of cadmium
3 讨论
本研究发现镉对不同海洋生物的毒性存在明显差异,其中褶皱臂尾轮虫对镉的48 h-LC50是青岛大扁藻的10倍左右,是褐牙鲆、许氏平鮋的7倍左右,而日本虎斑猛水蚤的LC50是褐牙鲆、许氏平鮋的3倍左右,这与蔡卓平等[44]镉对海洋微藻类毒性较强的研究结果一致。秦华伟等[45]研究的褐牙鲆LC50为6.79 mg·L-1,与本文结果相近。在本研究中,镉对褐牙鲆和许氏平鮋的LC50差异不大,这是因为二者同属于脊索动物门鲽形目,且实验中采用的两种鱼类体型差异不大并均为幼鱼。根据最大容许质量浓度[45](Maximum permissible concentration, MPC)公式: MPC= LC50×0.01计算本实验条件下镉对6种海水养殖生物的安全浓度及表5可知,我国现行的渔业水质标准完全满足这6种生物的养殖用水要求。
镉污染在水体中不易降解,只能在环境中迁移或转化,并通过食物链在各营养级的生物体内不断蓄积放大,富集可达到数千乃至万倍以上,且极少量可被排出体外[46]。近年来,越来越多研究发现,金属镉对生物体的损伤不仅仅是产生活性氧,更可能在免疫系统和分子机理水平产生影响,且不同浓度的镉离子浓度对生物体的影响还不相同[47-48]。黑褐新糠虾在不同浓度的Cd2+溶液中,浓度越高,存活率越低,除此之外,生物在重金属溶液中暴露的时间也能对海洋生物存活率造成影响,死亡率随时间的延长而增加[49]。总体来说,生物对重金属的耐受范围因物种、年龄、暴露时间而不同。
随着毒性数据积累及定值方法的完善,水质基准值也会更加科学合理。研究证实,水质基准值会受采用的生物毒性数据及基准推导方法的影响[30]。如美国,相较于1980年发布镉的淡水水质基准,因生物物种毒性数据的增减,美国于2016年更新了镉的海水水质基准。本研究采用物种敏感度排序法推导的渤海水质基准与我国学者穆景利等[50]采用物种敏感度曲线法推导的我国海洋镉基准值有一定差异但在同一数量级内不大(见表5),一定程度上表明虽基于同一数理统计理论,但推导方法的不同可能并不会导致最终基准值有量级的差别,但为更加合理的保护海洋生态环境及海洋生物,避免因过度保护而造成的经济浪费,分区域的基准研究仍有必要,本研究所推导出的渤海水环境基准值不仅可以更加科学可靠地保护渤海生物,也可保护我国海域大部分的海洋生物。吴丰昌等[51-52]分别使用评价因子法、物种敏感度排序法、及物种敏感度分布法推导了国家层面的镉、锌等典型重金属的淡水基准值,根据我国学者先前的研究发现,与评价因子法和物种敏感度分布法相比,物种敏感度排序法推导出的重金属基准值更可靠[51-52],能保护水体中更多的水生生物。与美国2016年发布的海水镉基准值相比,本研究推荐的CMC、CCC值与其略有差异(见表5),这主要与基准计算时采用的毒性数据及物种不完全相同有关,而本研究所用的毒性数据主要为渤海海域的海洋生物毒性数据。目前,我国学者对珠江、长江、太湖和辽河等流域的镉的急慢性基准进行了推算,其中,镉急性基准值分别为3.60、3.61、3.19和2.95 μg/L,慢性基准分别为1.39、0.06、0.04和0.04 μg/L[53]。由此可见,这些流域的镉急性基准值均大于国家淡水急性基准值2.1 μg/L(水体硬度为50 mg/L时), 而大部分慢性基准则小于国家淡水慢性基准0.15 μg/L(水体硬度为50 mg/L时)。总的来看,我国其他海域镉的水质基准值尚未见报道。

表5 与其他研究区域海水镉基准值的比较Table 5 Comparison of the cadmium baseline in the seawater with other studies
本研究镉的CCC推荐值位于镉的II类与III类海水水质标准之间(见表5),且更接近II类水质标准。从长期保护渤海海洋生物的目标来看,当前镉的海水水质标准可能存在一定的“过保护”现象。然而,本研究镉的CCC略高于《渔业水质标准》(见表5),说明本研究的基准值可满足渤海大部分渔业资源保护的需求。
研究过程中我们也发现,方法及数据的选择是水质基准研究的核心,当前我国海洋生物毒性效应实验仍缺乏系统的适应我国本土情况的实验方法指导标准,导致搜集的很多毒理学数据无法被更好的利用于水质基准计算研究中。此外,水质基准具有科学性、基础性和区域性等特点[54],所以,水质基准的推导过程要综合考虑各相关环境要素的影响,如水体硬度、温度、pH、溶解氧、盐度及其他溶解性有机质等。但在现有可利用的毒理学数据中,实验设计无统一标准,环境要素标准化以降低其对水质基准的影响是一项复杂但又不可忽视的研究。因此,在海洋生态毒理学的逐步完善过程中,以后的海水基准研究需着重考虑环境因素对海水基准的影响。
4 结论
(1)镉对6种渤海本土生物的LC50/EC50值在4.46~50.0 mg/L之间,不同物种对于镉的敏感性差异较大,敏感性排序为:青岛大扁藻>褐牙鲆>许氏平鲉>日本虎斑猛水蚤>褶皱臂尾轮虫>天津厚蟹。
(2)渤海海域GMAV最小的4个属依次为对虾属、新糠虾属、舌鳎属和巨砺属,据此推导出镉基准最大浓度值为23.4 μg/L,连续浓度值为5.60 μg/L,可科学有效地保护渤海大部分海洋生物。

