不同剂量基因重组人生长激素治疗特发性矮小症效果及对糖脂代谢、甲状腺功能影响
喻 琴,刘 宇,熊家玲,张愉愉
特发性矮小症为病因不明矮小症总称,占矮小症儿童1/5[1]。基因重组人生长激素是临床治疗特发性矮小症主要药物,可在短期内提高生长速度,但治疗效果个体差异较大[2]。有研究指出,大剂量基因重组人生长激素治疗特发性矮小症效果更佳,但生长激素在发挥治疗作用同时,也可促进脂质氧化,增加游离脂肪酸水平,抑制糖代谢,导致血糖升高,并刺激胰岛素分泌从而产生胰岛素抵抗,影响机体糖脂代谢,这也是临床一直较为关注基因重组人生长激素对糖脂代谢影响的原因[3]。同时,也有研究报道在接受基因重组人生长激素治疗的患儿中有30%可发生甲状腺功能异常,主要表现为亚临床甲状腺功能减退[4]。因此,在探讨基因重组人生长激素治疗特发性矮小症效果基础上,分析其对特发性矮小症患儿糖脂代谢及甲状腺功能影响十分必要。本研究探讨不同剂量基因重组人生长激素治疗特发性矮小症患儿临床效果,并着重分析不同剂量基因重组人生长激素对特发性矮小症患儿糖脂代谢及甲状腺功能影响,以期为特发性矮小症患儿临床治疗及治疗剂量选择提供依据。
1 资料与方法
1.1一般资料 选取2017年7月—2018年7月在自贡市妇幼保健院就诊的符合纳入及排除标准的特发性矮小症 86例,根据基因重组人生长激素使用剂量不同将其分为A组和B组,每组43例。A组男26例,女17例;年龄3~11(7.23±2.13)岁;体质量14~39(27.26±9.82)kg,体质量指数(BMI)14.0~23.8(18.27±3.01)kg/m2;心率70~115(95.87±10.52)/min;收缩压86~102(95.89±2.24)mmHg,舒张压65~75(70.07±2.40)mmHg。B组男22例,女21例;年龄4~11(7.19±2.20)岁;体质量14~38(26.39±8.74)kg,体质量指数14.7~23.5(18.54±3.09)kg/m2;心率70~114(94.07±9.44)/min;收缩压85~102(96.37±2.43)mmHg,舒张压60~72(66.27±3.89)mmHg。两组性别和年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究符合“赫尔辛基宣言”,经医院医学伦理委员会批准同意执行。
1.2纳入及排除标准 纳入标准:①符合特发性矮小症诊断标准[5];②年龄≤12周岁;③生长速度每年<4 cm,骨龄低于实际年龄2年以上;④智力发育正常;⑤患儿家长均签署相关知情同意书。排除标准:①合并甲状腺功能疾病患儿,如甲状腺功能亢进症和甲状腺功能减退症等;②过敏体质或对本研究使用药物过敏患儿;③合并急慢性肾功能不全患儿;④有遗传和生长激素缺乏症等明确病因身材矮小患儿。
1.3治疗方法 两组均接受常规基础治疗,包括制定科学饮食方案,并依据患儿个体情况适当接受钙、维生素及微量元素等营养治疗;同时对患儿及其家长开展疾病知识宣教,确保患儿睡眠及运动时间充足,运动方式以跳绳和游泳等为主。
A组每日睡前皮下注射基因重组人生长激素(丹麦诺和诺德公司/Novo Nordisk A/S,国药准字J20170044),注射剂量为每日0.15 U/kg,注射部位为大腿外侧、脐周、上臂外侧。B组亦每日睡前皮下注射基因重组人生长激素(丹麦诺和诺德公司/Novo Nordisk A/S,国药准字J20170044),注射剂量为每日0.20 U/kg,注射部位同A组。两组疗程均为1年。
1.4观察指标 ①临床效果:治疗前和治疗后1年测量比较两组身高、生长速度、骨龄,并参照文献[6]预测成年身高。②糖代谢指标:治疗前及治疗后1年采集两组晨间空腹静脉血2 ml,采用全自动生化分析仪检测空腹血糖、空腹胰岛素,并计算胰岛素敏感指数[7]。③脂代谢指标:治疗前和治疗后1年采集两组晨间空腹静脉血2 ml,采用全自动生化分析仪检测总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)水平。④甲状腺功能指标:治疗前和治疗后1年采集两组晨间空腹静脉血2 ml,应用电化学发光免疫分析法检测血清游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)和促甲状腺激素(TSH)水平。⑤不良反应发生情况:两组分别于治疗后3、6个月和1年定期门诊复查,出现不适症状可通过电话和网络通信等手段及时告知临床医师或门诊就医,统计治疗期间不良反应发生情况。不良反应包括空腹血糖>6.5 mmol/L、注射部位红肿、生长痛、头痛。夜间出现不明原因双下肢或膝关节周围疼痛,多为肌肉疼痛且次日可自行消失,疼痛部位较固定,无游走性,局部未见红肿及有明显压痛,经实验室及X线检查排除其他疾病,即可诊断为生长痛[8]。
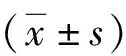
2 结果
2.1临床效果比较 治疗前,两组组间身高、生长速度、骨龄和预测成年身高比较差异无统计学意义(P>0.05)。治疗后1年,两组身高、生长速度、骨龄和预测成年身高较治疗前增加或增快,且A组身高、生长速度、骨龄和预测成年身高低于或慢于B组,差异有统计学意义(P<0.05),见表1。

表1 采用不同剂量基因重组人生长激素治疗的特发性矮小症患儿两组治疗后1年临床效果比较
2.2糖代谢指标比较 治疗前,两组组间空腹血糖、空腹胰岛素和胰岛素敏感指数比较差异无统计学意义(P>0.05)。治疗后1年,两组空腹胰岛素较治疗前下降,差异有统计学意义(P<0.05);两组空腹血糖和胰岛素敏感指数与治疗前比较差异无统计学意义(P>0.05);两组组间空腹血糖、空腹胰岛素和胰岛素敏感指数比较差异无统计学意义(P>0.05)。见表2。

表2 采用不同剂量基因重组人生长激素治疗的特发性矮小症患儿两组治疗前后糖代谢指标比较
2.3脂代谢指标比较 治疗前,两组组间TC、TG、LDL-C和HDL-C比较差异无统计学意义(P>0.05)。治疗后1年,两组TG和LDL-C较治疗前下降,差异有统计学意义(P<0.05);两组TC和HDL-C与治疗前比较差异无统计学意义(P>0.05);两组组间TC、TG、LDL-C和HDL-C比较差异无统计学意义(P>0.05)。见表3。
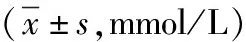
表3 采用不同剂量基因重组人生长激素治疗的特发性矮小症患儿两组治疗前后脂代谢指标比较
2.4甲状腺功能指标比较 治疗前,两组组间FT3、FT4和TSH比较差异无统计学意义(P>0.05)。治疗后1年,FT3、FT4和TSH两组与治疗前比较差异无统计学意义(P>0.05);两组组间比较差异亦无统计学意义(P>0.05)。见表4。

表4 采用不同剂量基因重组人生长激素治疗的特发性矮小症患儿两组治疗前后甲状腺功能指标比较
2.5不良反应发生情况比较 治疗期间,两组空腹血糖>6.5 mmol/L、注射部位红肿、生长痛和头痛发生率比较差异无统计学意义(P>0.05),见表5。两组出现空腹血糖>6.5 mmol/L患儿均暂停注射基因重组人生长激素至血糖恢复正常,后再次接受基因重组人生长激素注射,未见血糖上升,血糖恢复时间为2~4 d;出现注射部位红肿及头痛患儿均为一过性,未予特殊处理;出现生长痛患儿主要表现为膝盖疼痛及抽筋,补充钙剂后症状消失,未对治疗产生影响。

表5 采用不同剂量基因重组人生长激素治疗的特发性矮小症患儿两组治疗期间不良反应发生情况比较[例(%)]
3 讨论
特发性矮小症多见于身高低于第3百分位患儿,若未有效干预,多数特发性矮小症患儿终身高将低于遗传靶身高[9-10]。目前,特发性矮小症病因虽尚未完善阐明,但以往研究认为其发生与生长激素缺乏及对生长激素敏感度不佳有关[11]。生长激素由垂体产生,可促进蛋白质分泌,也是骨骼及肌肉生长重要激素[12]。因此,现临床上对特发性矮小症患儿仍以基因重组人生长激素干预为主,以期改善患儿预测成年身高[13-14]。大量研究证实经基因重组人生长激素治疗后特发性矮小症患儿可获得相对较高成年身高,但受个体年龄和骨龄等多因素影响,治疗效果个体差异较大[15]。基因重组人生长激素在发挥促生长作用同时,主要通过刺激肝脏细胞合成胰岛素生长因子来发挥生物学效应,而胰岛素生长因子又具有一定抗凋亡作用,故基因重组人生长激素的使用剂量及安全性一直是临床关注的焦点[16]。当前临床关于基因重组人生长激素治疗特发性矮小症研究较多,但多数样本量较小,给药剂量也不尽相同[17],结合基因重组人生长激素治疗特发性矮小症安全性考虑,基因重组人生长激素在特发性矮小症中的临床应用价值仍有极大深入探究空间。
本研究结果显示,治疗后1年,两组身高、生长速度、骨龄和预测成年身高较治疗前增加或增快,且A组身高、生长速度、骨龄和预测成年身高低于或慢于B组,差异有统计学意义。提示无论是每日0.15 U/kg还是每日0.20 U/kg剂量的基因重组人生长激素治疗特发性矮小症均可发挥确切治疗效果,增长患儿预测成年身高,但采用每日0.20 U/kg的基因重组人生长激素治疗获益更佳,这与朱一杰[18]的研究报道结果相符。究其原因为基因重组人生长激素可刺激肝脏细胞合成胰岛素生长因子-1,从而促进软骨细胞增长及骨生长,相较每日0.15 U/kg剂量,每日0.20 U/kg剂量可发挥更显著作用,从而进一步优化治疗效果。本研究结果显示,治疗后1年,两组空腹胰岛素较治疗前下降,差异有统计学意义;两组空腹血糖和胰岛素敏感指数与治疗前比较差异无统计学意义。分析原因可能与长期使用基因重组人生长激素可产生信号传导抑制蛋白,降低胰岛素敏感性有关[19]。本研究结果显示,治疗后1年,两组TG和LDL-C较治疗前下降,差异有统计学意义;两组TC和HDL-C与治疗前比较差异无统计学意义。分析原因可能与基因重组人生长激素可通过介导生长激素介质产生间接调节血脂水平有关[20]。本研究结果还显示,治疗后1年,两组组间糖代谢和脂代谢指标比较差异均无统计学意义。说明无论是每日0.15 U/kg还是每日0.20 U/kg剂量的基因重组人生长激素对特发性矮小症患儿糖代谢和脂代谢的影响都是有限的,且二者对特发性矮小症患儿糖代谢和脂代谢的影响无明显差异。
垂体甲状腺轴功能异常是基因重组人生长激素治疗特发性矮小症患儿最常见的不良反应之一。有文献报道,在接受基因重组人生长激素治疗的患儿中30%可出现亚临床甲状腺功能减退,主要表现为甲状腺素下降,但TSH不变[21]。本研究结果显示,治疗后1年,FT3、FT4和TSH两组与治疗前比较差异无统计学意义,两组组间比较差异亦无统计学意义。提示每日0.15 U/kg和每日0.20 U/kg剂量的基因重组人生长激素治疗特发性矮小症患儿对甲状腺功能产生的影响并不显著。此外,本研究结果还显示,治疗期间,两组空腹血糖>6.5 mmol/L、注射部位红肿、生长痛和头痛发生率比较差异均无统计学意义,且两组所出现的不良反应均程度较轻,皆可控,这与凌岚等[22]的报道结论相似。提示基因重组人生长激素治疗特发性矮小症患儿安全性良好,且剂量增加并未显著增加不良反应发生风险,这也在一定程度上反映了特发性矮小症患儿对基因重组人生长激素治疗的耐受性良好。
总之,基因重组人生长激素治疗特发性矮小症每日0.20 U/kg较每日0.15 U/kg剂量获益更佳,且两种剂量对特发性矮小症患儿糖脂代谢及甲状腺功能影响相当,较大剂量也并未造成显著不良反应。然而,本研究也存在一定局限性,研究对象为年龄≤12岁儿童,在基础治疗依从性上可能存在一定差异,从而影响研究结果。今后可采集大样本并严格控制混杂因素影响后持续补充及完善本研究结果。

