CT 引导下经皮无水乙醇注射联合射频消融治疗高危部位原发性肝癌*
李文东 郭晓笛 陈京龙 丁晓燕 孙 巍 孙莎莎 申燕军 李 莉
(首都医科大学附属北京地坛医院肿瘤内科,北京 100015)
原发性肝癌是目前我国第4 位常见恶性肿瘤及第2 位肿瘤致死病因[1]。我国原发性肝癌的病理类型主要是肝细胞肝癌。外科手术是早期肝细胞肝癌的首选治疗手段。射频消融(radiofrequency ablation,RFA)由于微创、消融范围可预测、治疗有效、安全的优点,已成为根治极早期和早期肝细胞肝癌的一线治疗手段[2,3]。肝癌病灶位于某些特殊部位,如肝脏包膜下或邻近大血管、胆囊、胃、肠管、膈肌、心脏、肾脏等,临床上认为是高危部位[4],单纯行射频消融操作风险大,容易损伤邻近脏器,手术相关严重并发症发生率高,而且完全消融率低,局部复发率和死亡率增加,曾被列为射频消融治疗禁忌[5~7]。高危部位原发性肝癌并不少见,可高达23.4%~34.7%[7]。因此,如何安全地提高高危部位原发性肝癌的完全消融率值得探讨。目前,已有很多手段应用到高危部位原发性肝癌的射频消融中,联合经皮无水乙醇注射(percutaneous ethanol injection,PEI)是常用手段之一[7]。
我科前期开展了CT 引导下经皮无水乙醇注射联合射频消融治疗高危部位原发性肝癌的研究[6],结果显示可明显提高肝癌病灶完全消融率,且安全性较好。但以往研究无水乙醇局部注射联合或不联合射频消融都针对整个高危部位病灶。事实上,即使高危部位病灶也不是所有部分都是射频消融高危风险的。因此,我们将高危部位病灶分为两部分:①高危部分,射频消融不安全或不能安全覆盖的部分;②非高危部分,射频消融安全且能完全覆盖的部分。2017 年1 月~2018 年12 月,我科收治58 例不适合或不愿外科手术的高危部位原发性肝癌,其中28 例(44 个高危病灶)经皮将无水乙醇直接注射到高危部分进行化学消融,然后对非高危部分进行射频消融,30 例(46 个高危病灶)单纯行射频消融。本研究对此进行回顾性比较,观察能否在保证安全的前提下提高高危部位原发性肝癌的完全消融率。
1 临床资料与方法
1.1 一般资料
病例选择标准:年龄18~70 岁,根据2011 年原发性肝癌诊治规范或病理明确诊断为原发性肝癌[8];根据文献[4]定义原发性肝癌高危病灶,包括病灶边缘距离肝被膜,门静脉左右支,肝静脉主干,肝段下腔静脉,周围重要脏器(包括心脏、肺、胆囊、肾脏、胃肠道等)10 mm 以内;高危病灶最大径≤5 cm,数目≤3 个;不愿或无法耐受肝癌根治性手术;肝功能Child-pugh A 级或B 级。
排除标准:有活动性出血倾向;活动性感染;正在或既往1 个月内索拉非尼等全身治疗;碘造影剂或乙醇过敏;门静脉主干癌栓或肝外转移病灶。
本组58 例,男40 例,女18 例。年龄32~70岁,平均56 岁。腹部增强CT 或MRI 共检出90 个高危病灶,1 个病灶27 例,2 个病灶30 例,3 个病灶1 例;直径1.0~4.8 cm,平均2.8 cm;高危病灶位置:近肝被膜29 个,近门脉分支22 个,近下腔静脉5 个,近胆囊5 个,近心脏6 个,近肺15 个,近胃肠道8 个。乙肝感染者48 例,丙肝感染者7 例,非乙肝非丙肝感染者3 例。
对所有患者告知高危病灶行射频消融联合或不联合无水乙醇局部注射治疗的优缺点及并发症,根据患者和家属意愿选择,行PEI+RFA 组28 例(44个高危病灶),RFA 组30 例(46 个高危病灶)。2 组一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。

表1 2 组一般资料比较
1.2 方法
均先行碘油为基础的肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE) (2组各5 例拒绝),化疗方案:吡柔比星15 mg/m2,羟喜树碱10 mg/m2。TACE 术后第3~7 天行CT 引导下肝癌RFA 或PEI 联合RFA。术者为作者中具有10 年和8 年操作经验的2 名副主任医师。①PEI联合RFA(图1):根据CT 图像实时设定适合的穿刺路径和角度(避开肋骨、肺等,安全且距离较短),使用日本八光21G 穿刺针引导,将无水乙醇混合碘海醇(碘海醇和无水乙醇体积比为1∶19,其中碘海醇作为示踪剂)注射于病灶的高危部分。根据肿瘤高危部分的大小,每个病灶2~8 ml,CT扫描通过示踪剂碘海醇显示无水乙醇覆盖高危部分情况,必要时多点注射或补充注射,确保对病灶高危部分完全覆盖。之后对肝癌的非高危部分进行RFA。②RFA 组:在保证10 mm 以上安全边界距离的情况下行RFA。RFA 操作参考我科已发表文献[6]。
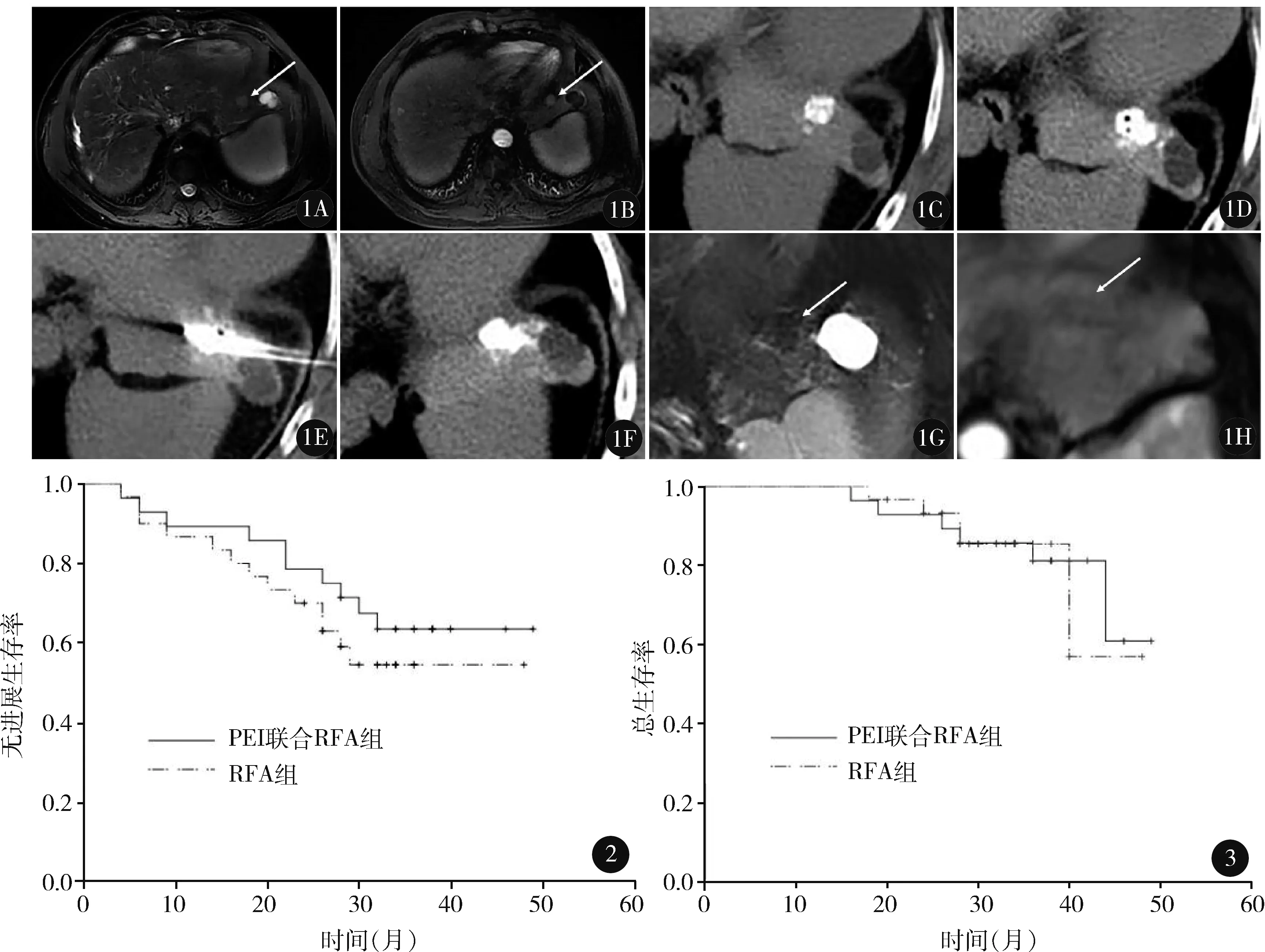
图1 58 岁男性原发性肝癌患者经皮无水乙醇注射联合射频消融治疗前后的影像学资料:A、B.术前MRI显示肝左叶肿瘤长径1.5 cm,毗邻心脏(肿瘤边缘距离心包最近处2 mm)(A 为T2 序列,肿瘤呈高信号,B 为增强MRI 动脉期,白色箭头示病灶);C.TACE 后碘油沉积于肿瘤部位,但不够密实;D.CT 引导下引导针进入并已注射碘海醇与无水乙醇混合液于病灶高危部分;E.射频消融针进入并消融覆盖非高危部分;F.治疗结束;G、H.PEI 联合RFA 治疗后1 个月复查MRI,原病灶及周围2 cm 以内未见高信号和强化,提示肿瘤完全消融(G 为T2 序列,H 为增强MRI 动脉期;白色箭头示病灶位置)图2 经皮无水乙醇注射(PEI)联合射频消融(RFA)组和RFA 组无进展生存曲线图3 经皮无水乙醇注射(PEI)联合射频消融(RFA)组和RFA 组总生存曲线
术后常规检测血常规、肝肾功能和甲胎蛋白(AFP)等。术后3 个月内每月影像学评估(腹部增强CT 或MRI),3 个月后每3 个月评估,同时抽血复查以及观察不良事件。每1~3 个月随访患者生存情况。肿瘤消融不完全或局部肿瘤进展的病灶,可再次进行相同治疗或转外科手术。
1.3 观察指标
主要指标为术后1 个月肿瘤完全消融率,次要指标为2 年肿瘤局部进展率、总生存时间和不良反应。
按照《肝癌射频消融治疗规范的专家共识》判断有效性[9]。完全消融:术后1 个月复查三期增强CT 或MRI,病灶未见强化。肿瘤局部进展:肿瘤完全消融后,在消融灶的边缘出现新的病灶,新病灶与消融灶相连。
参考美国国家癌症研究所不良事件通用术语标准(National Cancer Institute Common Terminology Criteria for Adverse Events,CTCAE)v4.03 和《肝癌射频消融治疗规范的专家共识》[9]评价治疗的不良反应和并发症。
1.4 统计学处理
采用SPSS22.0 统计学软件进行统计分析。2组计数资料比较采用χ2检验;计量资料用Kolmogorov-Smirnov 进行正态性检验,正态分布资料用x±s表示,2 组比较采用独立样本t检验,不符合正态分布的用中位数(最小值~最大值)表示,2 组比较采用Mann-WhitneyU检验。采用Kaplan-Meier法绘制生存曲线,生存分析采用log-rank 法。P<0.05 为差异有统计学意义。
2 结果
有效性:术后1 个月增强CT(5 例)或增强MRI(53 例)显示,PEI 联合RFA 组肿瘤完全消融率[93.2%(41/44)]明显高于RFA 组[73.9%(34/46),χ2=6.012,P=0.014)。58 例随访16~49 个月,中位随访35 个月,无失访。PEI 联合RFA 组2 年局部肿瘤进展率为18.2% (8/44),RFA 组为32.6%(15/46),差异无统计学意义(χ2=2.460,P=0.117)。2组无进展生存率(图2,log-rankχ2=0.682,P=0.409)和总生存率(图3,log-rankχ2=0.010,P=0.922)差异无统计学意义。
安全性:见表2。RFA 组1 例肝脓肿(经引流及抗感染治疗治愈),1 例膈动脉出血(术后右侧胸腔出血,血红蛋白进行性下降,最低64.2 g/L,2 次介入手术怀疑膈动脉出血,但止血效果不佳,最终胸外科胸腔镜下膈动脉缝扎止血),PEI 联合RFA 组未出现手术相关严重并发症,2 组手术相关严重并发症差异无统计学意义(P>0.05)。治疗期间,2 组出现3 级丙氨酸氨基转移酶(ALT)升高12 例、3 级天门冬氨酸氨基转移酶(AST)升高9 例和3 级腹痛4例,其余不良反应均为1~2 级,均为一过性,经过药物对症治疗,均在1~2 周内缓解。2 组不良反应发生率差异均无统计学意义(P>0.05)。
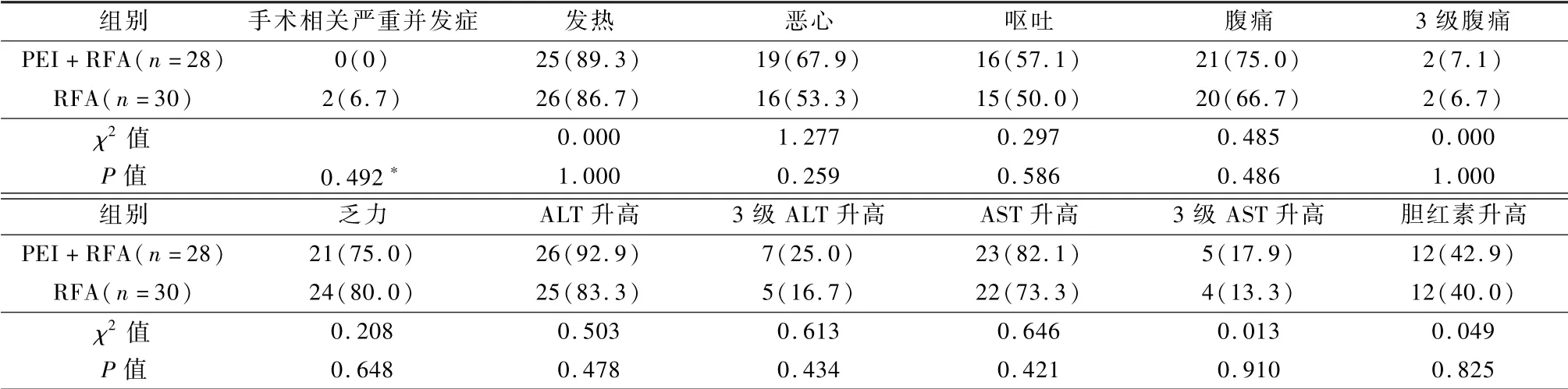
表2 2 组不良反应比较[n(%)]
3 讨论
目前,射频消融联合或不联合肝动脉化疗栓塞已经成为Ⅰa、Ⅰb 和Ⅱa 期原发性肝细胞癌的根治性治疗手段[10]。肝癌射频消融要达到病灶完全消融一般需要5~10 mm 的安全边界,而高危部位原发性肝癌要达到完全消融几乎不可避免地会造成邻近脏器损伤,包括穿刺损伤和热损伤,出现腹腔内出血、胃肠道穿孔、肝脓肿、心脏压塞、膈肌穿孔等严重并发症,甚至危及生命[4,11~13];邻近血管的肝癌病灶射频消融除消融针可能穿刺损伤血管或胆管外,还存在血流带走热量的“热沉降”效应,可能因温度不够高而导致局部消融不彻底。对高危部位肝癌病灶行射频消融操作风险大,周围脏器损伤造成严重并发症风险高,完全消融率低[5~7]。因此,有必要探讨如何安全、有效地提高高危部位原发性肝癌的完全消融率。已有一些方法联合射频消融应用于高危部位原发性肝癌提高病灶完全消融率的报道,包括肝动脉化疗栓塞,无水乙醇注射,人造腹水或胸水,低功率射频消融,球囊导管干预,融合影像引导技术,腹腔镜或开腹射频消融等[7,14~20],取得不错的效果。
以前我科进行了CT 引导下经皮无水乙醇注射联合射频消融治疗高危部位原发性肝癌的研究[6],结果显示联合治疗组26例肝癌病灶完全消融率为92.5%(37/40),明显高于28 例TACE 序贯RFA 组的70.6% (24/34),没有增加并发症发生率。但以往研究中无水乙醇局部注射不只针对病灶的高危部分,而是整个高危病灶。高危部位原发性肝癌并不是所有部分都是射频消融高危风险的,我们将高危部位原发性肝癌分为高危部分(射频消融不能覆盖或不安全的部分)和非高危部分(射频消融安全且能完全覆盖的部分),无水乙醇经皮直接注射于病灶高危部分进行化学消融,然后射频消融治疗非高危部分。碘海醇作为示踪剂可以在CT 图像下即时显示无水乙醇是否充分覆盖高危部分,如未完全覆盖高危部分,可即刻补充注射。本研究结果显示,PEI 联合RFA 组肿瘤完全消融率明显高于RFA 组。PEI 联合RFA 组2 年局部肿瘤进展率低于RFA 组,但差异无统计学意义,考虑与样本量少有关。2 组无进展生存和总生存率无统计学差异。本研究结果与我科之前的研究[6]结果基本一致。本研究提示PEI 联合RFA 的疗效可能略优于单纯RFA,由于无水乙醇只需注射于病灶高危部分,因而能够减少无水乙醇用量。
安全性方面,RFA 组手术相关严重并发症的发生率高于PEI 联合RFA 组,但差异无统计学意义,可能与样本量少有关。本研究中PEI 联合RFA 组与RFA 组不良反应发生率差异无统计学意义,与我科之前研究[6]一致。RFA 组1 例肝脓肿,该患者存在糖尿病基础,病灶邻近门脉右支分叉处,考虑RFA 后肿瘤坏死液化继发感染,伴行胆管热损伤管壁通透性增加,或病灶内胆管坏死肠道细菌逆行上移所致;RFA 组1 例严重的膈动脉出血,分析原因为治疗的S4 病灶紧邻膈肌,引导针或射频消融针穿刺经膈肌时损伤膈动脉,或者射频消融热损伤邻近膈肌和膈动脉导致出血。PEI 联合RFA 组未出现心脏压塞、胃肠穿孔、膈肌穿孔、被膜下大出血等严重并发症,分析原因射频消融只针对病灶的非高危部分,而高危部分则由无水乙醇局部注射覆盖,因而射频消融针可与邻近脏器及管道(血管或胆管)等保持安全距离,避免射频消融针穿刺损伤和热消融直接损伤。对于邻近膈肌或腹腔脏器的病灶,我们并未采用文献报道的人工腹水或胸水进行隔离的方案[16~18],但也取得了类似的治疗效果。
综上所述,与单纯射频消融相比,无水乙醇注射化学消融高危部位原发性肝癌的高危部分,联合射频消融治疗非高危部分,能明显提高肿瘤的完全消融率,是安全可行的治疗手段,但尚需进一步开展大样本的随机对照研究进行验证。
致谢:感谢放射科谢汝明主任和周安医生对本研究全部病例进行肿瘤影像学疗效评估。

