养血解毒汤对小鼠银屑病样皮损IL-36表达的影响
张琪,朱磊,黄钰淇,陈永锋
1.南方医科大学皮肤病医院,广东 广州 510091;2.广东医科大学,广东 湛江 524023
银屑病是一种慢性、复发性、炎症性、红斑鳞屑性皮肤病,其发病率在全球范围约为2%,在高加索人和斯堪的纳维亚人中发病率更高,达11%左右[1],发病机制主要包含环境因素、感染因素、自身免疫因素以及遗传易感因素等。在对银屑病发病机制的探究中,目前发现IL-23/IL-17炎症轴起着重要作用,有研究发现TNF、IL-17、IL-22等可进一步诱导IL-36产生[2-3],诸多研究发现IL-36与银屑病发病关系密切。银屑病目前常用药物主要有阿维A、甲氨蝶呤、环孢素、外用维生素D3衍生物、糖皮质激素及生物制剂等[4],通过不同组合,银屑病的治疗方案多种多样,但是大多情况下银屑病患者经过系统治疗后,相关症状也只是部分缓解,甚至部分患者治疗疗效欠佳,长期外用糖皮质激素带来的副作用也显而易见。最近几年,中医药在银屑病治疗方面突显出了一些独特优势,在临床中应用范围也较广,对患者症状改善及疾病预后具有推动作用[5]。养血解毒汤为北京中医药大学赵炳南老中医的经验方[6],在血燥型银屑病中应用广泛,目前对于银屑病的中药治疗,大多是由该经验方加减而成,对于银屑病的有效率较高[7],然而其具体作用机制仍不明了。本课题旨在初步探究养血解毒汤对于小鼠银屑病样皮损的影响及其作用机制,为养血解毒汤治疗银屑病提供理论基础。
1 材料与方法
1.1 实验动物来源
本实验所用C57小鼠均购于广东省医学实验动物中心。
1.2 主要试剂与仪器
养血解毒汤(南方医科大学皮肤病医院)、5%咪喹莫特乳膏(美国3M)、医用凡士林(天津致远)、IL-36β/IL-1F8单克隆抗体(美国RD)、上下游引物(上海生工)、DEPC水(上海生工)、ECL发光液(上海生工)、Trizol® reagent(日本TaKa-Ra)、PrimeScript RT reagent kit with gDNA Erase(日本TaKaRa)、SYBR® Premix EX Taq TMⅡ(日本TaKaRa)。Leica2135石蜡病理切片机(德国Leica公司)、NanoDrop核酸浓度测量仪(美国赛默飞)、荧光定量PCR仪(美国Bio-rad)。
1.3 方法
1.3.1 建立模型将18只SPF级雌性、6~8周龄的C57小鼠随机分为对照组(凡士林+生理盐水)、模型组(5%咪喹莫特+生理盐水)、实验组(5%咪喹莫特+养血解毒汤),每组6只,于小鼠背部剃去约2 cm×3 cm区域的毛发。每天早上在小鼠剃毛区涂抹62.5 mg 5%咪喹莫特或凡士林,下午在小鼠剃毛区涂抹1 mL养血解毒汤或生理盐水。每天观察和记录小鼠皮损变化,在用药第8天进行最终评分,用脊椎脱臼法处死小鼠,取背部约1 cm×1 cm大小的皮损并用10%福尔马林固定,剩余皮损放-80℃冰箱保存。
1.3.2 评价小鼠银屑病皮损根据小鼠剃毛区红斑、鳞屑及斑块肥厚程度对皮损进行评分,评分标准[8]如下:①红斑:无明显红斑为0分;淡红色为1分;红色为2分;深红色为3分;极深红色为4分。②鳞屑:无明显可见鳞屑为0分;细微鳞屑为1分;片状鳞屑为2分;堆积成层的鳞屑为3分;堆积成层且十分厚密的鳞屑为4分。③斑块:肥厚程度平齐于正常皮肤为0分;轻微高出于正常皮肤表面为1分;中度隆起为2分;隆起明显、肥厚为3分;隆起极为明显为4分。三个指标评分之和为皮损严重程度评分。
1.3.3 HE染色与免疫组化染色对小鼠皮损进行固定、洗涤与脱水、包埋、切片、脱蜡、HE染色、免疫组化染色、封片,显微镜下观察各组小鼠背部皮损组织学形态及IL-36β水平,拍照保存。
1.3.4 RT-qPCR检测皮损中IL-36α、IL-36β、IL-36γ及IL-36Ra mRNA水平取50 mg小鼠皮损进行研磨,利用TRIZOL法提取总mRNA,通过反转录得到cDNA。根据说明书步骤,分别加入所需试剂及上下游引物(表1)进行qPCR,总反应体系为20μL,反应条件为预变性95℃30 s;95℃5 s,60℃30 s,40个循环。

表1 各组引物序列Table 1 Primer sequence
1.3.5 Western blot检测IL-36的蛋白表达研磨小鼠皮损,提取蛋白,配平及煮沸变性后,加入12%分离胶/5%浓缩胶中,电泳使蛋白分离(工作条件:60 V 30 min,120 V 60 min),转膜(工作条件:100 V 80 min),随后进行封闭,孵育一抗(按1∶1 000浓度稀释,4℃过夜),隔天洗膜后室温孵育二抗,洗涤后在发光成像仪中使用ECL液进行显影并拍照。
1.3.6 统计学处理使用GraphPad Prism5.0软件分析数据与作图,两组间PASI评分及IL-36β mRNA表达水平等比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 养血解毒汤对小鼠银屑病皮损的影响
对照组小鼠背部皮损无明显改变。模型组小鼠背部皮损自涂药第2天起开始出现红斑,并逐渐出现鳞屑、肥厚,在用药7 d后皮损最明显。实验组小鼠背部皮损自涂药第2天起出现红斑,并逐渐出现鳞屑、肥厚,在第4天皮损最明显,随时间推移,小鼠背部皮损逐渐减轻,用药7 d后实验组小鼠背部皮损明显轻于模型组(图1)。对小鼠皮损严重程度进行评分(图2),模型组与实验组小鼠用药7 d后的PASI评分分别为7.83±0.69、1.17±0.37,两者差异具有统计学意义(t=19.07,P<0.05)。

图1 用药7 d后小鼠背部皮损外观 Figure 1 The appearance of skin lesions after 7 days of treatment.

图2 小鼠PASI评分变化Figure 2 PASI score.
2.2 小鼠皮损的病理变化
对用药7 d后各组小鼠背部皮损进行HE染色,结果显示,对照组小鼠皮肤组织病理无明显改变;模型组小鼠出现银屑病样病理改变,如角质层增厚、角化不全、可见Munro微脓肿、棘层增厚、颗粒层减少或消失等;实验组小鼠皮损无明显银屑病样改变,仅出现表皮增厚,且厚度明显薄于模型组(图3)。

图3 用药7 d后小鼠背部皮损病理(HE,200×)Figure 3 HE staining of skin lesions after 7 days of treatment(200×).
2.3 小鼠皮损中IL-36家族mRNA水平检测
比较模型组与对照组IL-36α、IL-36β、IL-36γ及IL-36Ra mRNA水平,结果显示模型组中IL-36β、36γ的表达明显高于对照组(IL-36β:4.85±0.42 vs 1.00±0.13,t=14.74,P<0.01;IL-36γ:3.89±0.71 vs 1.00±0.06,t=11.64,P<0.01),而IL-36α、IL-36Ra无明显变化。比较实验组与模型组,结果显示实验组小鼠IL-36β表达下降(1.85±0.28 vs 4.85±0.42,t=8.01,P<0.01),而IL-36α、IL-36γ及IL-36Ra的mRNA水平无明显改变(图4)。
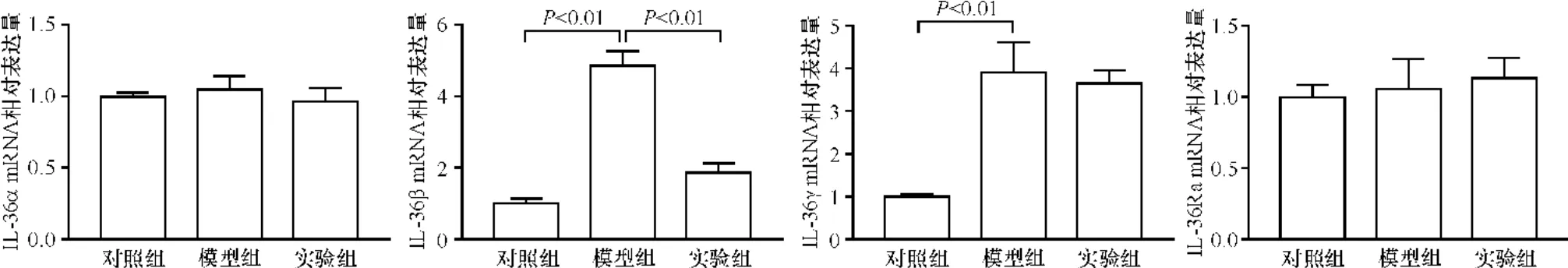
图4 小鼠背部皮损中IL-36α、IL-36β、IL-36γ、IL-36Ra的mRNA相对表达水平Figure 4 Relative expression levels of IL-36α,IL-36β,IL-36γand IL-36Ra mRNA.
2.4 小鼠皮损IL-36β免疫组化检测
IL-36β在对照组中仅少量表达于真皮层;在模型组中大量表达于颗粒层以及棘层中上部的细胞胞核和胞浆,且真皮层也有少量分布;在实验组中少量表达于真皮层,并少量或无表达于表皮层(图5)。

图5 用药7 d后小鼠背部皮损IL-36β免疫组化(200×)Figure 5 Immunohistochemical staining of IL-36βin skin lesions after 7 days of treatment(200×).
2.5 小鼠皮损中IL-36β蛋白水平的改变
结果显示(图6),模型组IL-36β的表达(3.27±0.32)明显高于实验组(2.50±0.24),差异具有统计学意义(t=3.31,P<0.05)。

图6 各组小鼠背部皮损中IL-36β的蛋白表达Figure 6 Expression of IL-36βprotein in skin lesions.
3 讨论
随着研究的深入,学者们对银屑病的发病机制有了更加深入的认识,大量实验结果表明除了遗传因素外,其发病主要有自身免疫及自身炎症因素介导[9]。在某些物理、化学因素或药物刺激等情况下,机体释放大量炎症介质,适应性免疫细胞(T细胞)、天然免疫细胞(中性粒细胞、巨噬细胞、树突状细胞)和角质形成细胞之间的反馈回路被激活,导致炎症反应被进一步放大[10],多种炎症细胞在表皮及真皮聚集,从而产生银屑病病理表现。
到目前为止,针对各种炎症通路的生物制剂已大量面世,明显提高银屑病的治疗效果,但部分患者由于经济条件或者有生物制剂禁忌症,因此需选择低毒、有效的重要制剂使用。养血解毒汤在临床治疗中取得了良好的疗效,主要应用于血燥型银屑病,血燥型相当于寻常型银屑病的静止期、缓解期,患者表现为口干咽燥,舌质淡、苔薄白、脉缓或沉。养血解毒汤以当归、鸡血藤养血活血润肤,土茯苓解毒祛湿,生地、拳参、丹参清热凉血,加入天冬、麦冬养阴生津,体现出养血润燥、凉血解毒的主要治则[11]。不少研究发现养血解毒汤对银屑病有良好的疗效,并能使银屑病相关免疫调节因子趋于正常[12-14]。本研究使用时随证加减,选用纯药成份颗粒制剂溶解后于皮损处外用。
IL-36是一群结构相似和功能相关联的细胞因子,主要包括IL-36α、IL-36β、IL-36γ和IL-36Ra。IL-36(α、β、γ)与IL-36受体特异性结合,进行细胞内信号转导,使跨膜受体胞内段Toll样受体(Toll/IL-1 receptor domain,TIR)结构域改变,进一步招募细胞内髓样分化因子(myeloid differentiation factor 88,MyD88),从而激活NF-κB通路和MAPKs通路[15],继而发挥促炎作用。有研究比较皮炎湿疹患者与银屑病患者的皮肤组织,发现银屑病患者皮损组织中IL-36水平明显高于皮炎患者皮肤组织[3]。另外,与正常人相比,银屑病患者血清IL-36水平亦有升高,与疾病严重程度呈正相关[16]。
本研究通过使用5%咪喹莫特乳膏建立银屑病样小鼠模型,自建模第2天起模型小鼠背部即出现银屑病样皮损改变,并逐日加重,在第8天银屑病样改变最明显,成模时间与国内冯艳等[17]描述相似。同时,实验组小鼠外涂养血解毒汤,观察发现实验组小鼠银屑病样改变逐渐减轻,在第8天实验组小鼠皮损PASI评分明显低于模型组,再次验证了养血解毒汤对银屑病的治疗疗效。显微镜下观察发现,实验组小鼠皮损无明显银屑病样改变,仅出现表皮增厚,且厚度明显薄于模型组,说明养血解毒汤能抑制角质形成细胞的过度增殖和角化不全,降低银屑病皮损的严重程度。对IL-36 mRNA水平及蛋白水平的检测发现,应用养血解毒汤后,小鼠皮肤中IL-36β表达明显降低,提示养血解毒汤对银屑病样皮损的影响主要通过IL-36β/IL-36R通路来调节。
综上所述,本研究证实了在银屑病样小鼠中使用养血解毒汤可明显减轻银屑病皮损的严重程度,其机制与IL-36β相关;为养血解毒汤治疗银屑病的理论依据带来了新发现,但其更详细的调控机制仍需进一步探究。

