游泳运动在干预2型糖尿病大鼠认知功能和海马形态结构中的作用及可能机制
刘艳秋,侯改霞,习雪峰,王 勇
(1.三明学院 体育与康养学院,福建 三明 365004;2.河南大学 体育学院,河南 开封 475001)
糖尿病脑病(diabetic encephalopathy,DE)是2型糖尿病的主要并发症之一[1],临床上主要表现为轻、中度认知功能障碍,大脑神经结构及生理功能改变,行为缺陷和获得性认知障碍。海马是与大脑记忆功能相关的重要核团,CA1区是海马主要功能区。海马对高血糖反应敏感,糖尿病机体大脑海马可表现为神经元数量减少,突触功能失常,胞体形态异常[2]。故研究2型糖尿病大鼠海马结构和生理功能的变化对揭示高血糖导致的认知功能障碍的发病机制有重要意义。糖尿病导致的血糖升高可使糖基化终末产物 (advanced glycation end product,AGEs)产生增加,AGEs与其受体RAGE(advanced glycation end product receptors,RAGE)结合,激活AGEs-RAGE信号通路,活化的AGEs-RAGE通路是糖尿病靶器官损害的重要原因之一[3-5]。Nardin P等[6]研究发现,糖尿病大鼠血清和脑脊液中的AGEs水平升高,海马RAGE表达增高,与糖尿病认知障碍关系密切。升高的AGEs可通过与其受体RAGE结合启动核转录因子(NF-κB)等信号途径,从而加重海马的炎症和氧化应激反应[7-8]。反过来,NF-κB的上调、炎症因子的增多、氧化应激反应的增加会进一步促进RAGE的表达,形成恶性循环,导致海马结构和生理功能的异常,进一步加重认知障碍。运动是防治2型糖尿病的常用辅助方法之一。已有研究发现,运动可通过降低糖尿病大鼠肾脏AGEs水平,改善肾脏纤维化[9]。那么,运动能否通过降低2型糖尿病大鼠海马AGEs水平及减弱AGEs-RAGE信号通路改善糖尿病脑病?这方面的研究还比较少见。本研究拟复制2型糖尿病大鼠模型,通过12周的游泳运动干预,来探讨运动对2型糖尿病大鼠认知功能及AGEs/RAGE/NOX2/氧化应激/NF-κB信号通路的影响,为运动防治2型糖尿病脑病方面的作用和机制研究提供理论依据。
1 材料与方法
1.1 2型糖尿病大鼠模型的建立、分组及运动干预
雄性SD大鼠30只,SPF级,购于郑州大学医学院实验动物中心。随机分为对照组(C组,6只)和高脂组(24只)。
高脂组饲喂高脂饲料6周,空腹12 h,腹腔注射链脲佐菌素(STZ,30 mg/kg),72 h后检测随机血糖,随机血糖≥16.7 mmol/L为暂时成模标准。1周后复查暂时成模大鼠,随机血糖仍≥16.7 mmol/L为2型糖尿病大鼠建模成功,将建模成功大鼠随机分为糖尿病组(D组,8只)和糖尿病运动组(DS,8 只)。
糖尿病运动组(DS)大鼠采用无负重游泳运动,水温(36±1)℃,游泳干预共12周,每周5 d。游泳运动具体时间安排为:第1周15 min/d,第2~6周以每周15 min递增延长,直到第6周延长至90 min/d;第 7~12 周,每天运动 90 min/d。
1.2 实验药品
链脲佐菌素(STZ)购自美国Sigma公司,氧化型谷胱甘肽(GSSG)和还原型谷胱甘肽(GSH)试剂盒购自碧云天生物研究所,丙二醛(MDA)和HE染色试剂盒购自南京建成生物研究所,兔抗大鼠多克隆抗体晚期糖基化末端产物 (AGEs)、晚期糖基化末端产物受体 (RAGE)、NADPH氧化酶2(NOX2)、二抗、DAB显色试剂购自武汉博奥森生物有限公司,BCA蛋白定量试剂盒购自北京鼎国生物技术有限责任公司。
1.3 取材及指标测定
为了避免最后一次游泳运动对动物造成的应激反应,在最后一次游泳运动结束48 h后,过夜禁食12 h,麻醉处死大鼠取材。
1.3.1 海马HE染色及AGEs免疫组化检测
脑组织固定、脱水、浸蜡、包埋、切片4 μm,HE染色。AGEs免疫组化染色采用SABC法,DAB显色,中性树脂封片,在Olympus显微镜400倍光镜视野下,每张切片随机选出6个视野并获取图像,采用IPP 6.0图像分析系统分析,得到平均光密度值(IOD)。
1.3.2 海马 RAGE、NOX2 免疫印迹(WB)检测及结果分析
取海马组织,加入裂解液,匀浆,裂解,离心,取上清备用。采用BCA法进行蛋白定量。制备分离胶和浓缩胶。经SDS-PAGE电泳,电转移到PVDF膜上,将膜移至封闭液封闭 1 h。将RAGE、NOX2一抗用5%的脱脂奶液稀释至适当浓度后与膜接触(RAGE、NOX2稀释比例均为1∶500),4℃孵育过夜。二抗室温下孵育2 h。化学发光、显影和定影。用生物凝胶成像分析仪扫描采图,采用Quantityone软件进行分析,计算目的条带与GAPDH条带的光密度值之比值。
1.3.3 RT-PCR 法检测海马 NF-κB mRNA 表达
取大鼠海马组织,采用TRIzol法提取总RNA,测定RNA的浓度与纯度,用DNase处理提取的RNA,以总RNA为模板,使用TOYOBO反转录试剂盒进行cDNA的合成。SYBR Green法检测基因,进行PCR反应。每个样品设置三个复孔,GAPDH为内参。基因相对定量△Ct法计算各基因表达量。以2-△△Ct表示该基因相对表达量。mRNA引物合成由北京鼎国生物公司完成。
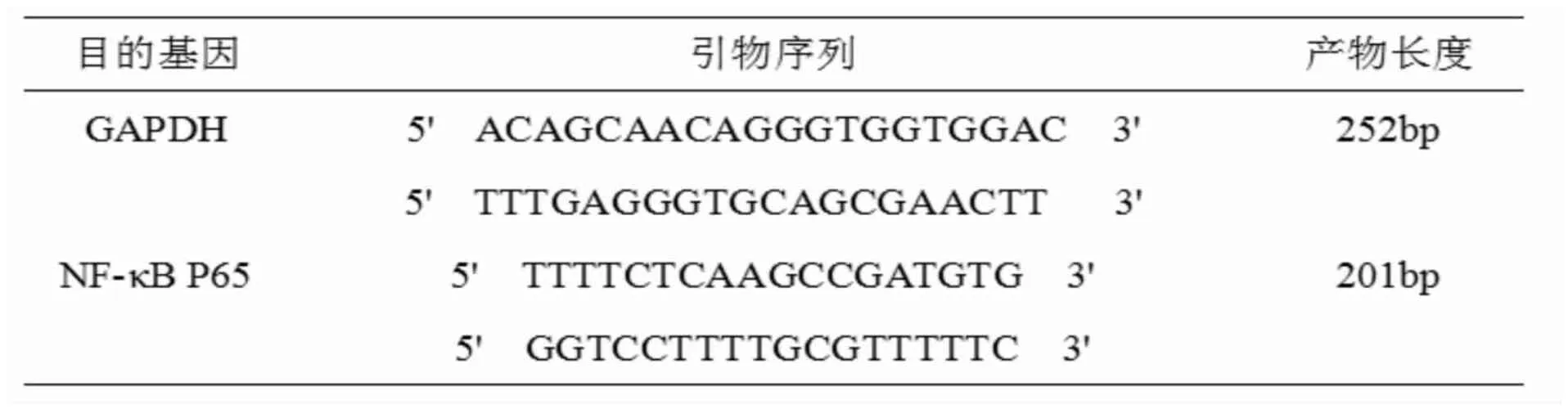
表1 目的基因的引物序列
1.3.4 新物体识别实验
黑色开放检测箱(50 cm×50 cm×80 cm),顶部安装摄像头观察动物的探索过程及活动情况。检测过程由适应期、熟悉期和测试期3个阶段组成。第1~3天为适应期,每天将大鼠放入检测箱内,熟悉环境10 min;第4天为熟悉期,将两个红色、形状、体积完全相同的正方体积木对称放在盒子一端,将大鼠背向积木放入盒内,大鼠自由探索10 min。测试期:间隔1 h后,开始测试。将一个红色积木替换为大小相近的绿色圆柱形积木,记录5 min内大鼠对新颖物体(绿色圆柱形积木)和熟悉物体(红色正方体)的探索时间,应用识别指数(recognition index,RI)来评价动物的学习记忆能力,与新颖物体触碰次数记为TN,与熟悉物体触碰次数记为TF,计算公式为RI=TN/(TN+TF)×100%。
1.4 统计学方法
2 结果
2.1 游泳运动对2型糖尿病大鼠海马CA1区锥体细胞形态结构的影响
由图1可知,正常组(C)CA1区的锥体细胞排列整齐致密,层次清楚,边界清晰,胞核饱满;糖尿病组(D)CA1区的锥体细胞排列紊乱,细胞肿胀,胶质细胞增生,细胞间隙增宽。与糖尿病组(D)相比,糖尿病运动组(DS)CA1区的锥体细胞排列偏整齐,细胞稍肿胀,细胞间隙缩小。

图1 游泳运动对2型糖尿病大鼠海马CA1区锥体细胞形态结构的影响(HE染色,×400)
2.2 新物体识别实验评价小鼠学习记忆
由图2可知,与正常组(C组)相比,2型糖尿病大鼠(D 组)RI显著降低(P﹤0.01);与糖尿病组(D组)相比,游泳运动显著升高了2 型糖尿病大鼠的 RI(P﹤0.05)。
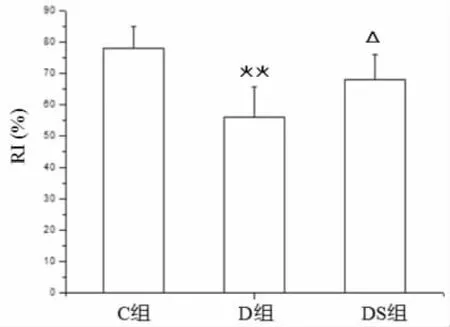
图2 游泳运动对2型糖尿病大鼠认知指数(RI)的影响
2.3 游泳运动对2型糖尿病大鼠海马CA1区AGEs平均光密度值(IOD)的影响
由图3~4可知,与正常组(C组)相比,2型糖尿病大鼠(D组)海马CA1区AGEs平均光密度值(IOD)显著升高(P﹤0.01);与糖尿病组(D组)相比,游泳运动显著降低了2型糖尿病大鼠海马CA1区AGEs的平均光密度值(IOD)(P﹤0.05),但仍高于正常组(C 组)(P﹤0.05)。
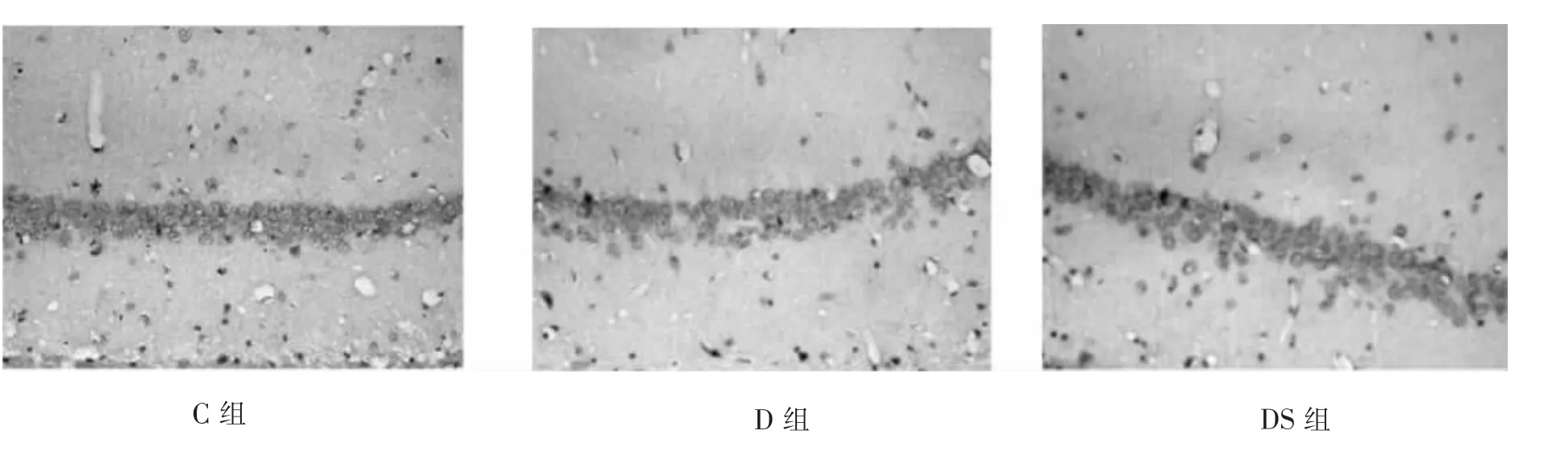
图3 游泳运动对2型糖尿病大鼠海马CA1区AGEs平均光密度值(IOD)的影响(免疫组化,×400)
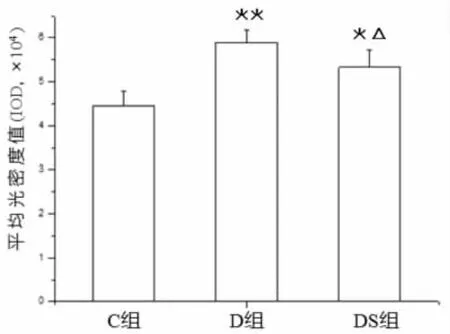
图4 游泳运动对2型糖尿病大鼠海马CA1区AGEs平均光密度值(IOD)的影响
2.4 游泳运动对2型糖尿病大鼠海马RAGE、NOX2蛋白表达的影响
由图5可知,与正常组(C组)相比,2型糖尿病大鼠(D组)海马RAGE、NOX2蛋白表达显著升高(P﹤0.01);与糖尿病组(D组)相比,游泳运动显著降低了2型糖尿病大鼠海马RAGE、NOX2蛋白表达(P﹤0.05),但仍高于正常组(C 组)(P﹤0.01 或 P﹤0.05)。
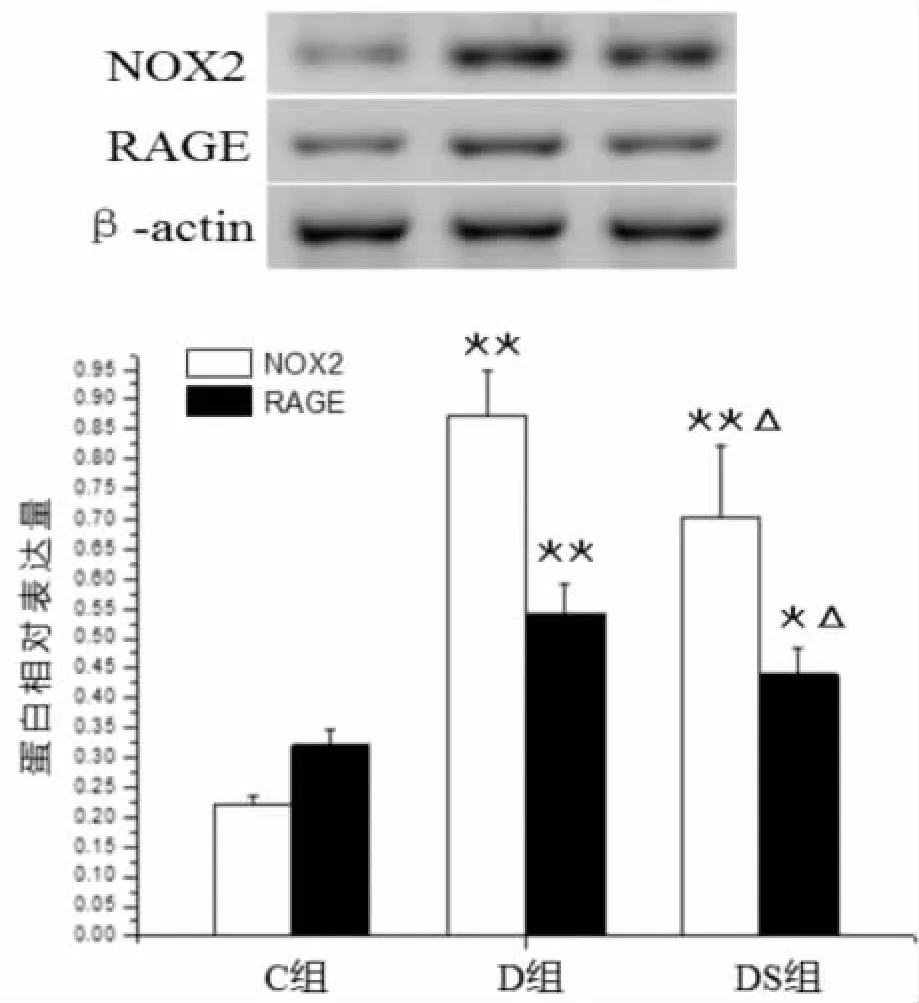
图5 游泳运动对 2 型糖尿病大鼠海马RAGE、NOX2蛋白表达的影响
2.5 游泳运动对2型糖尿病大鼠海马NF-κB mRNA表达的影响
由图6可知,与正常组(C组)相比,2型糖尿病大鼠(D组)海马NF-κB mRNA表达显著升高(P﹤0.01);与糖尿病组(D组)相比,游泳运动显著降低了2型糖尿病大鼠海马NF-κB mRNA表达(P﹤0.05),但仍高于正常组(C组)(P﹤0.05)。
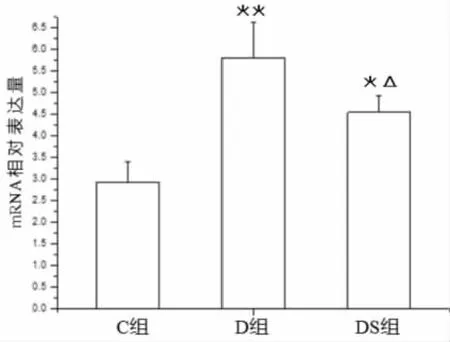
图6 游泳运动对2型糖尿病大鼠海马NF-κB mRNA表达的影响
2.6 游泳运动对2型糖尿病大鼠海马MDA、GSSG/GSH 的影响
由表2可知,与正常组 (C组)相比,2型糖尿病大鼠(D组)海马 MDA、GSSG/GSH显著升高 (P﹤0.01);与糖尿病组(D组)相比,游泳运动显著降低了2型糖尿病大鼠海马 MDA、GSSG/GSH(P﹤0.01 或 P﹤0.05),但仍高于正常组(C 组)(P﹤0.01 或 P﹤0.05)。

表2 游泳运动对2型糖尿病大鼠海马MDA、GSSG/GSH的影响
3 讨论
作为氧化应激和慢性高血糖产物的糖基化终末产物(advanced glycation end products,AGEs)一直被作为研究糖尿病各种慢性并发症的重要地位。AGEs的发生需要几周甚至几个月,因此多发生于半衰期长、转换率低的蛋白质。AGEs可通过交联形成大分子物质,沉积在大脑、肾脏、心血管等各种组织器官,从而导致脑组织以及其他器官的病变。
脑组织中AGEs的聚集主要产生以下毒性反应:①AGEs与其特异性受体RAGE结合,促进NADPH氧化酶(NADPH oxidase)活化,产生大量活性氧(ROS),进而激活核转录因子NF-κB,引起大量促炎细胞因子的生成,触发炎症反应,造成组织细胞的损伤[10];②Tau蛋白是神经细胞骨架成分含量最高的微管相关蛋白,可参与多种细胞功能。脑组织内Tau蛋白发生糖基化反应,造成微管结构受损,导致神经细胞功能障碍[11];③ β-淀粉样蛋白(amyloid β-protein,Aβ)具有很强的神经毒性作用。脑中Aβ被糖基化修饰后诱导细胞产生的氧化应激反应,能激活神经小胶质细胞并使其获得吞噬功能,进而引起神经元损伤[12]。总之,AGEs介导的损害作用可影响糖尿病动物海马神经元的产生,这或许是糖尿病相关抑郁症以及认知能力下降发病的潜在机制[13]。
AGEs与其受体RAGE结合过程中产生ROS,NADPH氧化酶在此过程中起着重要作用。AGEs可诱导表达野生型NADPH氧化酶的巨噬细胞产生ROS和细胞因子,而NADPH氧化酶中心亚基gp91phox缺失的巨噬细胞与AGEs共同作用,没有ROS和细胞因子的生成增加,提示NADPH氧化酶的活化在AGEs/RAGE介导的氧化应激中起了重要作用,RAGE或AGEs抑制剂均可阻止此信号通路[14]。 Zhang等[15]在心肌细胞、Nitti等[16]在神经细胞也证实AGEs/PKC-α/NADPH氧化酶活化通路的存在。NADPH氧化酶活化所诱导的ROS增多可激活MAPK、NF-κB和JAK/STAT等多条信号通路[17]。NADPH氧化酶介导核因子-κB(NF-κB)的活化可使炎症介质和细胞因子的转录增强,NADPH氧化酶抑制剂DPI(diphenyleneiodonium)可阻止此效应[18]。 Kim等[19]的研究也发现老年大鼠肾脏AGEs/RAGE表达增多可激活NADPH氧化酶,进而促进NF-κB的表达,山奈酚(kaempferol)可通过抑制NADPH氧化酶的活性进而下调NF-κB依赖的促炎基因的表达。
本文的研究发现,与正常组(C组)相比,2型糖尿病大鼠(D组)海马CA1区的锥体细胞的形态结构发生了改变,具体表现为排列紊乱,细胞肿胀,胶质细胞增生,细胞间隙增宽等。2型糖尿病大鼠(D组)海马CA1区AGEs集聚增多,海马RAGE和NOX2(NADPH氧化酶2)蛋白表达增多,氧化应激增强,NF-κB mRNA表达显著升高,糖尿病大鼠认知指数(RI)显著降低。由此推测,由于糖尿病导致的大鼠海马AGEs集聚增多,AGEs及其所引发的AGEs/RAGE/NOX2/氧化应激/NF-κB信号通路的增强可能在损害糖尿病大鼠认知能力中起着重要的作用。运动是防治2型糖尿病及其并发症的常用辅助方法之一。已有研究表明运动可降低糖尿病机体的血糖[20]和AGEs水平,提高糖尿病机体的抗氧化状态和胰岛素敏感性。本研究还表明,与糖尿病组(D组)相比,游泳运动降低了2型糖尿病大鼠海马CA1区AGEs的集聚,海马RAGE和NOX2(NADPH氧化酶2)蛋白表达下降,氧化应激减弱,NF-κB mRNA表达下降,糖尿病大鼠海马CA1区的锥体细胞的形态结构趋于正常,糖尿病大鼠认知指数(RI)得到提高。总之,运动在改善糖尿病大鼠认知功能及海马形态结构和功能方面起着一定的作用,具体机制可能与运动可以降低2型糖尿病大鼠海马CA1区AGEs的集聚,进而减弱AGEs所引发的AGEs/RAGE/NOX2/氧化应激/NF-κB信号通路有关。
综上所述,12周游泳运动可降低2型糖尿病大鼠海马CA1区AGEs的集聚、RAGE和NOX2蛋白表达,减弱大鼠海马氧化应激反应和NF-κB mRNA表达,进而改善糖尿病大鼠海马的形态结构和认知功能。

