高效液相色谱-蒸发光检测器法测定鸡蛋中卵磷脂的含量
孔凡华,王 轩,于连洋,白沙沙,徐佳佳,杨春雪,李 东,崔亚娟,
(1.北京市营养源研究所,北京 100069;2.中国农业大学食品科学与营养工程学院,北京 100083;3.北京城市学院生物医药学部,北京 100083)
卵磷脂是从植物或动物中提取出来的磷脂混合物,包括磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰肌醇(PI)、鞘磷脂(SM)及其他磷脂[1],天然卵磷脂广泛存在于动植物体内,以蛋黄、大豆内含量较多。按照原料的不同,分为蛋黄卵磷脂、大豆卵磷脂和菜籽卵磷脂。蛋黄卵磷脂是从蛋黄中提取并精制得到的天然磷脂混合物,主要为磷脂酰胆碱,蛋黄磷脂的脂肪酸组分大多为棕榈酸、油酸,其次为硬脂酸、亚油酸,并且还含有微量的花生四烯酸(AA)和二十二碳六烯酸(DHA)等多不饱和脂肪酸及奇数碳脂肪酸[2]。蛋黄卵磷脂具有抗氧化[3]、抗菌[4]、抗炎[5]、提高人体记忆和认识功能[6]、降低血压[7]和预防肥胖症[8]等重要的生理功能。
目前,磷脂的检测方法主要有紫外可见分光光度法[9]、薄层色谱法[10]、液相色谱法[11−12]、核磁共振法[13]、红外光谱法[14]和质谱分析法[15−16],其中高效液相色谱法灵敏度高、稳定性和重现性好,是最为有效的检测方法。现行国家标准方法有GB/T 35867-2018[17]《粮油检验 卵磷脂中磷脂含量的测定 高效液相色谱蒸发光散射检测法》适用于粗制含油卵磷脂、无油卵磷脂和从植物油脂中提取的卵磷脂的测定;GB 5009.272-2016[18]《食品安全国家标准 食品中磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇的测定》适用于含油大豆磷脂、脱油大豆磷脂、大豆油、菜籽油、花生油、葵花籽油中磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰肌醇(PI)的测定;SN/T 3851-2014[19]《出口食品中磷脂的测定 比色法》适用于肉制品、豆制品、乳制品、鸡蛋、花生、糖果等中磷脂含量的测定,只能测定鸡蛋中的总磷脂的含量,不能测定磷脂酰胆碱和磷脂酰乙醇胺的含量;NY/T 2004-2011[20]《大豆及制品中磷脂组分和含量的测定 高效液相色谱法》适用于大豆及制品(豆腐、豆浆、腐乳等)中磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇的测定;GB/T 5537-2008[21]《粮油检验 磷脂含量的测定》适用于植物原油、脱胶油及成品油中磷脂的测定。上述标准方法主要集中在大豆卵磷脂和菜籽卵磷脂的检测,尚缺少蛋黄卵磷脂检测的标准方法。
蛋黄卵磷脂具有重要的生理功能,成为人们关注的热点,蛋黄卵磷脂的研究起步较晚,目前国内蛋黄卵磷脂的检测多采用紫外分光光度法[22−23],利用最大吸收波长对卵磷脂进行定量分析,由于卵磷脂的紫外吸收波长较低,处于紫外吸收波长的末端,容易受到其他溶剂的干扰,影响定量结果。刘颖等[23]通过薄层色谱法定性检测蛋黄卵磷脂,但由于薄层色谱法需要较高的点样技术,且成功率低,使结果重现性差。示差折光检测器(RI)在定量分析卵磷脂时有一定的优势,但该检测器对温度敏感且灵敏度低,仪器平衡时间长,基线不容易稳定,限制了示差折光检测器的使用。龚雁等[24]报道了蛋黄中卵磷脂测定的HPLC-ELSD法,但是只建立了蛋黄中PC的检测方法,没有建立PE的检测方法,方法测得PC的加标回收率为98.2%~128.2%,方法准确度较低,且流动相体系用到了正己烷,大部分液相系统的密封圈不耐受正己烷溶液,限制了方法的使用。ELSD是通用型检测器,不容易受溶剂体系、梯度洗脱和基线干扰,具有高分辨率和快速分离的优势,是检测卵磷脂的理想检测器,本研究优化了HPLC-ELSD测定蛋黄卵磷脂的色谱条件,以鸡蛋为研究对象,进行方法学验证,考察方法的科学性、准确性和适用性,并通过测定已知磷脂含量的鸡蛋样品,对比研究蒸发光检测器和紫外检测器测定结果的准确性,以期建立鸡蛋中磷脂的精准分析检测技术。
1 材料与方法
1.1 材料与仪器
鸡蛋样品 采自超市;乙腈、甲醇、异丙醇 色谱纯,美国Fisher公司;磷脂酰胆碱标准品(纯度>99%)、磷脂酰乙醇胺标准品(纯度>98%)Sigma公司;氯化钠、氯仿、甲醇、乙酸、乙醚 分析纯,国药集团化学试剂有限公司。
EYELA MMV-1000W振荡器、EYELA N-1100 旋转蒸发仪 东京理化株式会社;Agilent 1260 高效液相色谱仪、蒸发光检测器和ChemStation for LC systems(版本序列号:Rev.B.04.03-SP2 [105])色谱工作站 美国Agilent公司;Cleanert氨基固相萃取柱 天津博纳艾杰尔科技有限公司。
1.2 实验方法
1.2.1 鸡蛋中总脂肪的提取 鸡蛋样品中总脂肪的提取参考Folch等[25]的方法。准确称取混匀的鸡蛋样品5 g(精确到0.0001 g),加入100 mL氯仿-甲醇(2:1,v/v),混匀并超声(功率为100 W)35 min,抽滤并收集滤液,用氯仿-甲醇(2:1,v/v)溶液重复清洗滤渣,将所收集滤液全部混合并入分液漏斗中。向分液漏斗中加入适量质量分数为0.9%的氯化钠溶液,振荡摇匀,静止30 min后,收集下层氯仿层,重复以上操作两次,将氯仿层合并,旋转蒸干。
1.2.2 鸡蛋中磷脂的纯化 磷脂的纯化参考GB 5009.272-2016[18]方法,将50 mL氯仿加入到收集的总脂肪中,涡旋混合均匀,将10.0 mL油脂氯仿溶液移入氨基硅胶固相萃取柱中,然后依次用2.0 mL氯仿-异丙醇(2:1,v/v)混合溶液和3.0 mL的乙酸-乙醚(2:144,v/v)混合溶液淋洗小柱,然后用3.0 mL甲醇洗脱出磷脂,再重复4 次,收集洗脱液。洗脱液在45 ℃旋转蒸发仪上蒸至近干,转为氮吹,吹干后加入10.0 mL甲醇溶液溶解,在4000 r/min下离心5 min,取上清液用于液相色谱分析。
1.2.3 色谱条件 色谱柱:Intersil SIL-100A色谱柱(4.6 mm×100 mm,5 μm);流速为0.8 mL/min;柱温30 ℃,ELSD采用分流模式,以空气作为雾化气,气体流速1.7 L/min,漂移管温度45 ℃;进样量为20 μL;流动相A:乙腈-异丙醇(55:5,v/v),流动相B:甲醇-异丙醇(35:5,v/v),洗脱程序为:0~14 min,A由70%变换至0,B由30%变换至100%;14~24 min,100% B保留10 min;24~25 min,A由0 变换至70%,B由100%变换至30%;25~45 min,70% A保留20 min。
1.2.4 方法验证 按照GB/T 27404-2008 《实验室质量控制规范 食品理化检测》[26]方法学要求,建立校准曲线及校准曲线的工作范围;逐步稀释样品上机测定,R(S/N)=3 时的测定浓度作为检出限,R(S/N)=10 时的测定浓度作为定量限;称取鸡蛋样品,按照实验优化的方法,平行测定6 次,计算磷脂酰胆碱和磷脂酰乙醇胺的含量和相对标准偏差,考察方法的重现性;根据鸡蛋中磷脂酰胆碱和磷脂酰乙醇胺的含量,按本底值的0.5 倍、1 倍、1.5 倍三个浓度水平,进行三水平六平行加标回收实验,以回收率的高低评价方法的准确度。
1.2.5 ELSD和UV检测方法比较研究 鉴于目前磷脂标准检测方法多采用紫外检测法[18−21],本实验进行了ELSD和UV检测方法的比较研究,参照GB 5009.272-2016[18],UV检测波长被选择205 nm,其他色谱条件不变,选取已知PC和PE含量的鸡蛋质控样品(质控样品由客户提供),PC和PE标示含量分别为20 mg/g和9 mg/g,按1.2.1 和1.2.2 前处理方法提取纯化磷脂后,平行测定6 次,分别进HPLCELSD和HPLC-UV液相系统分析,测定样品中PC和PE的含量。
1.2.6 实际样品的测定 选取市售不同品种的鸡蛋,按1.2.1 和1.2.2 提取纯化卵磷脂,按1.2.3 色谱条件进行液相色谱分析,计算不同品种鸡蛋中磷脂酰胆碱和磷脂酰乙醇胺的含量。
1.3 卵磷脂含量的计算
1.3.1 标准曲线的制作 将磷脂酰胆碱和磷脂酰乙醇胺标准系列工作液,按1.2.3 色谱条件进行液相色谱分析,根据磷脂酰胆碱和磷脂酰乙醇胺的保留时间定性,以标准工作溶液的浓度为横坐标,以峰面积为纵坐标,绘制标准曲线,外标法定量。
1.3.2 结果计算 试样中磷脂酰胆碱和磷脂酰乙醇胺的含量X以质量分数计,按下式计算:

式中:X-试样中磷脂酰胆碱、磷脂酰乙醇胺的含量,mg/g;ρ-从标准工作曲线上得到的磷脂酰胆碱、磷脂酰乙醇胺的浓度,mg/mL;V-试样溶液的体积,mL;m-试样的质量,g;f-稀释倍数。
1.4 数据处理
通过与仪器配套的ChemStation for LC systems工作站软件完成数据的采集与处理。
2 结果与分析
2.1 色谱条件的优化
HPLC法是卵磷脂分离和定量的常用方法,基于磷脂分子头部基团极性大小和磷脂上脂肪酸酰基链疏水性的不同,可以采用正相或反相系统洗脱。文献报道[27],磷脂分离常用的流动相体系为正己烷-异丙醇-水、乙腈-甲醇-水、氯仿-甲醇-水(氨水),考虑到氯仿-甲醇-水(氨水)体系ELSD基线噪音比较高[24],优先选择其他两种流动相体系。参考Zhou等[28]的方法,配制PC和PE混合标准溶液,甲醇-乙腈等度洗脱,结果显示,PC和PE可以达到基线分离,但两个峰间隔近20 min,且PE的色谱峰与溶剂峰非常接近。异丙醇具有改善峰形的作用,在流动相中加入少量异丙醇可以延长溶剂峰与目标峰的距离,故选择甲醇/乙腈/异丙醇梯度洗脱,PC和PE的标准色谱图和样品色谱如图1 和图2,可见PC和PE在优化的流动相体系下峰形良好,适合定量分析。

图1 PC和PE标准溶液液相色谱图(HPLC-ELSD)Fig.1 Chromatogram of phosphatidylcholine and phosphatidylethanolamine(HPLC-ELSD)
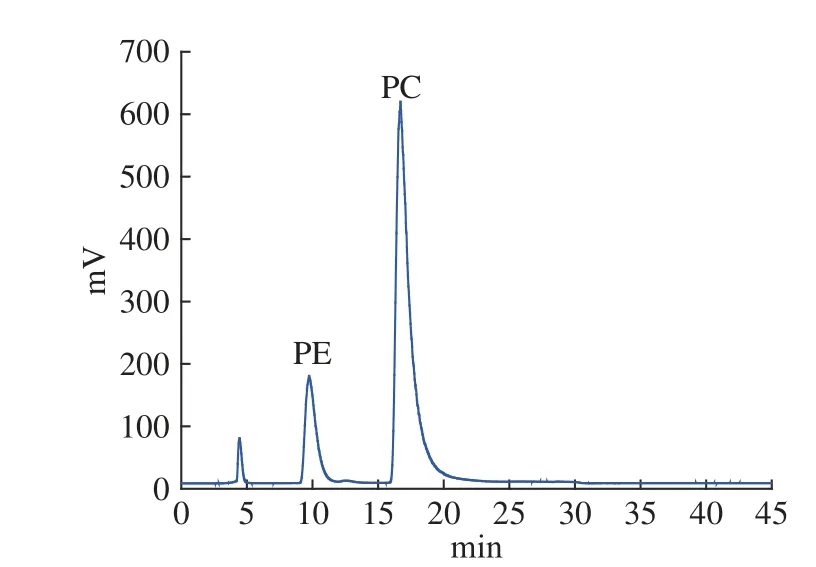
图2 鸡蛋中PC和PE液相色谱图(HPLC-ELSD)Fig.2 Chromatogram of phosphatidylcholine and phosphatidylethanolamine in egg(HPLC-ELSD)
2.2 方法学验证
2.2.1 线性关系、检出限及定量限 按1.2.1 和1.2.2提取纯化卵磷脂,在1.2.3 色谱条件下进行HPLC分析,得到磷脂酰胆碱和磷脂酰乙醇胺分别在0.052~1.031、0.041~0.823 mg/mL范围内,浓度与峰面积有良好的线性关系,PE的线性回归方程为y=0.0001x+0.0557,PC的线性回归方程为y=0.0002x+0.0677,回归系数均大于0.99,PC和PE的检出限分别为0.75 mg/g和0.60 mg/g,定量限分别为2.50 mg/g和2.00 mg/g。
2.2.2 精密度和重复性 取标准储备液,按照1.2.3色谱条件进行测定,重复测定6 次,PC和PE的峰面积的相对标准偏差(RSD)分别为2.55%和2.50%,表明仪器精密度良好,结果见表1。准确称取同一鸡蛋样品6 份,测定样品中PC和PE含量,结果显示鸡蛋中PC和PE含量及保留时间的RSD均小于5%,表明方法重复性良好,结果见表2。

表1 PC和PE的峰面积及其RSD%(n=6)Table 1 Peak area and RSD% of PC and PE (n=6)
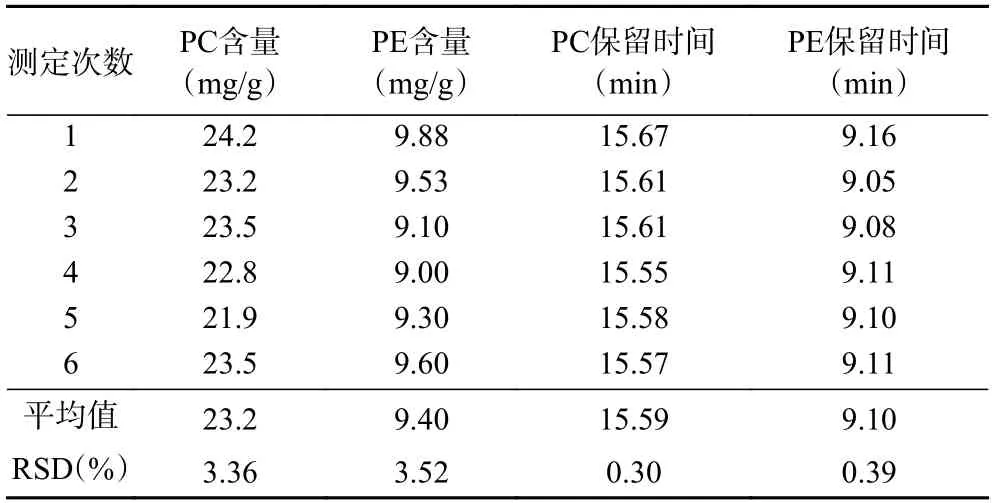
表2 鸡蛋中PC和PE的含量及保留时间(n=6)Table 2 Content and peak time of PC and PE in egg (n=6)
2.2.3 方法准确度实验 采用样品加标试验进行本方法准确度验证,结果见表3,由表3 知,鸡蛋中PC的回收率为93.0%~101.8%,平均回收率为97.4%,RSD为2.66%,PE的回收率为96.7%~106.7%,平均回收率为102.1%,RSD为3.99%,结果表明PC和PE准确度高,相对标准偏差小,适合鸡蛋中PC和PE含量的测定。
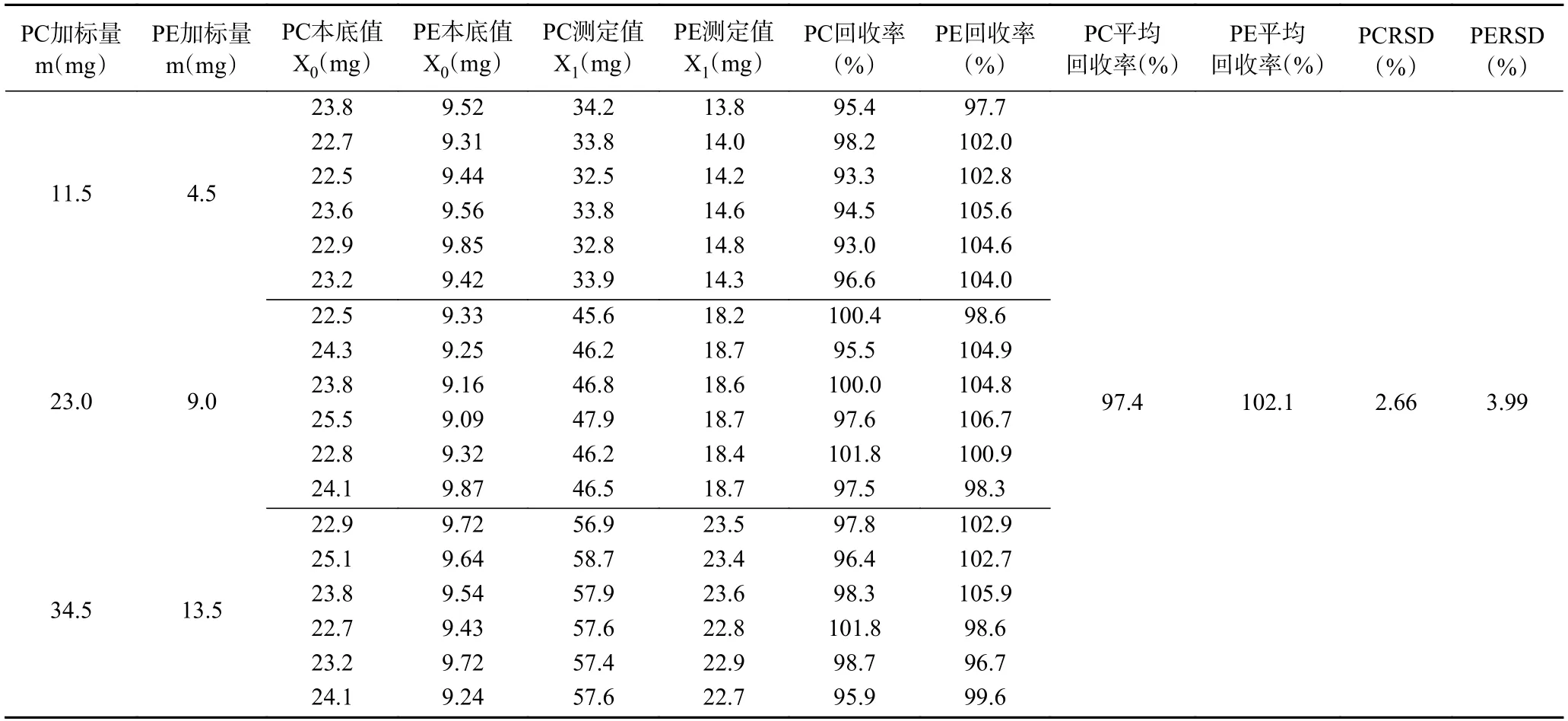
表3 鸡蛋加标回收率实验结果(n=6)Table 3 Results of recovery rate in egg (n=6)
2.3 ELSD和UV检测测定结果
选取PC和PE标示含量分别为20、9 mg/g鸡蛋质控样品,HPLC-ELSD测定PC和PE结果分别为21.9~24.2 mg/g和9.12~10.4 mg/g,HPLC-UV测定PC和PE结果分别为28.6~32.3 mg/g和13.7~14.8 mg/g,HPLC-ELSD测量结果更符合标示值,HPLC-UV和真值差别较大,这可能是因为卵磷脂处于紫外吸收波长的末端,紫外检测很容易受到溶剂和环境等因素的干扰,导致结果误差大,可见,蒸发光散射检测器更适合蛋黄卵磷脂的测定,本研究与龚雁等[24]研究结果相吻合。
2.4 样品的测定
不同鸡蛋中PC和PE的含量见表4,由表4 可知,不同品种鸡蛋中PC和PE含量差别较大,这是因为鸡的产地、品种和饲料等会影响蛋黄卵磷脂脂肪酸的组分,从而影响蛋黄卵磷脂的含量,张琳等[29]研究发现黄酮类化合物可以提高蛋黄卵磷脂的含量。
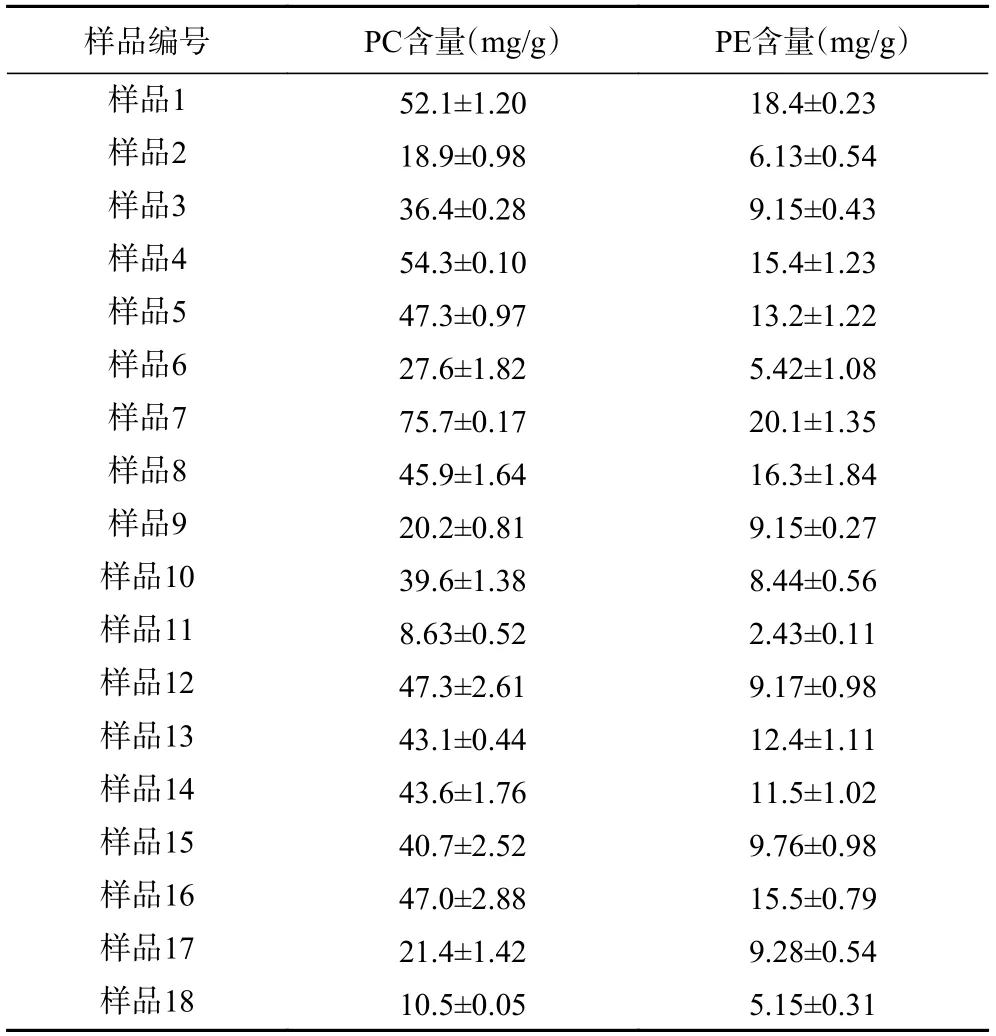
表4 鸡蛋中PC和PE的测定结果(n=3)Table 4 Content of PC and PE in eggs (n=3)
3 结论
蛋黄卵磷脂被广泛应用于医疗保健领域,目前,尚未建立蛋黄卵磷脂检测的标准方法,本实验采用反相色谱系统梯度洗脱,ELSD检测器检测,实现了对蛋黄卵磷脂中PC和PE的准确定量。甲醇-乙腈-异丙醇体系,对液相色谱仪器要求低,普适性强。建立的回归方程相关系数均大于0.99,PC和PE的检出限分别为0.75 mg/g和0.60 mg/g,定量限分别为2.50 mg/g和2.00 mg/g;鸡蛋中磷脂酰胆碱和磷脂酰乙醇胺精密度的相对标准偏差(RSD)分别为2.55%和2.50%,加标回收率分别为93.0%~101.8%和96.7%~106.7%。测定已知磷脂含量的鸡蛋样品,结果显示,与HPLC-UV相比,实验建立的HPLCELSD方法测定结果符合标示值,表明实验建立的方法可以对蛋黄卵磷脂准确定量。

