PCI并发冠脉穿孔致心包填塞14例临床分析
刘杰兵,马建飞
(沧州市中心医院 心血管内科,河北 沧州 061000)
0 引言
冠脉介入治疗已成为冠心病治疗的主要手段之一,随着手术量的增加,手术并发症亦有发生量的增加,此研究仅纳入2014年1月至2020年12月于我院心血管内科行PCI治疗并发冠状动脉穿孔致心包填塞的14例患者,对患者的临床资料进行回顾性分析,分析发生原因、心包填塞早期表现、诊断、治疗及预后。通过数据回顾性分析,得到以下结论:老年、女性、合并高血压可能是CPIPT危险因素,PCI术中或术后如患者出现恶心、胸闷、烦躁、大汗、低血压等情况应警惕的CPIPT可能,Ⅲ型穿孔所致CPIPT死亡率较高,及时发现并给以心包穿刺是治疗的关键。
1 资料与方法
1.1 一般资料。纳入我院心血管内科2010年1月至2018年12月行PCI 治疗并发冠状动脉穿孔致心包填塞(CPIPT)的14 例患者,其中男5例,女9例,年龄42~75岁;行急诊PCI 者术前顿服阿司匹林300 mg联合氯吡格雷300 mg或替格瑞洛180 mg;行择期PCI者术前3 d服用阿司匹林100 mg/d 氯吡格雷75 mg/d。术前根据体重静脉推注普通肝素(5190248),首剂用量100~120 U/kg,随手术时间延长适当补充1000~2000U。
1.2 研究方法。对14例患者的临床和PCI影像资料进行 分析造影结果用定量冠状动脉分析(quantitative coronary analysis,QCA)或目测进行评价(由2名主治医师资历以上的医师共同阅读影像资料),CAP的影像特征按照Ellis分型,对患者发生CAP的原因,并发心包填塞时的临床表现及处理措施、预后进行分析。Ellis分型分为三型:I型,对比剂呈龛影突出于血管腔外,但无渗漏;II型,对比剂漏至心包或心肌,但无喷射状漏出;III型,对比剂通过直径>1 mm的破口,对比剂呈喷射状外渗[1]。
2 结果
2.1 PCI合并CAP致心包填塞患者的一般临床特点。14例患者中男性5例(35.7%),平均年龄62.4岁,女性9例(64.3%),平均年龄63.5岁,所有患者平均年龄63岁;PCI心包填塞患者高危因素如表1所示。
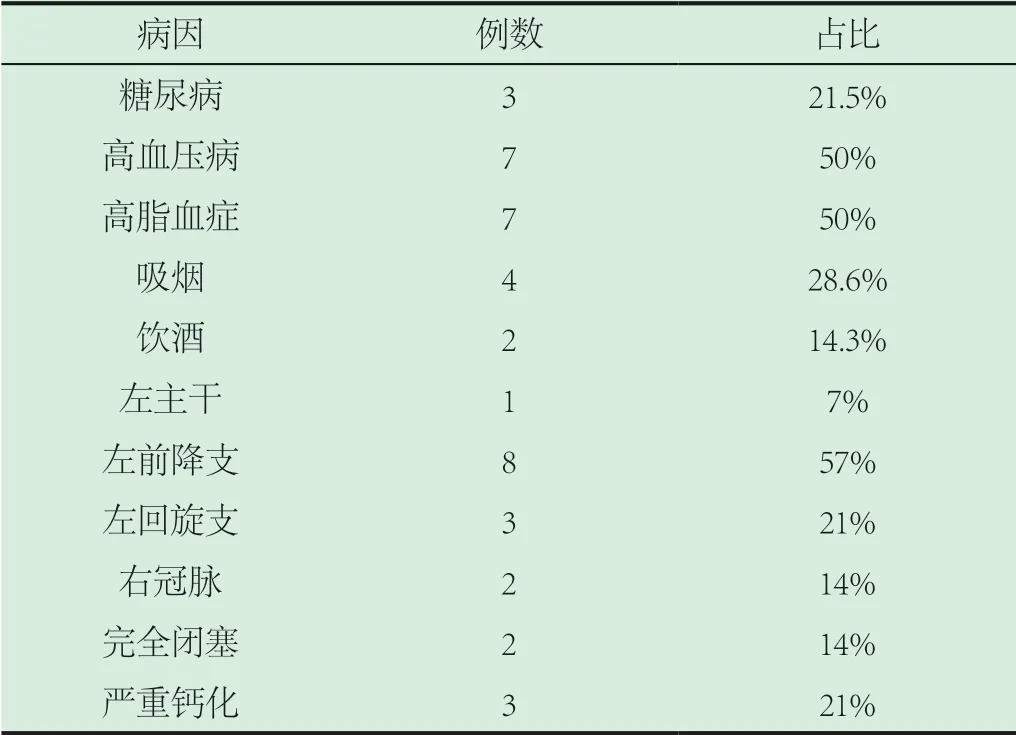
表1 PCI心包填塞患者高危因素
2.2 CAP的原因分析。14例患者中,导丝引起冠脉穿孔者3例,其中2例为CTO病变;支架引起的5例,预扩张球囊引起的2例,后扩张球囊引起的4例。2例术中造影未发现穿孔影像者考虑分别由后扩张球囊与支架相关。
2.3 PCI并发冠脉穿孔致心包填塞患者临床症状、急救措施及转归预后。14例患者中,10例患者术后出现迟发型心包填塞,于术后1~7.5 h出现。心包填塞时7例患者以现胸闷、胸痛为首发表现,6例患者出现恶心、呕吐,6例患者出现烦躁,2例患者出现突发意识丧失。所有患者均给予心包穿刺引流,10例患者单纯引流后联合抗感染等治疗后治愈;2例患者术中给予球囊低压力贴附后封堵穿孔部位后得以控制;2例患者给予球囊低压力贴附后均植入覆膜支架,其中1例转入外科继续治疗,术后终究因心包填塞死亡,另1例因突发室颤死亡。
3 讨论
冠状动脉穿孔是PCI少见但较为严重的并发症,如不给予重视严重者危及生命。PCI并发CAP的发生率为0.1%~3%。随着PCI技术的不断成熟,各种复杂病变行PCI治疗的例数不断增加以及各种新器械在PCI术中的应用,冠状动脉穿孔所致的心包压塞(CPIPT)的发生率也明显增加[2]。目前认为冠脉慢性闭塞性病变、严重的钙化、严重扭曲、分叉病变以及高龄、女性为CPIPT的易患因素,本组病例与国内外数据对比在易患因素方面比较一致。根据患者心包填塞发生时间,可分为PCI术中CPIPT及PCI术后延迟CPIPT。PCI术后延迟CPIPT一般发生于术后30 min至术后4 d,绝大部分发生于术后24 h内。
CAP的发生的原因一般认为与导丝、球囊、支架相关。导丝穿孔是冠状动脉穿孔的一大原因,国内同行报道39%的穿孔由其所致,尤其是超硬、亲水性导丝增加穿孔风险。本研究中3例由导丝引起的穿孔中,2例为CTO,1例为严重弥漫性狭窄病变。所用导丝1例Runthrouhg导丝,1例为Miracle3导丝,1例Fielder XT导丝。一般而言,单纯导丝穿孔很少引起严重的并发症,若导丝穿孔进入假腔未能及时辨认出而送入球囊进行扩张会引起急性心包填塞,本研究中使用Runthrouhg导丝未能多体位投影发现进入假腔而送入球囊扩张,术中即发生造影剂外渗引起心包积液,其余2例均于术后发生延迟性心包填塞。可见多体位造影显示导丝走行情况或对侧造影做好闭塞段远段指引路标可降低导丝所致CAP的发生率。球囊或支架直径过大(与血管腔比>1.2)、扩张压力过高、后扩张球囊与支架直径比值过大也是导致穿孔的重要原因,本研究中有5例因支架扩张压力过高、3例因后扩张球囊直径过大(多因患者术中放置2枚以上直径不一致支架,本着替患者节约经济的原因使用一个直径较大的后扩张球囊),1例后扩张球囊压力过大,2例预扩张球囊扩张后出现穿孔的均为弥漫性狭窄钙化病变。同时,CAP的发生与术者的经验、操作技巧等也 是密切相关的[3]。
PCI术中的CPIPT诊断主要依靠患者出现胸闷、胸痛等症状,C形臂下透视可见造影剂进入心包腔及心影外缘光亮环等,判断相对较为容易。术中发现造影剂外渗,及时于破口处给予球囊长时间低压力贴附封堵,然而,不得不承认的是,一次贴附封堵的成功率并不高,很多情况下需要反复多次长时间封堵,同时也需注意因球囊长时间堵塞导致的心肌长时间缺血、缺氧而出现的胸闷、胸痛、恶性心律失常的发生[4]。虽然近年来有研究表明覆膜支架在可增加支架内血栓形成及再狭窄的发生率,但急诊无外科支援情况下,覆膜支架不失为一种解决球囊低压力贴附治疗冠脉穿孔失败的一种较好选择。如果已使用IIb/IIIa抑制剂,可以静脉内使用鱼精蛋白逆转抗凝,或通过充气球囊导管的远端腔在冠脉穿孔处内缓慢注射100~300 IU凝血酶,建议注射浓度为50~100 IU/mL,凝血酶注射后保持10~15分钟的球囊充气,以留出足够的时间来产生纤维蛋白凝块的良好交联并防止活化的凝血酶的逆行作用,均能防止造影剂进一步外渗,减少CAP发生率。对于血管口径小的远端动脉穿孔,支架难以植入或者手术操作难度较高的,用聚乙烯醇,胶原泡沫,或金属线圈栓塞到穿孔血管中也是可以选择的治疗策略。如果对血管的损害很大,或非手术治疗具有局限性,如果使用上述方法未能密封穿孔,造成严重失血,或覆盖支架递送不成功,可以紧急行外科手术修补穿孔或行冠脉旁路移植术[5]。
PCI术后需密切关注患者的临床症状,对于PCI术后延迟CPIPT一定要有强烈的诊断意识,一旦患者出现胸闷、烦躁、大汗、血压下降、给予血管活性药物血压短时间内上升后又很快下降等情况时,高度警惕心包填塞存在可能,认识到冠脉穿孔是PCI术后心包填塞的重要原因之一,及时行床头心脏超声检查是必要的[6]。无论是PCI术中CPIPT及PCI术后延迟CPIPT,一旦诊断,避免使用IIb/IIIa抑制剂、立即给予心包穿刺引流都是治疗的关键。
综上所述,对于存在冠脉穿孔高风险的复杂PCI,一定要心存芥蒂。心包穿刺是救命技术,介入治疗是最佳处理手段,外科开胸手术是最后的防线。

