维持性腹膜透析患者继发性甲状旁腺功能亢进症危险因素分析
张圆圆,刘晓斌,王 凉
(南京医科大学附属无锡人民医院,江苏 无锡214000)
继发性甲状旁腺功能亢进症(SHPT)是慢性肾脏病(CKD)患者最常见的并发症之一,以甲状旁腺激素(PTH)水平升高和甲状旁腺腺体增生为主要表现[1]。随着透析龄延长,SHPT的发病率越高,有研究显示长期进行透析的患者出现SHPT的概率超过50%[2]。PTH是一种尿毒症毒素,其受体PTH-1广泛分布于骨骼、肾脏、皮肤、胰腺、心脏及循环系统等[3]。目前研究表明,PTH与其受体结合,不仅可导致肾性骨病、瘙痒、神经系统损害等,还可促进心房及肾脏去甲肾上腺素释放,与心脑血管钙化、心力衰竭、高死亡风险的发生密切相关[3-4]。Fisher等人研究发现高PTH是老年骨折患者死亡风险的独立预测因子,不依赖于维生素D水平[5]。Cawthon等人亦发现高PTH水平与老年患者的全因死亡率和心血管死亡相关,而低活性维生素D水平与全因死亡率和心血管死亡无关[6]。CKD继发SHPT的重症患者致残率明显高于一般CKD人群,心血管事件发生率和死亡率也明显增加[7-8]。本研究通过分析本院腹膜透析中心患者的数据库,旨在探讨维持性腹膜透析患者SHPT的相关影响因素,为临床更好的管理SHPT提供理论依据。
1 对象和方法
1.1 研究对象选取2019年1月至2019年8月在南京医科大学附属无锡人民医院肾内科腹膜透析中心规律随访的腹膜透析患者为对象。透析液均使用美国Baxter公司的葡萄糖透析液。纳入标准:1)年龄≥18岁;2)在本中心规律腹膜透析3个月以上;3)完成基础临床评估及实验室检查。排除标准:1)原发性甲状旁腺功能亢进患者;2)已行甲状旁腺切除术患者;3)合并严重感染、肿瘤、严重心血管疾病、消化系统疾病者。
1.2 方法根据患者情况调整用药及腹透液的类型和剂量,以期达到理想的钙、磷、PTH、血红蛋白及Kt/V值。收集患者性别、年龄、透析龄、血压、血常规、生化、Kt/V、Ccr等资料。iPTH>300 pg/ml时诊断继发性SHPT。根据iPTH值将患者分为继发性甲状旁腺功能亢进组和甲状旁腺功能非亢进组。
1.3 统计方法用SPSS 26.0软件进行统计分析,正态分布的连续变量用平均值±标准差表示,非正态分布采用中位数(四分位数间距)表示,计数资料用例(%)表示。计量资料两组间比较采用t检验或秩和检验,计数资料用卡方检验。相关因素分析采用Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的临床资料比较本研究共纳入73例患者,其中男性40例,女性33例。有40例患者诊断为SHPT,患病率为54.8%。与非亢进组患者相比,亢进组患者血红蛋白水平更低,而碱性磷酸酶水平更高,差异有统计学意义(P<0.05),见表1。亢进组患者的平均透析龄、磷及铁蛋白水平更高,但未达到统计学差异(P>0.05)。在性别比、年龄、血压、透析充分性、中性粒细胞水平、C反应蛋白(CRP)、白蛋白等方面,亢进组与非亢进组患者无明显差异。
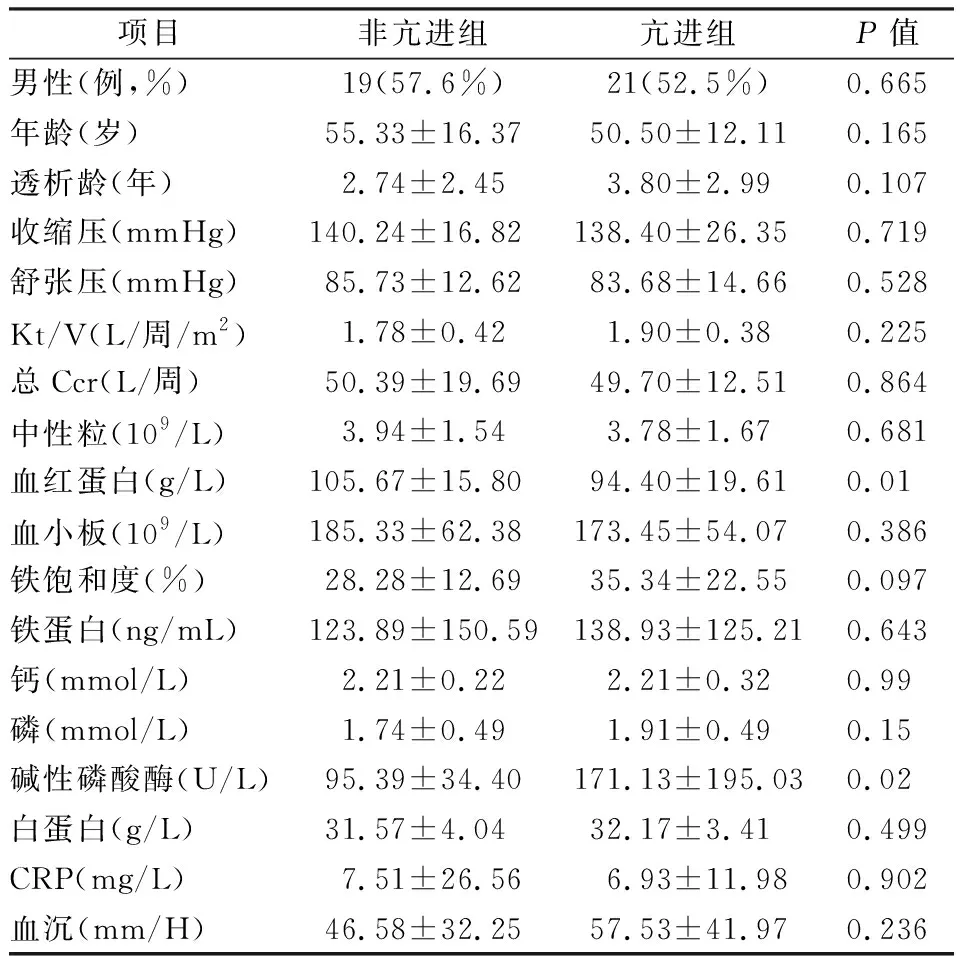
表1 两组患者的临床资料比较
2.2 SHPT相关因素的单因素Logistic回归分析将收集的临床指标作为变量与是否发生SHPT进行单因素Logistic回归分析,结果如表2所示,P<0.2的因素有血红蛋白、钙、磷、碱性磷酸酶、白蛋白。
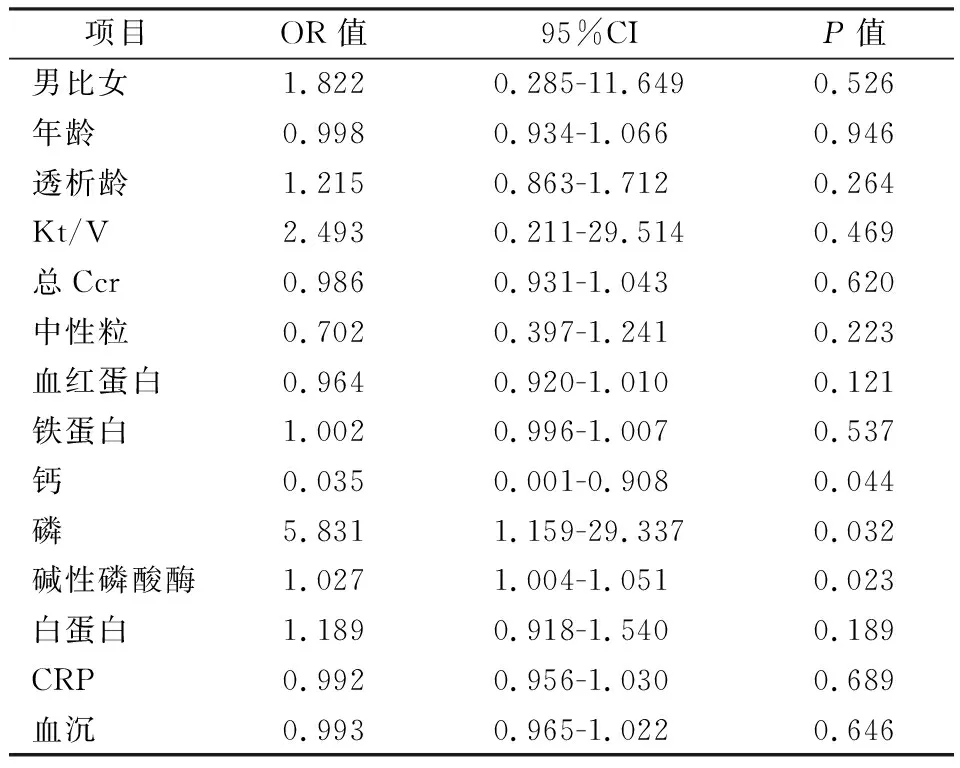
表2 SHPT相关因素的单因素Logistic回归分析
2.3 SHPT相关因素的多因素Logistic回归分析根据单因素分析的结果及既往的文献资料,将透析龄、Kt/V、总Ccr、血红蛋白、钙、磷、碱性磷酸酶、白蛋白、CRP、血沉作为变量与是否发生SHPT进行多因素Logistic回归分析,结果显示低血红蛋白、低钙、高磷、高碱性磷酸酶水平与SHPT的发生相关(P<0.05),而透析龄、Kt/V、总Ccr、白蛋白、CRP、血沉不是SHPT的独立相关因素,见表3。

表3 SHPT相关因素的多因素Logistic回归分析
3 讨论
随着对透析并发症认识的深入,慢性肾脏病矿物质与骨异常(CKD-MBD)越来越受到研究者和临床医生的重视。CKD-MBD以血钙、血磷、PTH、维生素D、成纤维细胞生长因子23(FGF23)水平紊乱及骨代谢异常为主要特点。几乎所有的透析病人均合并CKD-MBD。SHPT是CKD-MBD的中心环节,可加重钙磷代谢障碍和相关并发症的发生[1]。多项临床研究证实,继发于PTH升高所致的骨矿物质代谢异常与透析患者的骨折、血管钙化、死亡等不良预后相关[9-11]。对SHPT发病机制及治疗的探索是国际研究热点。
本研究通过分析腹膜透析患者的临床数据,旨在探索SHPT患者的相关危险因素。结果发现73例患者中有40例为SHPT,患病率为54.8%,高于中山大学第一医院(46.95%)及加拿大(47%)的患病率[12-13]。这可能与本组患者平均腹透时间更长及病例较少引起的偏差有关。有报道显示随着腹透时间延长,SHPT的患病率增加[12]。通过Logistic回归分析,研究发现低血红蛋白、低钙、高磷、高碱性磷酸酶水平是SHPT的相关危险因素。低钙、高磷、高碱性磷酸酶导致SHPT已成共识,其相关机制亦有较多报道[14],主要进展包括以下几个方面:1)低钙血症:血钙与血PTH呈反S线关系,SHPT时该曲线右移,钙调定点上移,需要更高浓度的钙离子来抑制PTH分泌。而透析患者由于活性维生素D下降、胃肠道吸收减少等原因可致低钙血症,从而刺激贮存于甲状旁腺细胞分泌泡内的PTH释放增加。此外,低钙血症还能通过刺激甲状旁腺细胞增生和增加PTH mRNA表达的方式来加重SHPT。2)钙敏感受体(CaSR)表达下调:细胞外升高的钙离子可激活CaSR,通过磷酸肌醇途径使细胞内钙离子浓度升高,抑制细胞释放PTH,促进PTH 的胞内降解,进而降低血PTH水平。SHPT患者甲状旁腺中CaSR表达下调,且病变愈重表达愈低,使甲状旁腺对钙离子的调节作用敏感性降低,导致SHPT的发生和加重[15]。3)高磷血症:高磷血症与血钙结合成磷酸钙沉积于软组织并抑制肠道钙的吸收,加重低钙血症;此外,高磷血症能抑制肾脏1α-羟化酶的活性,减少活性维生素D的形成;近年有研究发现高磷血症还可直接刺激甲状旁腺组织增生,促进PTH分泌。4)活性维生素D系统异常:活性维生素D一方面可通过与PTH基因启动子上的维生素D受体作用直接抑制PTH合成,另一方面可促进胃肠道钙吸收以升高血钙间接抑制PTH分泌,CKD患者体内活性维生素D合成减少,加上甲状旁腺细胞膜上维生素D受体的减少或敏感性降低,使甲状旁腺对活性维生素D抑制作用不敏感,加剧SHPT。5)FGF23-FGFR1/Klotho通路异常:FGF23是由成骨细胞和骨细胞分泌产生的一种具有内分泌功能的蛋白质,可通过抑制近端肾小管对磷的重吸收及抑制甲状旁腺PTH和肾脏活性维生素D的合成作用降低血磷。Klotho是一种跨膜蛋白,可调节FGF23的活性并决定FGF23的组织特异性。在甲状旁腺中,FGF23 与 FGFR1/Klotho结合后可通过下游信号通路抑制甲状旁腺增生及PTH的合成和分泌。CKD时患者甲状旁腺细胞中Klotho、FGFR1表达下调,导致FGF23不能有效的对甲状旁腺分泌PTH进行调节,甲状旁腺细胞对高FGF23的调节作用产生抵抗,致使PTH分泌持续增多,SPHT逐渐加重。针对上述机制,目前临床治疗高PTH血症方面亦有一些新的进展:1)活性维生素D制剂:包括骨化三醇及活性维生素D类似物如帕立骨化醇或马沙骨化醇,因维生素D类似物可减少高钙血症的发生,临床应用前景较好。2)CaSR激动剂:第一个批准用于临床的CaSR激动剂是西那卡塞,可模仿细胞外钙离子对甲状旁腺细胞的作用,增加钙受体的敏感性,降低PTH的同时降低血钙、血磷,抑制和减缓甲状旁腺的增生。目前二代拟钙剂伊特卡赛肽在欧洲、美国也已应用于临床。3)手术:多适用于药物难以控制或抵抗的SHPT。
高PTH水平与贫血的关系目前尚未明确,有临床研究提示SHPT可促进肾性贫血,降低PTH水平可改善贫血并降低促红细胞生成素(EPO)抵抗[16-17]。关于CKD SHPT致肾性贫血的机制主要有以下几个方面:1)iPTH及其末端可激活红细胞膜表面的钙泵,并进一步触发钙离子通道,促使细胞内钙离子浓度增加,致红细胞膜渗透脆性增大,红细胞易被破坏[18]。2)高PTH抑制Na+-K+-ATP酶的活性,红细胞糖酵解受阻,细胞内ATP产生不足,干扰红细胞的能量代谢,使红细胞寿命缩短[19]。3)高 iPTH下调骨髓红系祖细胞膜EPO受体表达,抑制红系祖细胞的的增殖与分化,使红细胞生成减少[20]。4)高iPTH致成骨细胞分泌的IL-6,可抑制低氧所诱导EPO的分泌,使内源性EPO生成下降[21]。5)高 iPTH 增强破骨细胞活性,诱导骨髓纤维化,导致严重的纤维囊性骨炎,破坏骨髓造血微环境[22-23]。6)通过FGF-23,降低肾EPO mRNA表达[24]。本研究结果提示腹膜透析合并SHPT患者的血红蛋白水平更低,且Logistic回归分析显示血红蛋白是SHPT的独立危险因素,再一次证实了两者之间的相关性。临床上,SHPT与贫血的治疗多是分开的,本研究结果为综合管理SHPT和贫血提供了依据。
本研究发现亢进组患者的平均透析龄更高,但未达到统计学差异,进一步的相关性分析提示透析龄与SHPT无明显相关性,与已有报道不一致[12],这可能与本研究纳入的病例数过少及透析方式差异等因素有关。在透析充分性、白蛋白及炎症指标(CRP、中性粒细胞水平)方面,未得到其与SHPT相关的结果。

