澳洲鳗鲡(Anguilla australis)不同生长阶段的生物学耐受性特征及其演变趋势*
魏金生 江兴龙 王泽旭 李 凯
澳洲鳗鲡()不同生长阶段的生物学耐受性特征及其演变趋势*
魏金生1, 2江兴龙1, 2①王泽旭1, 2李 凯1, 2
(1. 集美大学水产学院 厦门 361021; 2. 鳗鲡现代产业技术教育部工程研究中心 厦门 361021)
以不同生长阶段的澳洲鳗鲡为对象, 研究澳洲鳗鲡白仔、黑仔、幼鳗和成鳗的耗氧率、窒息点、对水温、非离子氨、亚硝酸盐的耐受性特征及其演变趋势。结果表明, 白仔、黑仔、幼鳗和成鳗的昼间与夜间耗氧率都随体质量增大而下降。但昼夜间均存在显著差异(<0.05)。在15—30 °C, 耗氧率与水温呈正相关。并得到了白仔、黑仔、幼鳗和成鳗的耗氧率和水温回归方程。在水温25 °C, 白仔、黑仔、幼鳗和成鳗的窒息点溶解氧浓度随体质量增大而下降。14—29 °C为澳洲鳗鲡适温范围。具体来说, 25—29 °C为白仔和黑仔最适生长温度, 23—29 °C为幼鳗和成鳗最适生长温度, 随体质量增加对水温的耐受性增强。水中非离子氨对白仔、黑仔、幼鳗和成鳗的半致死浓度分别为2.35、7.96、2.94和2.62 mg/L, 安全浓度为0.24、0.80、0.29和0.26 mg/L, 可见黑仔的耐受性最强。亚硝酸盐对白仔、黑仔、幼鳗和成鳗的半致死浓度分别为52.07、63.80、691.89和885.12 mg/L, 安全浓度为5.21、6.38、69.19和88.51 mg/L。因此, 随体质量的增加, 澳洲鳗鲡对亚硝酸盐的耐受性增强。
澳洲鳗鲡(); 耗氧率; 窒息点; 非离子氨; 亚硝酸盐
鳗鲡作为营养价值丰富的高档水产品, 素有“水中人参”的美誉, 自20世纪90年代中期以来, 我国在养鳗产量、养鳗种类和养殖模式均居世界领先地位, 成为世界的养鳗中心(翟少伟等, 2019)。我国鳗鲡主要养殖种类有日本鳗鲡()、欧洲鳗鲡()、美洲鳗鲡()、花鳗鲡()和太平洋双色鳗鲡()等, 2018年我国鳗鲡养殖总产量23.3万t (农业农村部渔业渔政管理局等, 2019)。随着养殖产量逐年增加, 鳗苗市场需求增长导致苗种资源短缺、价格上涨和养殖成本的提高。为保证养殖产业的可持续发展, 寻找和开发新的鳗鲡种质资源。澳洲鳗鲡()又称澳洲短鳍鳗, 作为一种潜在养殖对象, 种质资源丰富。澳洲鳗鲡成鱼主要分布于澳大利亚本土和塔斯马尼亚州的东海岸, 南纬27°—44°, 产卵于热带海域, 鳗苗随着南赤道洋流漂流至澳大利亚东海岸, 在澳大利亚东海岸的费茨罗伊河口至南端的塔温河均有分布。产苗季节高峰主要在每年7—9月, 为澳洲冬季到春季之间(Shiao, 2002)。澳洲鳗鲡在澳大利亚主要以捕捞为主, 国内外尚未开展规模养殖, 对其养殖环境生态因子和生理学研究很少, 仅有澳洲鳗鲡耗氧率的研究报道(Forster, 1981)。本文开展不同生长阶段澳洲鳗鲡对水温、非离子氨和亚硝酸盐等水质因子的耐受性研究, 以及耗氧率和窒息点的研究, 以期为澳洲鳗鲡在我国进行大规模养殖、运输和生理生态研究提供科学依据。
1 材料与方法
1.1 试验材料
集美大学水产试验场自行养殖的不同生长阶段澳洲鳗鲡。试验前鳗鲡均停食48 h, 在25 °C条件下暂养48 h; 试验用水经曝气一周备用, pH 7.0±0.1。
1.2 试验方法
1.2.1 不同生长阶段澳洲鳗鲡对水温的耐受性试验 将体质量(0.179±0.011) g的白仔、(2.831±0.093) g的黑仔、(50.270±1.560) g的幼鳗和(251.850±5.630) g的成鳗放入有效体积为5 L的水族箱内, 通过无光的恒温培养箱进行控温; 保持溶氧6.2—7.2 mg/L, pH 7.0±0.1, 各生长阶段澳洲鳗鲡试验设置3个平行, 每个平行放置10尾。耐高温试验从27 °C依次上升至39 °C; 耐低温试验从27 °C依次降低至0 °C。升温或降温幅度每次调节1 °C, 达到目标温度后观察4 h, 如果出现死亡或者休克, 则延长1 h观察时间。记录鳗鲡的活动情况和死亡率。
1.2.2 非离子氨对不同生长阶段澳洲鳗鲡的毒性试验 通过NH4Cl配置试验溶液, 每个浓度设置两个平行, 每个平行加入不同生长阶段澳洲鳗鲡10尾, 控制水温25 °C, pH 7.0±0.1, 以经过曝气自来水为对照。体质量(0.297±0.013) g的白仔试验中非离子态氨的浓度梯度为0.125、0.5、1、2、4、8 mg/L; 体质量(2.950±0.109) g的黑仔试验中非离子态氨的浓度梯度为0.125、0.5、2、4、8、32 mg/L (樊海平等, 1997); 体质量(49.930±3.610) g的幼鳗和(250.750±8.540) g的成鳗试验中非离子态氨的浓度梯度为0.125、0.5、1、2、4、8 mg/L。每24 h更换试验液, 记录鱼的死亡数量。采用直线内插法计算非离子态氨对澳洲鳗鲡24、48、72、96 h的半致死浓度(LC50), 应用公式: 安全浓度(SC) = LC50(96 h) × 0.1计算安全浓度, 参考姜礼燔(1995)。
1.2.3 亚硝酸盐对不同生长阶段澳洲鳗鲡的毒性试验 通过NaNO2配制试验溶液, 每个浓度设置两个平行, 每个平行加入不同生长阶段澳洲鳗鲡10尾, 控制水温25 °C, pH 7.0±0.1, 以经过曝气自来水为对照。体质量(0.296±0.010) g的白仔和(2.960±0.116) g的黑仔试验中亚硝酸盐的浓度梯度为20、40、60、80、100 mg/L; 体质量(49.140±6.110) g的幼鳗和(252.080±11.170) g的成鳗试验中亚硝酸盐的浓度梯度为300、600、900、1 200、1 500 mg/L。每24 h更换试验液, 记录鱼的死亡数量。计算半致死浓度(LC50)和安全浓度。
1.2.4 不同生长阶段澳洲鳗鲡窒息点的研究 在水温(25±1) °C, pH (7.0±0.1)的条件下对体质量(0.299±0.011) g的白仔、(2.899±0.120) g的黑仔、(49.290±4.160) g的幼鳗和(249.760±6.980) g的成鳗进行窒息点试验, 每个试验装置有效体积5 L, 放入鳗鱼10尾, 待鱼状态稳定后。记录澳洲鳗鲡死亡1尾、死亡50%以及全部死亡时的溶解氧浓度。以50%死亡时的呼吸室水体溶氧为窒息点。自制静水式呼吸室, 如图1所示。

图1 澳洲鳗鲡窒息点测定试验装置
1.2.5 不同生长阶段澳洲鳗鲡耗氧率研究 在50 L方形聚乙烯装置进行体质量(0.289±0.005) g的白仔和(2.981±0.058) g的黑仔耗氧率试验, 在1 m3聚乙烯装置进行体质量(49.610±5.010) g的幼鳗和(250.970±8.830) g的成鳗耗氧率试验, 采用自动恒温加热棒和冰块控制水温。试验开始待鱼稳定后停止曝气, 采用聚酯薄膜(PET)包裹顶部, 同时在边缘加入加热棒和虹吸采样管, 四周采用石蜡进行密封处理。通过控制变量法, 分别测定不同生长阶段澳洲鳗鲡在25 °C下, 24 h耗氧率随昼夜变化情况, 重复测定三次。同时测定不同生长阶段澳洲鳗鲡在15、20、25和30 °C下耗氧率情况。
1.3 数据处理
试验数据处理使用SPSS 25.0进行统计分析, 以<0.05作为显著性差异的标志。文中数据表述方式均为平均值±标准差。耗氧率(ROC)的计算公式如下:
耗氧率[mg/(kg·h)] = [(起始–结束)×] / (×), (1)
式中,起始代表试验开始时装置内溶解氧浓度(mg/L);结束代表试验结束时装置内溶液氧浓度(mg/L);表示装置内有效水体积, 测定24 h耗氧率变化规律时=1–2;1表示采样前体积(L),2表示采样损耗的体积(L);表示时间(h);表示鱼的总重(kg)。
2 结果
2.1 不同生长阶段澳洲鳗鲡对水温的耐受性
澳洲鳗鲡在不同水温下死亡率见表1。不同生长阶段的澳洲鳗鲡在14—34 °C范围内均能够存活, 在14 °C以下无聚群现象, 对外界刺激反应迟钝, 在14—22 °C范围内开始有聚群现象, 在23 °C开始幼鳗和成鳗均正常活动, 大多数集群静卧于水底, 受外界光和声音刺激反应明显, 在25 °C以上白仔和黑仔开始正常活动, 沿着玻璃壁正常环游, 在29 °C以上均开始出现呼吸频率过快, 反应过激。耐高温试验中, 死鱼被黏液大量包裹, 体色变淡, 鳃部有大量黏液流出; 白仔在35 °C开始出现死亡, 在39 °C全部死亡; 黑仔在36 °C开始出现死亡, 在39 °C全部死亡; 幼鳗和成鳗在37 °C开始出现死亡, 在39 °C均全部死亡。耐低温试验中, 白仔在6.5 °C开始死亡, 0 °C全部死亡; 黑仔在3 °C开始出现死亡, 1 °C全部死亡; 幼鳗在1 °C开始出现死亡, 在0 °C仅出现20%死亡; 成鳗在0 °C只有10%出现死亡; 澳洲鳗鲡对水温耐受性为成鳗>幼鳗>黑仔>白仔。
2.2 非离子态氨对不同生长阶段澳洲鳗鲡的毒性
不同生长阶段澳洲鳗鲡在不同浓度非离子氨氮下死亡率结果见表2、表3、表4和表5, 各浓度随着时间延长非离子氨氮对鱼的毒性越强, 死亡率越高。通过直线内插法计算不同生长阶段澳洲鳗鲡对非离子氨氮半致死浓度结果见图2, 在四种生长阶段下, 黑仔对于非离子氨氮耐受性最强, 安全浓度为0.80 mg/L>幼鳗0.29 mg/L>成鳗0.26 mg/L>白仔0.24 mg/L; 白仔24、48、72和96 h的半致死浓度分别为3.66、3.08、2.63和2.35 mg/L; 黑仔24、48、72和96 h的半致死浓度分别为17.99、13.34、9.89和7.96 mg/L; 幼鳗24、48、72和96 h的半致死浓度分别为5.32、4.33、3.52和2.94 mg/L; 成鳗24、48、72和96 h的半致死浓度分别为4.39、3.58、3.04和2.62 mg/L。
表1 澳洲鳗鲡对水温的耐受性

Tab.1 The tolerance of A. australis to water temperature
表2 非离子氨氮对澳洲鳗鲡白仔的急性毒性试验死亡率结果(%)

Tab.2 Mortality results (%) of acute toxicity test of non-ionic ammonia on glass eels of A. australis
表3 非离子氨氮对澳洲鳗鲡黑仔的急性毒性试验死亡率结果(%)

Tab.3 Mortality results (%) of acute toxicity test of non-ionic ammonia on fingerlingsof A. australis
表4 非离子氨氮对澳洲鳗鲡幼鳗的急性毒性试验死亡率结果(%)

Tab.4 Mortality results (%) of acute toxicity test of non-ionic ammonia on juvenile eels of A. australis
表5 非离子氨氮对澳洲鳗鲡成鳗的急性毒性试验死亡率结果(%)

Tab.5 Mortality results (%) of acute toxicity test of non-ionic ammonia on yellow eels of A. australis

图2 不同生长阶段澳洲鳗鲡对非离子氨氮的耐受性
2.3 亚硝酸盐氮对不同生长阶段澳洲鳗鲡的毒性
不同生长阶段澳洲鳗鲡对亚硝酸盐氮耐受性死亡率结果分别见表6、表7、表8和表9。白仔、黑仔、幼鳗和成鳗对亚硝酸盐氮耐受性结果见图3, 随着体质量增加, 澳洲鳗鲡对于亚硝酸盐氮的耐受性增强, 成鳗耐受性最强, 安全浓度为88.51 mg/L>幼鳗69.19 mg/L>黑仔6.38 mg/L>白仔5.21 mg/L; 白仔24、48、72和96 h的半致死浓度分别为73.69、62.87、57.21和52.07 mg/L; 黑仔24、48、72和96的半致死浓度分别为99.53、82.43、73.18和63.80 mg/L; 幼鳗24、48、72和96 h的半致死浓度分别为995.19、933.73、831.01和691.89 mg/L; 成鳗24、48、72和96 h的半致死浓度分别为1 459.36、1 053.91、962.29和885.12 mg/L。
表6 亚硝酸盐氮对澳洲鳗鲡白仔的急性毒性试验死亡率结果(%)

Tab.6 Mortality results (%) of acute toxicity test of nitrite nitrogen on glass eels of A. australis
表7 亚硝酸盐氮对澳洲鳗鲡黑仔的急性毒性试验死亡率结果(%)
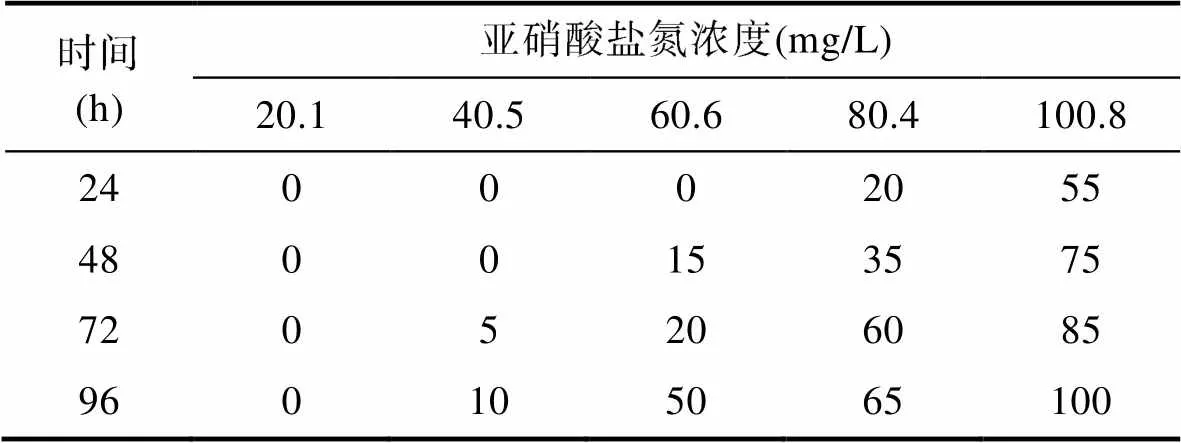
Tab.7 Mortality results (%) of acute toxicity test of nitrite nitrogen on fingerlings of A. australis
表8 亚硝酸盐氮对澳洲鳗鲡幼鳗的急性毒性试验死亡率结果(%)

Tab.8 Mortality results (%) of acute toxicity test of nitrite nitrogen onjuvenile eels of A. australis
表9 亚硝酸盐氮对澳洲鳗鲡成鳗的急性毒性试验死亡率结果(%)

Tab.9 Mortality results (%) of acute toxicity test of nitrite nitrogen on yellow eels of A. australis

图3 不同生长阶段澳洲鳗鲡对亚硝酸盐氮耐受性
2.4 不同生长阶段澳洲鳗鲡的窒息点
通过对体质量(0.299±0.011) g的白仔、(2.899± 0.120) g的黑仔鳗、(49.290±4.160) g的幼鳗和(249.760±6.980) g的成鳗进行窒息点试验, 结果如图4。随着澳洲鳗鲡体质量增加, 白仔、黑仔、幼鳗和成鳗在2.12、1.78、1.54和1.37 mg/L时开始出现死亡, 在1.37、0.91、0.71和0.52 mg/L时全部死亡; 窒息点由白仔1.70 mg/L降至成鳗0.90 mg/L, 下降47%; 不同生长阶段澳洲鳗鲡在开始死亡、窒息点和全部死亡时溶解氧浓度均存在显著性差异(<0.05), 且白仔>黑仔>幼鳗>成鳗。
2.5 不同生长阶段澳洲鳗鲡的昼夜耗氧率变化
不同生长阶段澳洲鳗鲡的昼夜变化情况如图5所示, 结果表明, 各种生长阶段澳洲鳗鲡在18:00时的耗氧率最高, 分别为白仔(282.76±8.29)、黑仔(259.09±10.27)、幼鳗(204.25±6.37)和成鳗(173.39±10.52) mg/(kg·h); 在14:00时耗氧率最低, 分别为白仔(80.08±7.30)、黑仔(75.67±12.32)、幼鳗(49.78±9.32)和成鳗(34.21±6.81) mg/(kg·h)。按照昼间6:00—18:00, 夜间18:00—次日6:00划分, 白仔昼间耗氧率为(127.14±47.84) mg/(kg·h), 夜间耗氧率为(212.20±27.23) mg/(kg·h), 24 h平均耗氧率为169.68 mg/(kg·h); 黑仔昼间耗氧率为(121.74± 45.66) mg/(kg·h), 夜间耗氧率为(199.01± 21.68) mg/(kg·h), 24 h平均耗氧率为161.01 mg/(kg·h); 幼鳗昼间耗氧率为(94.17±41.71) mg/(kg·h), 夜间耗氧率为(156.96±23.64) mg/(kg·h), 24 h平均耗氧率为125.56 mg/(kg·h); 成鳗昼间耗氧率为(72.46± 32.83) mg/(kg·h), 夜间耗氧率为(109.68± 23.51) mg/(kg·h), 24 h平均耗氧率为91.07 mg/(kg·h); 通过方差分析各种生长阶段澳洲鳗鲡昼间和夜间的耗氧率存在显著性差异(<0.05), 表明不同生长阶段澳洲鳗鲡耗氧率存在明显昼夜节律。通过方差分析各种生长阶段澳洲鳗鲡24 h平均耗氧率, 澳洲鳗鲡白仔和黑仔24 h平均耗氧率无显著性差异, 黑仔与幼鳗和成鳗之间存在显著性差异(<0.05), 且24 h平均耗氧率白仔>黑仔>幼鳗>成鳗。

图4 不同生长阶段澳洲鳗鲡窒息点
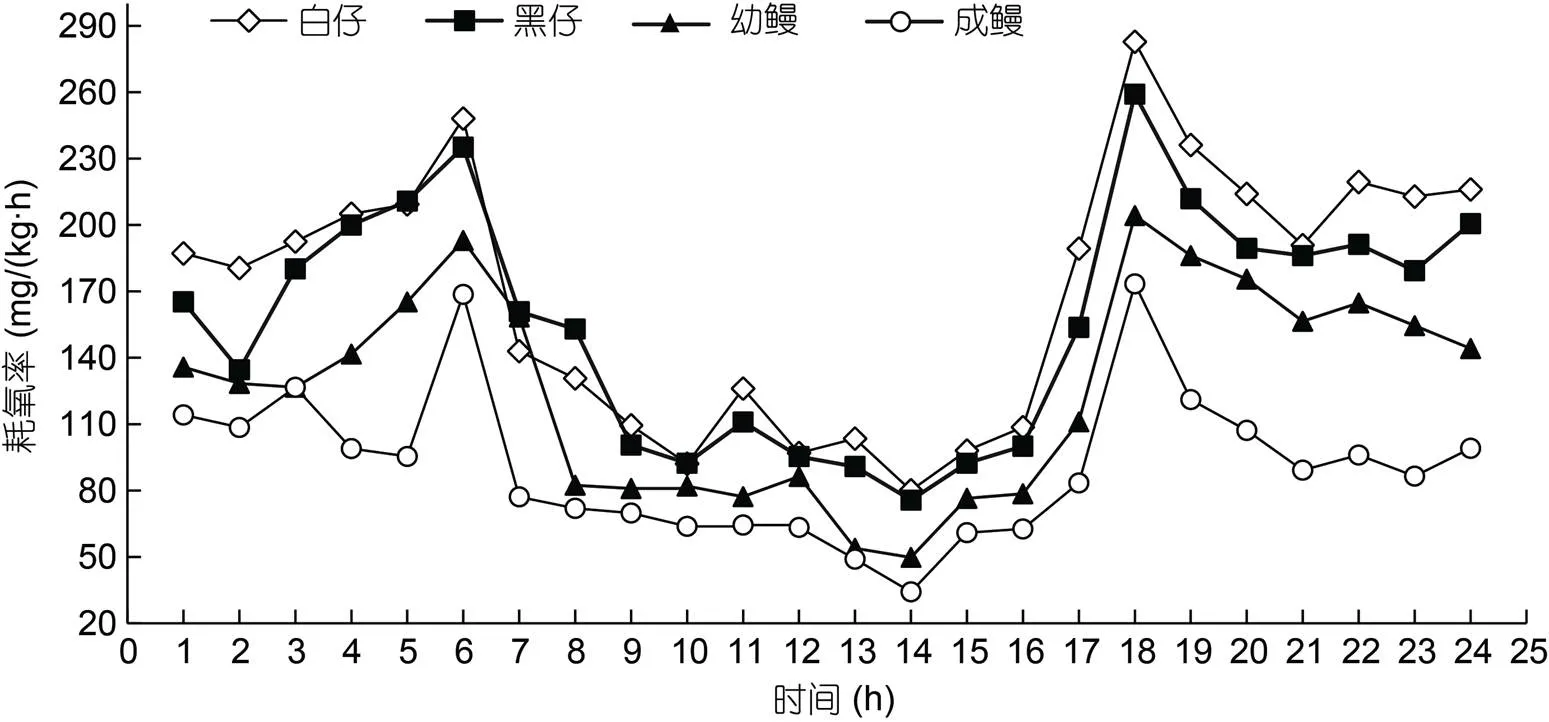
图5 不同生长阶段澳洲鳗鲡的24 h耗氧率变化
2.6 水温对不同生长阶段澳洲鳗鲡耗氧率影响
图6显示水温对不同生长阶段澳洲鳗鲡耗氧率的影响, 结果表明, 随着水温上升, 澳洲鳗鲡的耗氧率不断上升。白仔耗氧率从15 °C的(135.42± 9.41) mg/(kg·h)上升至30 °C的(194.24± 9.94) mg/(kg·h), 上升1.43倍, 黑仔耗氧率从15 °C的(121.58±6.64) mg/(kg·h)上升至30 °C的(185.12± 8.90) mg/(kg·h), 上升1.52倍, 幼鳗耗氧率从15 °C的(57.75±6.69) mg/(kg·h)上升至30 °C的(166.06± 6.17) mg/(kg·h), 上升2.88倍, 成鳗耗氧率从15 °C的(43.46±6.01) mg/(kg·h)上升至30 °C的(144.52± 7.59) mg/(kg·h), 上升3.33倍。通过方差分析表明白仔和黑仔15 °C与20 °C耗氧率无显著性差异(>0.05), 20、25和30 °C耗氧率存在显著性差异(<0.05), 幼鳗和成鳗15、20、25和30 °C耗氧率均存在显著性差异(<0.05); 白仔、黑仔、幼鳗和成鳗的耗氧率和水温回归方程分别为= 0.118 72– 1.273 6+ 126.74 (2= 0.988 8)、= 0.097 82+ 0.003 4+ 98.277 (2= 0.987 4)、= 0.207 52– 1.920 9+ 38.407 (2=0.993 9)和= 0.345 62– 8.948+ 100.92 (2=0.996 5)。
3 分析与讨论
3.1 鳗鲡对水温的耐受性
水温作为鱼类重要主导环境因子之一, 直接影响鱼体生化、生理和行为, 同时刺激鱼类性腺发育, 影响鱼类性别分化, 总的趋势是高温有利于雄性化, 低温则有利于雌性(Beitinger, 2000; 楼允东等, 2008)。鱼类作为变温动物, 水温直接影响鱼类循环系统和呼吸系统, 进而影响鱼类生长发育和能量代谢(龙华, 2005)。在鳗鲡方面, 吴宁等(2010)通过研究五种鳗鲡对水温的耐受性, 结果如表10和表11, 比较发现鳗鲡对高水温耐受性强弱顺序为日本鳗鲡>印尼鳗鲡>菲律宾鳗鲡>美洲鳗鲡>南美洲鳗鲡>本试验澳洲鳗鲡>欧洲鳗鲡; 对低温耐受性本试验仅强于印尼鳗鲡和菲律宾鳗鲡。现阶段研究表明, 鱼类对温度耐受性与生长阶段之间因种类而不同, 姜旭阳等(2019)研究表明虹鳟随体质量增加, 对高温的耐受力下降, 而对低温耐受力增强; Wagner等(2001)和Ospina等(2004)通过研究美洲鲑和几种观赏鱼发现生长阶段与高温耐受性之间无差异。本试验表明: 随着体质量增加, 澳洲鳗鲡对于水温的耐受性增强, 高温开始死亡水温由白仔鳗35 °C提高到商品鳗37 °C, 但39 °C均全部死亡, 低温死亡水温由白仔6.5 °C降至成鳗0 °C; 14—29 °C为澳洲鳗鲡的适温范围, 25—29 °C为白仔和黑仔最适生长温度, 23—29 °C为幼鳗和成鳗最适生长温度。

图6 水温对澳洲鳗鲡耗氧率的影响
表10 不同鳗鲡对高水温耐受性

Tab.10 Tolerance of different species of Anguilla to high water temperature
表11 不同鳗鲡对低水温耐受性

Tab.11 Tolerance of different species of Anguilla to low water temperature
3.2 鳗鲡对非离子氨氮和亚硝酸盐的耐受性
氨氮在水体中主要以非离子氨氮和离子氨氮的形式存在, 两者在水体中可以相互转化, 因具有较高的脂溶性, 能通过鳃和皮肤进入鱼体, 引起鳃表皮细胞损伤, 降低血液的载氧能力(周平, 2013), 严重时破坏鱼体排泄系统和渗透压平衡(王彦波等, 2002), 引起表皮和内脏器官充血。澳洲鳗鲡与其他鳗鲡对非离子氨氮耐受性结果比较如表12, 耐受浓度由大至小排序为, 莫桑比克鳗鲡>南美洲鳗鲡>中美洲鳗鲡>本试验澳洲鳗鲡>欧洲鳗鲡, 澳洲鳗鲡对非离子氨氮耐受性较差可能与其本身耐低氧能力差有关, 导致更容易在非离子氨氮毒性下缺氧死亡; 非离子氨氮SC为黑仔0.80 mg/L>幼鳗0.29 mg/L>成鳗0.26 mg/L>白仔0.24 mg/L。澳洲鳗鲡对非离子氨氮耐受性随体质量增加无规律, 整体对于非离子氨氮的耐受性较差, 所以在生产中应格外注意非离子氨氮浓度, 防止鱼体因中毒而影响经济效益。Thurston等(1981)研究结果表明非离子氨氮对鱼的毒性与水体中溶解氧浓度呈负相关, 溶解氧越高, 鱼体代谢非离子氨氮能力越强; 黑仔之所以耐受性最强, 可能因为鱼体越小, 比表面积越大, 可通过体表进行氧气交换, 导致耐受性增强。
亚硝酸盐主要通过鳃主动吸收亚硝酸盐, 亚硝酸盐氮对鱼类的毒性主要是血液中的亚铁血红蛋白(Fe2+)被氧化成高铁血红蛋白(Fe3+), 从而抑制血液的载氧能力(高明辉等, 2008), 严重时导致鱼类缺氧而窒息死亡(董玉波等, 2011)。现有亚硝酸盐氮耐受性研究报道(表12), 本试验亚硝酸盐氮对澳洲鳗鲡白仔、黑仔、幼鳗和成鳗SC为5.21、6.38、69.19和88.51 mg/L, 仅低于莫桑比克鳗鲡; 随着体质量增加, 澳洲鳗鲡对亚硝酸盐氮的耐受性迅速增强, 幼鳗和成鳗阶段对亚硝酸盐氮的耐受性极高, 因为随着体质量增加, 鱼对亚硝酸盐氮的敏感性逐渐就降低(Sprague, 1985), 同时幼鳗和成鳗耐低氧能力强, 只要体内溶解氧浓度未达到窒息点, 不易因为亚硝酸盐氮阻碍血液载氧能力而导致缺氧死亡, 所以难以受到亚硝酸盐氮危害。低浓度亚硝酸盐氮对大生长阶段澳洲鳗鲡毒性较小, 在自然界和正常养殖过程中一般不会受到亚硝酸盐氮危害。
3.3 鳗鲡窒息点的种间差异和不同生长阶段差异
鱼体窒息死亡时的环境溶氧量, 称为窒息点(point of asphyxiation) (殷名称, 1995)。窒息点和鱼体大小、种类和水体温度等存在相互关系, 同时绝大多数鱼类窒息点随体质量增加而降低(陈松波等, 2004)。杨小东等(2019)研究10、40和160 g南美洲鳗鲡窒息点分别为1.14—1.22、0.83—0.90和0.42—0.51 mg/L。陈健荣(2017)研究花鳗鲡窒息点, 结果表明窒息点随体质量增加而降低, 随着水温升高窒息点升高。周立红等(2012)研究(0.58±0.17) g中美洲鳗鲡窒息点, 结果表明窒息点为0.70 mg/L。王广军等(2001)研究孵出1 d日本鳗鲡窒息点, 在22 °C条件下, (47.46±1.53) mg日本鳗鲡窒息点为1.315 mg/L。本试验澳洲鳗鲡白仔、黑仔、幼鳗和成鳗窒息点为(1.670±0.11)、(1.50±0.06)、(1.24±0.01)和(0.895±0.04) mg/L, 成鳗较白仔窒息点溶解氧浓度下降46.4%; 窒息点高于中美洲鳗鲡、南美洲鳗鲡、日本鳗鲡和花鳗鲡, 说明澳洲鳗鲡对低氧耐受能力较差, 但是随着体质量增加窒息点降低, 耐低氧能力增强。在澳洲鳗鲡养殖和运输中应充分保证溶解氧含量, 防止缺氧导致的病害和死亡。
表12 不同鳗鲡对非离子氨氮和亚硝酸盐氮的耐受性

Tab.12 Tolerance of different species of Anguilla to non-ionic ammonia and nitrite nitrogen
3.4 鳗鲡的昼夜耗氧率变化
耗氧率用来衡量鱼类机体的代谢强度(王刚等, 2011), 鱼类的耗氧率同时受到自身行为(聚集、洄游、索饵、逃避敌害、繁殖), 水流、水温、体质量、昼夜节律等影响(殷名称, 1995)。卢迈新等(1999)研究结果表明日本鳗鲡在相同温度下, 随着体质量增加耗氧率降低, 与本试验中随着体质量的增加, 澳洲鳗鲡的最高耗氧率由白仔(282.76±8.29) mg/(kg·h)降至成鳗(173.39±10.52) mg/(kg·h)、最低耗氧率由白仔(80.08±7.30) mg/(kg·h)降至成鳗(34.21±6.81) mg/(kg·h)和24 h平均耗氧率由白仔169.68 mg/(kg·h)降至成鳗91.07 mg/(kg·h)相符合, 在仔鱼阶段, 体内组织、器官形成和发育比较快, 新陈代谢更加旺盛, 导致鱼对氧的需求量大, 因此耗氧率大(闫杰, 2014)。本研究澳洲鳗鲡在25 °C, 静水状态下的24 h耗氧率, 结果如图5所示, 在6:00和18:00出现峰值, 主要原因是这两个时间点为日常鳗鲡投喂时间, 也是昼夜交替时间, 此时受鱼捕食行为影响, 鱼活动最为频繁; 在两个峰值之后耗氧率出现骤然下降趋势, 因为鱼经过摄食行为和昼夜交替后, 开始出现挂台和正常游动, 导致耗氧率下降; 在14:00时耗氧率最低, 此时鱼代谢和活动最为缓慢, 通过方差分析, 白天与夜间耗氧率存在显著性差异, 与自然界中鳗鱼耗氧率相符合。建议在其养殖日常管理中, 可选择在6:00和18:00进行饲料投喂; 在14:00时进行涉鱼处理操作, 以减少鱼应激反应; 在早上9:00以后进行选别和运输。
3.5 水温对鳗鲡耗氧率的影响
温度作为影响鳗鲡耗氧率的重要因子, 各地鳗苗耗氧率均随水温升高而增高, 唐作鹏等(1996)通过研究中国各河口地区鳗苗耗氧率, 结果表明, 在7—25 °C范围内, 耗氧率与水温呈线性相关, 水温每升高5 °C, 耗氧率增高27.8%, 30 °C以上不适合鳗苗生存。Degani等(1989)通过研究水温对欧洲鳗鲡耗氧的影响, 结果表明水温对仔鳗的影响大于对成鳗, 且温度与耗氧呈正相关。丁益群等(2013)通过测定水温对日本鳗鲡耗氧率影响, 结果表明在不同状态下, 日本鳗鲡耗氧率都随着温度升高而增加。本试验随着水温的上升, 澳洲鳗鲡白仔、黑仔、幼鳗和成鳗的耗氧率与水温呈正相关, 且体质量越大上升比例越高, 白仔从耗氧率从15—30 °C上升1.43倍; 黑仔耗氧率从15—30 °C上升1.52倍; 幼鳗耗氧率从15—30 °C上升2.88倍; 成鳗耗氧率从15—30 °C上升3.33倍。在15—30 °C范围内, 随着澳洲鳗鲡体质量增大, 温度对其耗氧率影响越大, 主要是因为温度升高, 仔鱼内部代谢耗氧率大于成鱼, 但是成鱼的活动耗氧量大于仔鱼; 次要原因是仔鱼15 °C耗氧率基数远大于成鱼耗氧率, 所以增长倍数大于仔鱼。
4 结论
(1) 白仔、黑仔、幼鳗和成鳗的昼间耗氧率随体质量增大而下降, 分别为(127.14±47.84)、(121.74±45.66)、(94.17±41.71)和(72.46±32.83) mg/(kg·h), 夜间耗氧率随体质量增大而下降, 分别为(212.20±27.23)、(199.01±21.68)、(156.96±23.64)和(109.68±23.51) mg/(kg·h), 昼夜间均存在显著差异(<0.05)。
(2) 14—29 °C为澳洲鳗鲡适温范围, 25—29 °C为白仔和黑仔最适生长温度, 23—29 °C为幼鳗和成鳗最适生长温度, 随体质量增加对水温的耐受性增强。
(3) 在水温25 °C, 白仔、黑仔、幼鳗和成鳗的窒息点溶解氧浓度随体质量增大而下降, 分别为(1.69± 0.10)、(1.50±0.05)、(1.24±0.014)和(0.895±0.035) mg/L, 窒息点溶解氧浓度均存在显著性差异(<0.05)。
(4) 水中非离子氨对白仔、黑仔、幼鳗和成鳗的半致死浓度分别为2.35、7.96、2.94和2.62 mg/L, 安全浓度为0.24、0.80、0.29和0.26 mg/L, 黑仔的耐受性最强; 亚硝酸盐对白仔、黑仔、幼鳗和成鳗的半致死浓度分别为52.07、63.80、691.89和885.12 mg/L, 安全浓度为5.21、6.38、69.19和88.51 mg/L, 随体质量增加, 对亚硝酸盐的耐受性增强。
(5) 在15—30 °C范围内, 澳洲鳗鲡耗氧率与水温呈正相关, 白仔、黑仔、幼鳗和成鳗耗氧率和水温回归方程分别为= 0.118 72– 1.273 6+ 126.74 (2= 0.988 8)、= 0.097 82+ 0.003 4+ 98.277 (2= 0.987 4)、= 0.207 52– 1.920 9+ 38.407 (2=0.993 9)和= 0.345 62– 8.948+ 100.92 (2=0.996 5)。
丁益群, 刘小玲, 雷思佳, 2013. 摄食水平和温度对日本鳗鲡耗氧率与ETS活性的影响. 华中农业大学学报, 32(5): 95—99
王 刚, 李加儿, 区又君等, 2011. 环境因子对卵形鲳鲹幼鱼耗氧率和排氨率的影响. 动物学杂志, 46(6): 80—87
王广军, 谢 骏, 潘德博, 2001. 日本鳗鲡初孵仔鱼耗氧率的初步研究. 海洋水产研究, 22(1): 52—55
王彦波, 许梓荣, 邓岳松, 2002. 水产养殖中氨氮和亚硝酸盐氮的危害及治理. 饲料工业, 23(12): 46—48
龙 华, 2005. 温度对鱼类生存的影响. 中山大学学报(自然科学版), 44(S1): 254—257
卢迈新, 肖学铮, 吴锐全等, 1999. 不同生长状况下日本鳗鲡耗氧率的初步测定. 中国水产科学, 6(2): 120—121
闫 杰, 2014. 流速、温度对麦穗鱼耗氧率的影响研究. 南京: 南京农业大学硕士学位论文
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会, 2019. 2019中国渔业统计年鉴. 北京: 中国农业出版社

吴 宁, 李文静, 黎中宝等, 2010. 5种鳗鲡幼鳗极限温度的耐受性初步研究. 南方水产, 6(6): 14—19
陈松波, 陈伟兴, 范兆廷, 2004. 鱼类呼吸代谢研究进展. 水产学杂志, 17(1): 82—89
陈健荣, 2017. 花鳗鲡对低温胁迫和常用渔药的耐受性研究. 上海: 上海海洋大学硕士学位论文
周 平, 2013. 氨氮对水产养殖的危害及防治措施. 中国水产, (8): 63—64
周立红, 关瑞章, 陈学豪, 2012. 中美洲原产地鳗鲡苗种对几种生态因子的耐受性研究. 水生态学杂志, 33(1): 58—64
姜礼燔, 1995. 第三讲鱼药的安全浓度评价方法. 中国医院药学杂志, (6): 27
姜旭阳, 董双林, 刘骋跃等, 2019. 虹鳟和硬头鳟幼鱼对温度的耐受性. 中国海洋大学学报, 49(3): 57—62
殷名称, 1995. 鱼类生态学. 北京: 中国农业出版社
高明辉, 马立保, 葛立安等, 2008. 亚硝酸盐在水生动物体内的吸收机制及蓄积的影响因素. 南方水产, 4(4): 73—79
唐作鹏, 富丽静, 李 勃, 1996. 中国沿海各河口地区鳗苗耗氧率的研究. 大连水产学院学报, 11(2): 51—55
董玉波, 戴媛媛, 2011. 亚硝酸盐氮对水产经济动物毒性影响的研究概况. 水产养殖, 32(4): 28—32
楼允东, 吴 萍, 2008. 温度在水产动物性别控制中的作用. 上海水产大学学报, 17(4): 481—485
翟少伟, 杨 明, 陈学豪, 2019. 我国鳗鱼产业2019年发展趋势与建议. 当代水产, 44(2): 98—99
樊海平, 林 煜, 钟全福等, 2008. 莫桑比克鳗鲡养殖生物学主要特性研究. 福建水产, (4): 7—12
樊海平, 潘小玲, 陈百悦等, 1997. 非离子态氨对美洲鳗鲡()的急性毒性试验. 福建水产, (1): 19—21
潘小玲, 陈百悦, 樊海平, 1998. 非离子态氨及亚硝酸盐对欧洲鳗鲡的急性毒性试验. 水产科技情报, 25(1): 20—23
Beitinger T L, Bennett W A, McCauley R W, 2000. Temperature tolerances of North American freshwater fishes exposed to dynamic changes in temperature. Environmental Biology of Fishes, 58(3): 237—275
Degani G, Gallagher M L, Meltzer A, 1989. The influence of body size and temperature on oxygen consumption of the European eel,. Journal of Fish Biology, 34(1): 19—24
Forster M E, 1981. Oxygen consumption and apnoea in the shortfin eel,. New Zealand Journal of Marine and Freshwater Research, 15(1): 85—90
Ospina A F, Mora C, 2004. Effect of body size on reef fish tolerance to extreme low and high temperatures. Environmental Biology of Fishes, 70(4): 339—343
Shiao J C, Tzeng W N, Collins A, 2002. Role of marine larval duration and growth rate of glass eels in determining the distribution ofandon Australian eastern coasts. Marine and Freshwater Research, 53(3): 687—695
Sprague J B, 1985. Factors that modify toxicity. In: Rand G M, Petrocelli S R eds. Fundamentals of Aquatic Toxicology: Methods and Applications. Washington: Hemisphere Publishing, 124—163
Thurston R V, Russo R C, Vinogradov G A, 1981. Ammonia toxicity to fishes. Effect of pH on the toxicity of the unionized ammonia species. Environmental Science & Technology, 15(7): 837—840
Wagner E J, Arndt R E, Brough M, 2001. Comparative tolerance of four stocks of cutthroat trout to extremes in temperature, salinity, and hypoxia. Western North American Naturalist, 61(4): 434—444
BIOLOGICAL TOLERANCE CHARACTERISTICS AND EVOLUTION TREND OFAT DIFFERENT GROWTH STAGES
WEI Jin-Sheng1, 2, JIANG Xing-Long1, 2, WANG Ze-Xu1, 2, LI Kai1, 2
(1. Fisheries College, Jimei University, Xiamen 361021, China; 2. Engineering Research Center of the Modern Technology for Eel Industry, Ministry of Education, Xiamen 361021, China)
Experiments were conducted to understand the oxygen consumption rate and asphyxiation in tolerance to water temperature, non-ionic ammonia, and nitrite byat different growth stages from glass eel, fingerling eel, juvenile eel, and yellow eel. The oxygen consumption rates of the eels of different growth stages were measured, and it was found increased in daytime but decreased in nighttime with the increase of individual body mass, showing significant differences in between (<0.05). At 15—30 °C, oxygen consumption rate was positively correlated with water temperature, based on which equations by regressions were established for the eels of different ages. At 25 °C, the concentration of dissolved oxygen at the asphyxiation point decreased with the increase of age in terms of individual body mass. The suitable temperature range forgrowth was 14—29 °C. Specifically, 25—29 °C was the optimal growth temperature for the glass eel and fingerling eel, and 23—29°C was the optimal growth temperature for juvenile eel and yellow eel. With the increase of individual body mass, the thermal tolerance ofincreased. The LC50of non-ionic ammonia in water for glass eel, fingerling eel, juvenile eel, and yellow eel was 2.35, 7.96, 2.94, and 2.62 mg/L, while the SC (safety concentration) was 0.24, 0.80, 0.29, and 0.26 mg/L, respectively, indicating that the fingerling eel was most tolerant. The LC50of nitrite for glass eel, fingerling eel, juvenile eel, and yellow eel was 52.07, 63.80, 691.89, and 885.12 mg/L, while the SC was 5.21, 6.38, 69.19, and 88.51 mg/L, respectively, showing that the older the eel, the more tolerant to the stress, and the tolerance of nitrite concentration increased with the increase of individual weight.
; oxygen consumption rate; asphyxiation point; non-ionic ammonia; nitrite
* 国家重点研发计划“池塘尾水生态治理技术及工程设施研发”, 2019YFD0900302号; 国家重点研发计划“特色鱼类精准高效养殖关键技术集成与示范”, 2020YFD0900102号; 福建省科技厅高校产学研合作项目“鳗鲡养殖尾水处理与循环利用一体化系统研发与示范”, 2020N5009号; 鳗鲡现代产业技术教育部工程研究中心开放基金, RE202012号。魏金生, 硕士研究生, E-mail: 1165665102@qq.com
江兴龙, 博士, 教授, E-mail: xinlongjiang@jmu.edu.cn
2021-01-16,
2021-03-15
Q174; S965
10.11693/hyhz20210100015

