前S1抗原、乙型肝炎病毒的脱氧核糖核酸及乙型肝炎五项检验对乙型肝炎患者肝纤维化的诊断价值
程涵芬
汉川市中医院检验科 (湖北汉川 431600)
肝纤维化(Hepaticfibrosis,HF)是乙型肝炎(Chronic Hepatitis B,CHB)向肝硬化发展的必经阶段,是一个发展变化的病理过程,故早期准确诊断乙型肝炎患者HF发生情况,并及时进行针对性治疗,对抑制病情进展尤为关键。肝组织病理学活检是诊断HF的金标准,但其属于有创性操作,临床应用具有局限性,因而需寻求准确、高效、无创的诊断方案。有研究表明,乙型肝炎五项能有效判定乙型肝炎病毒(hepatitis B virus,HBV)的感染情况,有效诊断乙型肝炎[1];乙型肝炎病毒的脱氧核糖核酸(hepatitis B virus-deoxyribonucleic acid,HBV-DNA)可定量反映病毒复制及繁殖情况,有效反映乙型肝炎疾病进展;前S1抗原是HBV外膜蛋白的主要成分,可影响病毒的感染及复制繁殖,反映乙型肝炎疾病进展情况[2]。鉴于乙型肝炎五项、HBV-DNA、前S1抗原与乙型肝炎疾病发生及进展的关系,推测乙型肝炎五项、HBV-DNA、前S1抗原或可诊断乙型肝炎患者HF情况。基于此,本研究旨在探讨前S1抗原和HBV-DNA及乙型肝炎五项检验对乙型肝炎患者HF的诊断价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年12月至2020年1月我院收治的110例乙型肝炎患者作为研究对象。其中男65例,女45例;年龄35~75岁,平均(50.66±5.32)岁;乙型肝炎病程5~15年,平均 (8.50±1.50)年;体质量50~70 kg,平均(60.95±2.34)kg。本研究经医院医学伦理委员会审核批准。纳入标准:符合《慢性乙型肝炎防治指南(2015年更新版)》[3]中对乙型肝炎的诊断标准;患者签署研究知情同意书且配合研究;心、肺、肾功能正常。排除标准:其他类型肝炎病毒感染;免疫功能异常;其他感染性疾病。
1.2 方法
1.2.1 血清样本获取
所有患者均在入院后抽取其空腹肘部静脉血4~5 ml,置于含有枸橼酸钠的真空抗凝管1∶9进行抗凝处理,使用上海利鑫坚离心机有限公司提供的H-1600R型高速冷冻离心机,以3 200 r/min的速度离心处理10 min,分离出上层血清待检。
1.2.2 乙型肝炎五项检查
选择美国雅培公司生产的试剂盒,采用化学发光法测定乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)、乙型肝炎表面抗体(hepatitis B surface antibody,HBsAb)、乙型肝炎e抗原(hepatitis B e antigen,HBeAg)、乙型肝炎e抗体(hepatitis B virus e antibody,HBeAb)、乙型肝炎核心抗体(hepatitis B core antibody,HBcAb)水平。正常范围,HBsAg为0~0.05 IU/ml,HBsAb为0~10 mIU/ml,HBeAg为0~0.5 PEIU/ml,HBeAb为0~0.2 PEIU/ml,HBcAb为0~0.9 PEIU/ml。
1.2.3 HBV-DNA检查
使用上海市科华生物技术有限公司提供的试剂盒及美国Pekin Elemer公司提供的GeneAmp 5700定量检测仪,以荧光定量聚合酶链式反应(polymerase chain reaction,PCR)法严格按照说明书操作测定HBV-DNA水平,正常范围为<1 000 IU/ml。
1.2.4 前S1抗原检测
使用上海阿尔法生物技术有限公司提供的试剂盒及雷杜RT-6000酶标仪,以免疫双抗夹心法测定前S1抗原水平。
1.2.5 肝组织病理学活检
在完成上述检查后,实施肝组织病理学活检,连续切片获取组织检查标本,常规苏木精-伊红、网状纤维染色后依据ISHAK组织学评分[3]判定HF程度,S0期无纤维;S1期汇管区纤维化扩大,局限于窦周及小叶内纤维化;S2期汇管区周围纤维化,纤维间隔形成,小叶结构保留;S3期有纤维间隔伴小叶结构紊乱,无肝硬化;S4期有早期肝硬化。
1.3 评价指标
以肝组织病理学活检结果作为金标准,分析前S1抗原和HBV-DNA及乙型肝炎五项检验对乙型肝炎患者HF的诊断价值。
1.4 统计学处理
采用SPSS24.0统计软件进行数据处理,采用Shapiro-Wilk进行正态性检验,符合正态分布的计量资料以±s表示,组间数据比较采用独立样本t检验,计数资料以率表示,采用χ2检验,绘制ROC曲线并计算曲线下面积(area under curve,AUC),AUC>0.90表示诊断性能较高,0.71~0.90表示有一定的诊断性,0.50~0.70表示诊断性能较差,<0.5表示无诊断价值,P<0.05为差异有统计学意义。
2 结果
2.1 肝组织病理学活检结果
经肝组织病理学活检确诊,110例乙型肝炎患者中的未发生HF 35例,占31.82%,设为未发生组;发生HF 75例,占68.18%,设为发生组。
2.2 两组乙型肝炎五项、HBV-DNA、前S1抗原情况比较
发生组HBsAg、HBeAg、HBcAb、HBV-DNA、前S1抗原水平均高于未发生组,差异有统计学意义 (P<0.05);两组HBsAb及HBeAb水平比较,差异均无统计学意义(P>0.05),见表1。
表1 两组乙型肝炎五项、HBV-DNA、前S1抗原情况比较(±s)
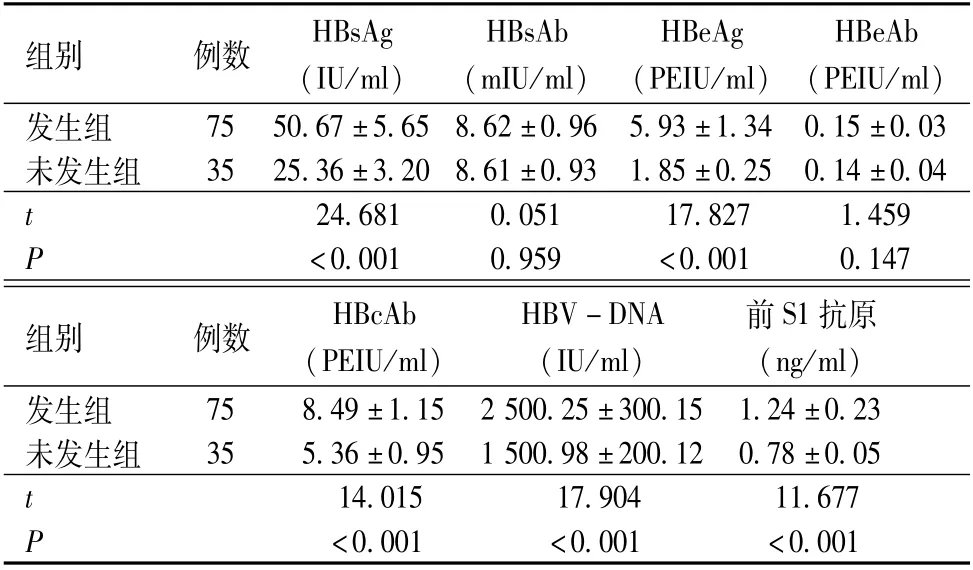
表1 两组乙型肝炎五项、HBV-DNA、前S1抗原情况比较(±s)
注:HBsAg为乙型肝炎表面抗原,HBsAb为乙型肝炎表面抗体,HBeAg为乙型肝炎e抗原,HBeAb为乙型肝炎e抗体,HBcAb为乙型肝炎核心抗体,HBV-DNA为乙型肝炎病毒的脱氧核糖核酸
组别例数HBsAg(IU/ml)HBsAb(mIU/ml)HBeAg(PEIU/ml)HBeAb(PEIU/ml )75 50.67±5.65 8.62±0.96 5.93±1.34 0.15±0.03未发生组35 25.36±3.20 8.61±0.93 1.85±0.25 0.14±0.04 t发生组24.681 0.051 17.827 1.459 P <0.001 0.959<0.001 0.147组别例数HBcAb(PEIU/ml)HBV-DNA(IU/ml)前S1抗原(ng/ml )75 8.49±1.15 2 500.25±300.15 1.24±0.23未发生组35 5.36±0.95 1 500.98±200.12 0.78±0.05 t发生组14.015 17.904 11.677 P <0.001<0.001<0.001
2.3 HBsAg、HBeAg、HBcAb、HBV-DNA、前S1抗原单独及联合诊断乙型肝炎患者HF的效能分析
将乙型肝炎患者HBsAg、HBeAg、HBcAb、HBV-DNA、前S1抗原水平作为检验变量,HF发生情况作为状态变量(1=发生,0=未发生),绘制ROC曲线图(图1),结果显示,HBsAg、HBeAg、HBcAb、HBV-DNA、前S1抗原单独及联合诊断乙型肝炎患者HF的AUC均>0.7,具有一定诊断价值,其中联合诊断效能最好,见表2。
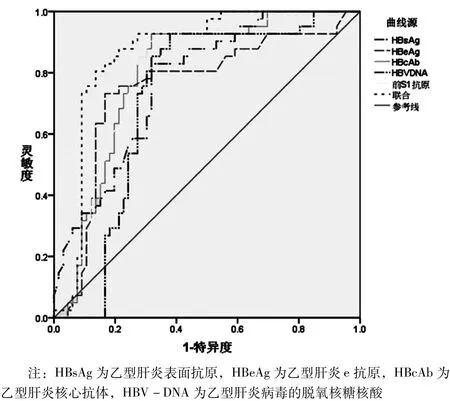
图1 HBsAg、HBeAg、HBcAb、HBV-DNA、前S1抗原单独及联合诊断乙型肝炎患者HF的ROC图
3 讨论
乙型肝炎病情迁移难愈,各种致病因子会破坏患者肝脏内细胞外基质合成与降解的稳态平衡,当细胞外基质大量形成并沉积在肝脏内后会引起HF。HF持续进展会导致正常肝实质细胞坏死和凋亡,使得肝实质逐步被细胞外基质形成的瘢痕组织取代,最终进展为肝硬化、肝癌甚至是肝衰竭,增加患者的病死率。因此,及早明确乙型肝炎患者HF发生情况,及早实施抗纤维化治疗意义重大。
有研究表明,HF的本质是慢性肝病过程中可逆的肝组织损伤后机体整体参与的修复反应,与HBV感染、复制及繁殖情况密切相关[4]。乙型肝炎五项是临床诊断乙型肝炎的重要手段,可有效反映HBV的感染情况[5];HBV-DNA是反映HBV复制及活动状态的敏感指标[6];前S1蛋白是反映体内HBV复制繁殖能力、传染性强弱的重要指标[7]。因此,临床或可通过前S1抗原、HBV-DNA及乙型肝炎五项检查来辅助诊断乙型肝炎患者HF发生情况。本研究结果显示,发生组HBsAg、HBeAg、HBcAb、HBV-DNA、前S1抗原水平均高于未发生组,提示可利用HBsAg、HBeAg、HBcAb、HBV-DNA、前S1抗原等指标辅助诊断乙型肝炎患者HF发生情况。分析其原因为,HBsAg是乙型肝炎病毒最外层包膜中的一种外壳蛋白,可以刺激体内产生抗体,是感染HBV特异性标志物;HBeAg来自病毒核心,是由基因组表达的蛋白加工后分泌到细胞外,HBeAg存在提示HBV在体内高度活跃;HBcAb是机体感染HBV后在血液中最早出现的特异性抗体。伴随着HBsAg、HBeAg、HBcAb的不断升高,乙型肝炎病情可不断进展,进而不断损伤肝组织正常生理功能并引起肝组织结构的异常改变,肝组织可出现过度修复反应,增加HF发生风险。HBV-DNA是病毒的遗传物质,可定量反映病毒复制情况,其水平升高提示病毒处于不断复制及异常活跃状态,可不断损伤肝组织功能与结构,增加HF发生率。HBV主要通过黏附在前S1蛋白内的肝细胞膜受体上进入肝细胞,前S1蛋白水平升高提示HBV复制繁殖能力增强,可加剧肝功能受损程度,增加HF发生风险[8]。本研究运用ROC进一步深入探讨发现,HBsAg、HBeAg、HBcAb、HBV-DNA、前S1抗原联合诊断乙型肝炎患者HF的效能最好,提示临床可利用HBsAg、HBeAg、HBcAb、HBV-DNA、前S1抗原来诊断乙型肝炎患者HF发生情况。通过联合诊断可以全面反映HBV感染、复制及繁殖情况,可弥补单项诊断的不足,更加全面地对乙型肝炎患者HF进行评估,提高诊断价值。

表2 HBsAg、HBeAg、HBcAb、HBV-DNA、前S1抗原单独及联合诊断乙型肝炎患者HF的效能分析
综上所述,前S1抗原、HBV-DNA及乙型肝炎五项诊断乙型肝炎患者HF均有较高的价值,且联合诊断的价值更高。

