百香果贮藏过程中香气成分及其相关酶活性的变化特征
辛明 李昌宝 孙宇 盛金凤 唐雅园 孙健 李杰民 李丽 何雪梅 零东宁


摘 要:為阐明采后百香果香气品质的变化特征,本研究采用顶空-固相微萃取(HS-SPME)结合气相色谱-质谱联用技术(GC-MS),研究了常温(25 ℃)、低温(6 ℃)贮藏期间百香果香气物质主要成分及其含量,酯类化合物代谢关键酶脂氧合酶(LOX)、醇酰基转移酶(AAT)、乙醇脱氢酶(ADH)和氢过氧化物裂解酶(HPL)活性的变化规律。结果表明:百香果在常温和低温贮藏期间,果汁中的香气物质均以酯类为主,相对含量分别占总香气物质的40.00%~60.32%和54.95%~69.27%,其次是醇类和酮类;进一步通过结构鉴定,在酯类物质中相对含量较高的化合物为丁酸乙酯、正己酸乙酯、丁酸己酯、乙酸乙酯、己酸己酯;常温下,百香果酯类物质相对含量在贮藏4 d时出现峰值(60.32%)、贮藏12 d时下降为40.00%,而低温下,其相对含量延至贮藏20 d时出现峰值(69.27%),整个贮藏期内保持在54.62%~69.27%,表明低温贮藏可以维持酯类物质较高的相对含量。对百香果酯类代谢途径关键酶活性分析发现,果汁中LOX、AAT和HPL在低温贮藏前期(0~10 d)活性变化不大,贮藏后期表现活跃,最高值出现时间迟于常温贮藏,表明低温可以有效抑制酯类代谢关键酶活性;另外,酯类香气化合物相对含量与LOX、AAT、ADH、HPL活性具有较强相关性。本研究为百香果采后品质保持和保鲜技术提供了参考依据。
关键词:百香果;香气成分;酯类;酶活性;相关性分析
中图分类号:TS255.3 文献标识码:A
Abstract: To clarify the variation characteristics of aroma quality in postharvest passion fruit, headspace-solid phase microextraction (HS-SPME) combined with gas chromatography-mass spectrometry (GC-MS) was used to determinethe main components and the contents in the fruit volatiles during storage at ambient temperature (25 ℃) and low tem-perature (6 ℃). The present study further analyzed the activity variation rule of key enzymes in ester metabolism pathway, such as lipoxygenase (LOX), alcohol acyltransferase (AAT), alcohol dehydrogenase (ADH) and hydroperoxide lyase (HPL). The results showed that the main aroma components in passion fruit juice were esters during storage at ambient and low temperatures, and their relative contents accounted for 40.00%-60.32% and 54.95%-69.27%, followed by alcohols and ketones. Furthermore, the main ester components with high relative contents were identified as ethyl butanoate, ethyl n-hexanoate, hexyl butyrate, ethyl acetate and hexyl hexanoate. During storage at ambient temperature, the relative content of esters in passion fruit peaked on 4th day (60.32%) and decreased to 40.00% on 12th day. However, this relative content peak appeared on 20th day (69.27%) and remained 54.62%-69.27% within the whole storage period at low temperature. Above results indicated that high relative content of esters could be maintained by low temperature storage. The analyses on key enzymatic activities in ester metabolism pathway showed that little variation of LOX, AAT and HPL activities appeared in passion fruit juice during early storage period (0-10 d) at low temperature. The enzymes were active during late storage period. The activity peaks appeared later than those at ambient temperature storage, indicating that low temperature could effectively inhibit the activities of key enzymes in ester metabolism pathway. In addition, the relative contents of ester components were strongly correlated with the activities of LOX, AAT, ADH and HPL. This study would provide reference for quality maintenance and postharvest preservation of passion fruit.
Keywords: passion fruit (Passiflora caerulea L.); aroma components; esters; enzyme activity; correlation analysis
DOI: 10.3969/j.issn.1000-2561.2021.05.037
百香果為西番莲科(Passiflora caerulea L.)西番莲属(Passiflora)多年生常绿藤本植物,是热带亚热带地区特有水果[1-2]。我国主要分布在广西、福建、海南、广东、云南、台湾等地[3],其中,广西、福建百香果产业发展较快,2017年两省栽培面积分别达14 000、6 700 hm2[4-5]。百香果香气成分丰富,因含有草莓、芒果、苹果、番石榴、香蕉、菠萝等多种水果的香气而得名,有“果汁之王”和“香料水果”之美誉[6]。浓郁怡人的香气是百香果风靡市场、备受消费者青睐的重要因素之一。
百香果香气的特殊性引起越来越多研究者的兴趣。Macoris等[7]在百香果果肉中分离检测到77种化合物,其中以丁酸甲酯、乙酸丁酯、己醛、丁酸丁酯、反式-3-己烯乙酸酯、顺式-3-己烯-1-醇、己酸丁酯、丁酸己酯等酯类为主要挥发性化合物。Porto-Figueira等[8]发现酯类为9种百香果鲜果挥发性物质中最主要成分,品种间挥发性化合物图谱存在差异。Janzantti等[9]采用动态顶空套袋采样技术对百香果鲜果汁进行前处理,共分离鉴定出64种挥发性香气化合物。潘葳等[10]鉴定出5个品种百香果鲜果汁中共含有68种香气成分,其中酯类含量最高,其次为醇类、酮类、萜烯类、烷类、醚类和杂环类。近年来关于水果香气代谢途径的研究主要集中在酶与果实香气物质形成关系上,百香果主要香气成分为酯类化合物(66.68%~91.92%)[10-11],酯类代谢途径中的关键酶脂氧合酶(lipoxygenase,LOX)、醇酰基转移酶(alcohol acyltransferase,AAT)、乙醇脱氢酶(alcohol dehydrogenase,ADH)、氢过氧化物裂解酶(hydroperoxide lyse,HPL)等已成为研究热点[12-14]。LOX是脂肪酸代谢途径初始过程中重要的限速酶,可将脂肪酸转化为氢过氧化物,参与以脂肪酸为前体的直链酯的合成,催化亚油酸、亚麻酸产生C6、C9化合物[15]。AAT是参与酯类香气合成途径中的最终限速酶,它可以催化醇类底物与酰基辅酶A酯化为相应的酯类物质,从而生成果实酯类香气成分中的特征香气[16]。ADH是醇类物质合成的关键酶,存在于醛和醇之间的内在转换中,使醛先转化为酸或醇后才能再转化为酯类化合物,其为酯类化合物的合成提供前体[17]。HPL是脂肪氧化途径中LOX下游的酶,以LOX的氧化产物为底物,脂氢过氧化物在HPL的催化作用下发生裂解反应生成短链醛和含氧酸[18]。
前人多以百香果鲜果为对象开展香气成分研究,但在不同贮藏条件下,百香果香气物质种类组成与含量都会随贮藏时间的延长发生很大变化。截至目前,针对百香果采后贮藏过程中香气成分及其相关酶的变化特征鲜有报道。百香果采后贮藏期间香气成分变化不但是衡量其货架寿命的重要指标之一,也是评价百香果产品品质差异与市场定价的一个重要因素。本文采用顶空-固相微萃取(HS-SPME)结合气相色谱-质谱联用(GC-MS)技术分析百香果果汁香气物质及其代谢关键酶活性,以期揭示贮藏过程中香气品质的变化规律,为百香果采后保鲜与品质保持技术开发提供参考依据。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 百香果(Passiflora caerulea L.)品种为‘台农1号,2018年10月采自广西南宁市邕宁区,选7~8成熟(花后55~60 d)果实,采收后立刻运回实验室。
乙酸、乙酸钠、硼酸、盐酸、氯化镁、丁醇、碳酸氢钠、聚乙烯吡咯烷酮(PVPP)、二硫苏糖醇(DTT)、乙二胺四乙酸(EDTA)、甘油、苯甲基磺酰氟蛋白酶抑制剂(PMSF)、山梨醇、三羟甲基氨基甲烧(Tris),国药集团化学试剂有限公司;5,5-二硫代双硝基苯甲酸(DTNB)、2-(N-吗啡啉)乙磺酸(MES)、还原型辅酶(NADH)、二硫苏糖醇(DTT)、羟乙基哌嗪乙硫磺酸(HEPES),上海源叶生物有限公司;亚油酸钠、乙酰辅酶A,酷尔化学科技有限公司。上述试剂均为分析纯。
1.1.2 仪器与设备 SPME装置手柄、固定搭载装置、双极性50/30 ?m二乙烯基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydi- methylsiloxane,DVB/CAR/PDMS)萃取头,美国Supelco公司;Agilent 7890A-5975C气相色谱-质谱联用仪,美国Agilent公司;D-37520型高速冷冻离心机,德国赛默飞世尔有限公司;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;离子PTP-IV-30型实验室超纯水机,广州品业仪器设备有限公司。
1.2 方法
1.2.1 材料预处理及取样 挑选无机械伤、果形端正、无病虫斑、大小及成熟度一致的果实。用浓度为500 mg/L的次氯酸钠溶液浸泡果实1 min,取出晾干后,在(25±1)℃及(6±1)℃下进行贮藏试验,每2 d取样一次。取果囊果汁、匀浆、过滤,经充分混匀后迅速进行香气成分测定,样品贮存于–80 ℃中待测,每个样品3组平行。
1.2.2 百香果香气成分的测定 参考郭艳峰[11]方法,略有改动。双极性DVB/CAR/PDMS(50/30 ?m)固相微萃取头置于GC-MS仪进样口进行老化处理,老化温度250 ℃,老化时间60 min。取搅匀的百香果汁5 g于20 mL萃取瓶中,将老化好的萃取头插入样品瓶顶空部分,于40 ℃吸附30 min,吸附后的萃取头取出,插入GC-MS进样口。GC-MS分析条件:DB-WAX MS 毛细管柱(30 m× 0.25 mm×0.25 μm),He 流量为1 mL/min,不分流进样,进样口温度为250 ℃;升温程序为40 ℃保持3 min,然后以8 ℃/min线性升温至90 ℃,10 ℃/ min线性升温至230 ℃,在此温度下保持7 min;离子化方式为电子轰击电离(EI),离子源温度230 ℃,电子能量80 eV,接口温度280 ℃;全扫描方式,扫描质量范围35~350 u;对照NIST 2014谱库进行数据分析,采用峰面积归一化法确定相对含量。
1.2.3 酯类代谢途径关键酶活性测定 (1)LOX活性测定。参考曹建康等[19]方法,略有改动。称取5 g百香果汁,加入10 mL 0.1 mol/L磷酸緩冲液(pH 6.8),在研钵内冰浴研磨成匀浆,于4 ℃12 000 r/min离心30 min,收集上清液用于酶活性测定。将总体积为2.8 mL的反应液[2.775 mL 0.1 mol/L乙酸-乙酸钠缓冲液(pH 5.5)、25 μL 10 mmol/L亚油酸钠溶液]在30 ℃保温3 min,与200 μL粗酶液混匀,以蒸馏水为参比调零,于234 nm处测定吸光度值,反应15 s后开始记录为初始值,然后每隔30 s记录一次,结果以比活性表示(mU/mg)。
(2)AAT活性测定。取3 g百香果汁,加入6 mL经4 ℃预冷的0.1 mol/L磷酸缓冲液(pH 7)和0.1 g PVPP,在研钵内冰浴研磨成匀浆,于4 ℃。10 000 r/min离心30 min,收集上清液用于酶活性测定。反应液由2.5 mL MgCl2溶液(0.5 mol/L pH 8 Tris-HCl缓冲液中含5 mmol/L MgCl2)、150 μL乙酰辅酶A溶液(0.5 mol/L pH 8 Tris-HCl缓冲液中含5 mmol/L乙酰辅酶A)、50 μL丁醇溶液(0.5 mol/L pH 8 Tris-HCl缓冲液中含200 mmol/L丁醇)组成。将反应液与150 μL酶提取液混合后在35 ℃下水浴15 min,加入10 mmol/L 5,5-二硫代双硝基苯甲酸(DTNB)100 μL。室温下放置10 min后,于412 nm处测定吸光度值,用不含酶提取液的反应液为空白。一个酶活力单位(U)以1 min吸光度升高值计算,结果以比活性表示(mU/mg)[20]。
(3)ADH活性测定。取5 g百香果汁,加入10 mL经4 ℃预冷的提取缓冲液[0.1 mol/L MES- Tris缓冲液(pH 6.5)、2 mmol/L DTT、1% PVP],在研钵内冰浴研磨成匀浆,于4 ℃、10 000 r/min离心30 min,收集上清液用于酶活性测定。反应液由2.4 mL MES-Tris缓冲液(pH 6.5)、0.15 mL l.6 mmol/L NADH和0.15 mL 80 mmol/L乙醛组成。将反应液与300 μL酶提取液在30 ℃下混合后,于340 nm测定ADH活性。一个酶活力单位(U)以1 min吸光度升高值计算,结果以比活性表示(mU/mg)[21]。
(4)HPL活性测定。取1 g百香果汁,加入4 mL经4 ℃预冷的提取液[150 mmol/L HEPES- KOH缓冲液(pH 8)、250 mmol/L山梨醇、10 mmol/L EDTA、10 mmol/L MgCl2、l%甘油、4% PVPP和0.1 mmol/L PMSF],在研钵内冰浴研磨成匀浆,于4 ℃ 10 000 r/min离心30 min,收集上清液用于酶活性测定。反应液由2 mL缓冲液[150 mmol/L HEPES-KOH(pH 8)、250 mmol/L山梨醇、10 mmol/L EDTA和10 mmol/L MgCl2]、0.75 mL 10 mmol/L亚油酸钠溶液、0.15 mL 1.6 mmol/L NADH、0.1 m ADH酶液、[0.5 mg/mL硼酸缓冲液(pH 8.6)]组成。将反应液与500 μL酶提取液在30 ℃下混合后,于340 nm测定HPL活性。一个酶活力单位(U)以1 min吸光度升高值计算,结果以比活性表示(mU/mg)[21]。
1.3 数据分析
所有实验均重复3次以上,数据结果表示为平均值±标准差;使用SPSS 19.0软件进行统计分析,利用邓肯(Duncan)多重比较法进行差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 不同温度贮藏过程中百香果香气成分的动态分析
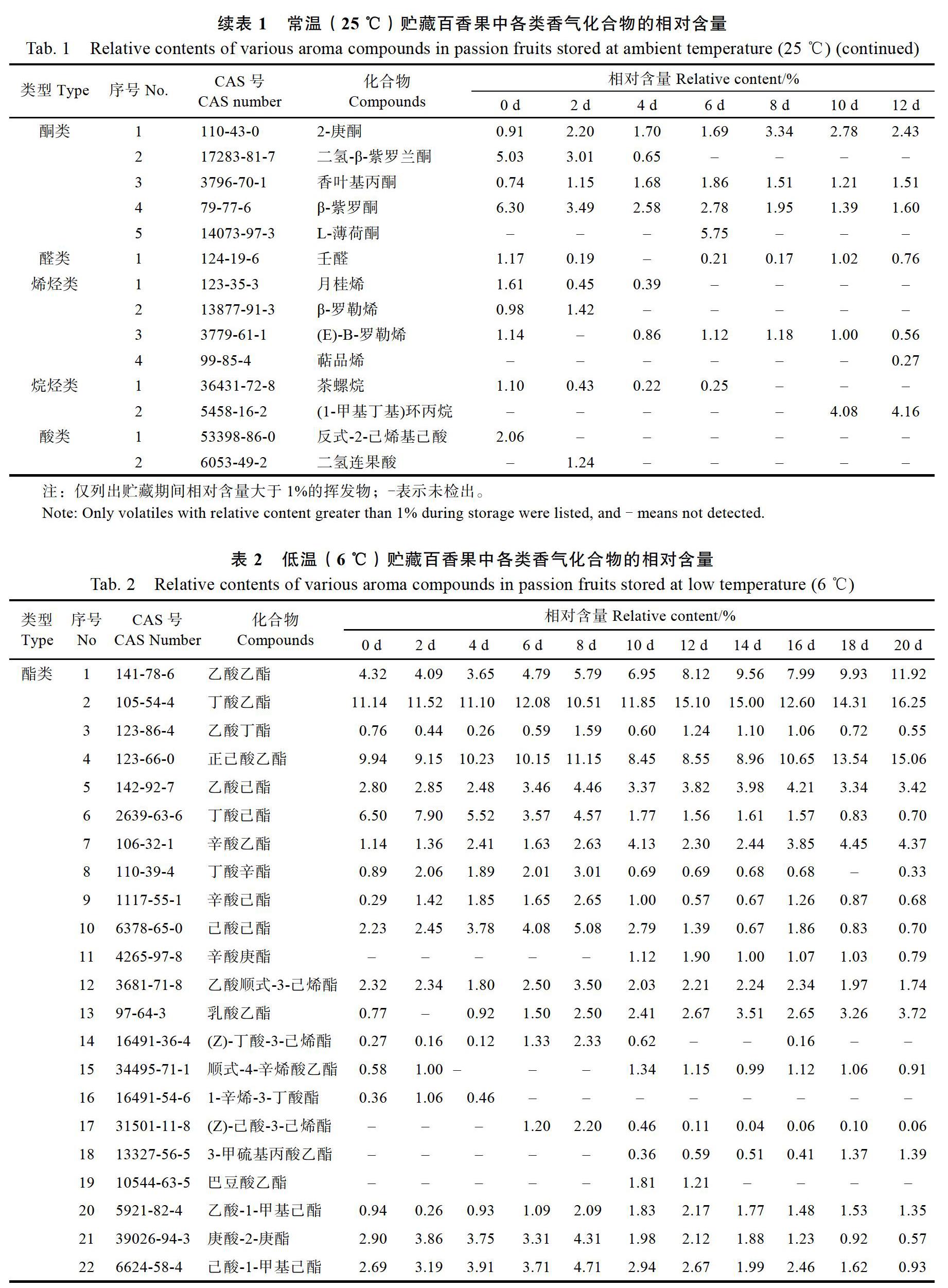
果实香气物质形成是一个动态过程,是多种挥发性组分共同作用的结果。由图1可知,不同温度贮藏过程中百香果香气物质的相对含量和种类组成明显变化,酯类、醇类、酮类、醛类、烯烃类、烷烃类、酸类这7类香气成分在不同温度贮藏条件下均存在差异。常温贮藏前期和中期(0~8 d)酯类占总香气物质的50.75%~60.32%;贮藏后期(10~12 d)酯类相对含量逐渐减少,而醇类相对含量逐渐增加,在贮藏12 d时酯类和醇类的相对含量分别为40.00%和24.74%、种类组成分别为28种和21种;此外,酮类、醛类、烯烃类、烷烃类、酸类及其他类成分的相对含量分别为7.31%~ 14.47%、0%~1.17%、1.82%~5.85%、0.08%~4.98%、0.77%~2.69%、0%~0.73%。低温贮藏0~20 d,酯类占总香气物质的54.62%~节69.27%,其次为醇类(8.52%~14.13%)、酮类(6.78%~14.47%),而醛烃类(0.18%~1.34%)、烯烃类(1.03%~5.85%)、烷烃类(0.44%~5.06%)、酸类(0%~3.26%)及其他类(0.21%~1.42%)成分相对含量较少。以上说明在不同贮藏温度下,百香果香气物质均以酯类为主,其次是醇类、酮类,而醛类、酸类、烯烃类、烷烃类及其他类成分的相对含量较少。
酯类具有果香型的感官特征,是果实中重要的特征芳香物质[22],由脂质氧化产生的游离脂肪酸与醇之间相互作用生成[23]。由图1A、表1可知,常温贮藏期间,百香果酯类物质相对含量呈先上升后下降趋势,在4 d时达最高值60.32%、种类33种,但在12 d时下降为40.00%、种类28种;进一步结构鉴定发现,在酯类物质中相对含量较高的化合物是丁酸乙酯(10.30%~12.33%)、正己酸乙酯(1.18%~9.94%)、丁酸己酯(0.15%~8.71%)、乙酸乙酯(2.99%~6.26%)、己酸己酯(0.09%~ 4.56%),其中正己酸乙酯、丁酸己酯、己酸己酯相对含量变化较大,贮藏中后期快速下降。由图1A、表2可知,低温贮藏期间,酯类物质相对含量逐渐上升、种类数先上升后下降,整个贮藏期内相对含量保持在54.62%~69.27%、20 d时达最高值69.27%,在10 d时种类数达最高值37种;在酯类物质中相对含量较高的化合物是丁酸乙酯(10.51%~16.25%)、正己酸乙酯(8.45%~15.06%)、丁酸己酯(0.70%~7.90%)、乙酸乙酯(3.65%~ 11.92%)、己酸己酯(0.70%~5.08%)。与常温贮藏显著不同的是,低温贮藏后期乙酸乙酯、丁酸乙酯、正己酸乙酯仍保持较高的含量。
醇类通常具有清香型的感官特征[24]。由图1B、表1可知,常温贮藏期间,醇类在百香果总香气物质中占比仅次于酯类。醇类物质相对含量在贮藏后期逐渐增加,贮藏12 d时达最高值24.74%、种类21种;在醇类物质中相对含量较高的化合物是2-庚醇(0.58%~6.06%)、芳樟醇(1.58%~3.29%)、正辛醇(0.66%~4.73%)。由图1B、表2可知,低温贮藏期间,醇类物质相对含量呈先上升后下降趋势,在贮藏8 d时达最高值16.11%、种类数达最高值19种,在醇类物质中相对含量较高的化合物是芳樟醇(2.07%~3.29%)、2-庚醇(0.42%~3.14%)、正辛醇(0.66%~3.10%)、正己醇(0%~2.30%)。
酮类可能是由于脂肪的热氧化降解和氨基酸降解而形成[25]。由图1C、表1可知,总体而言常温贮藏期间,酮类相对含量在百香果总香气物质中占比排名第三,在酮类物质中相对含量较高的化合物是β-紫罗酮、L-薄荷酮、二氢-β-紫罗兰酮、2-庚酮。由图1C、表2可知,低温贮藏期间,酮类物质相对含量呈下降趋势,贮藏1 d时为14.47%、种数为9种,但20 d时相对含量为6.78%、种数为10种,在酮类物质中相对含量较高的化合物是β-紫罗酮、二氢-β-紫罗兰酮、2-庚酮。
醛类、烷烃类在百香果贮藏过程中成分较为单一,相对含量在百香果总香气物质中占比较低。由图1D、图1F和表1可知,常温贮藏期间醛类仅检测出壬醛,贮藏0~12 d相对含量最高仅为1.17%(0 d);另外,检出的烷烃类化合物主要是茶螺烷、(1-甲基丁基)环丙烷,贮藏0~12 d烷烃类相对含量最高为4.98%(12 d)。与常温贮藏相比,低温贮藏期间鉴定出的醛类、烷烃类化合物种类更多,但主要的醛类化合物也是壬醛(0.13%~1.17%),主要的烷烃类化合物是(1-甲基丁基)环丙烷、8-丙烷-2-亚烷基双环[5.1.0]辛烷、茶螺烷。
烯烃类在百香果不同温度贮藏期间相对含量和种类数均呈下降趋势。由图1E可知,不同温度贮藏过程中烯烃类相对含量最高均为5.85%(0 d)。由表1、2可知,相对含量最高的化合物均为月桂烯,常温贮藏期间从1.61%(0 d)降至0.39%(4 d)、贮藏6~12 d未检出;低温贮藏期间从1.61%(0 d)降至0.73%(8 d)、贮藏10~20 d未检出。常温貯藏期间,相对含量大于1%的化合物仅检测出月桂烯、β-罗勒烯、(E)-Β-罗勒烯、萜品烯;低温贮藏期间,相对含量大于1%的化合物仅检测出月桂烯、(E)-Β-罗勒烯。
酸类在百香果不同温度贮藏期间相对含量较高的化合物均为反式2-己烯基己酸和己酸,由表1、2可知,常温下反式2-己烯基己酸仅在贮藏0 d时检出、己酸仅在贮藏2 d时检出;低温下反式2-己烯基己酸仅在贮藏0~2 d检出、己酸仅在贮藏12~16 d检出。
2.2 不同温度贮藏过程中百香果酯类代谢途径关键酶活性分析
百香果酯类香气物质是果实次生代谢产物,是在相关酶催化下以脂肪酸、氨基酸和单糖为前体物质形成的[26]。百香果不同温度贮藏过程中酯类代谢途径关键酶活性的变化见图2。
果实LOX活力随常温与低温贮藏时间的延长发生显著变化(P<0.05)。贮藏0 d时,果实LOX活力为2.53 mU/mg;常温条件下果实的LOX活力在贮藏10 d时达最高值8.02 mU/mg,12 d时降至6.69 mU/mg;低温贮藏果实的LOX活力在18 d时达最高值6.41 mU/mg,20 d时降至5.53 mU/mg;表明低温贮藏可延缓百香果LOX高峰出现。
果实AAT活力在常温贮藏期间总体呈先升高后降低趋势,在贮藏8 d时达最大值1.56 mU/mg。低温贮藏果实的AAT活力前期变化缓慢,贮藏中后期逐渐升高而后降低;贮藏0~10 d该酶活力无显著差异(P<0.05),从12 d开始上升,16 d时AAT活力达到峰值2.75 mU/mg。
果实ADH活力在常温贮藏期间总体呈下降趋势,中间有波动,贮藏0 d时为最大值0.23 mU/mg,贮藏8~12 d无显著差异(P<0.05);低温贮藏果实的ADH活力波动较大,总体呈先下降后上升再下降的趋势,贮藏4 d时该酶活力为最小值0.50 mU/mg,18 d时该酶活力达到峰值5.46 mU/mg。
果实HPL活力在常温与低温贮藏期间均呈先上升后下降趋势,常温贮藏6 d时达最大值2.54 mU/mg;低温贮藏前期变化较为缓慢,贮藏0~10 d该酶活力无显著差异(P<0.05),贮藏18 d达最高值2.38 mU/mg。
2.3 百香果酯类香气化合物与其代谢关键酶的相关性分析
常温与低温贮藏百香果果实中,主要香气成分酯类化合物与其代谢关键酶LOX、AAT、ADH、HPL活性的相关性分析结果见表3。常温贮藏条件下,LOX活性与3-羟基丁酸乙酯、3-甲硫基丙酸乙酯的相对含量呈极显著正相关(P<0.01),与乙酸乙酯、乙酸甲酯、(Z)-巴豆酸乙酯、3-羟基己酸乙酯的相对含量呈显著正相关(P<0.05);但与3,7-二甲基-6-辛烯醇丁酸酯的相对含量呈极显著负相关(P<0.01),与乙酸丁酯、乙酸己酯、丁酸己酯、丁酸辛酯、己酸己酯、庚酸2-庚酯的相对含量呈显著负相关(P<0.05)。AAT活性与丁酸乙酯、2-己烯酸乙酯、乳酸乙酯、巴豆酸乙酯的相对含量呈显著正相关(P<0.05);但与丁酸甲酯、乙酸丁酯的相对含量呈极显著负相关(P<0.01),与正己酸乙酯、乙酸己酯、辛酸乙酯、乙酸顺式-3-己烯酯的相对含量呈显著负相关(P<0.05)。ADH活性与正己酸乙酯的相对含量呈极显著正相关(P<0.01),与乙酸丁酯、己酸甲酯、乙酸己酯、辛酸己酯、乙酸顺式-3-己烯酯的相对含量呈显著正相关(P<0.05)。HPL活性与丁酸庚酯、(Z)-己酸-3-己烯酯、辛基己酸酯的相对含量呈显著正相关(P<0.05),但与己酸-1-甲基己酯的相对含量呈显著负相关(P<0.05)。
低温贮藏条件下,LOX活性与乙酸乙酯、辛酸乙酯、3-羟基己酸乙酯、3-甲硫基丙酸乙酯、3-羟基十三烷酸乙酯的相对含量呈极显著正相关(P<0.01),与丁酸乙酯、正己酸乙酯、乳酸乙酯、(Z)-巴豆酸乙酯的相对含量呈显著正相关(P<0.05);但与庚酸2-庚酯、己酸-1-甲基己酯的相对含量呈极显著负相关(P<0.01),与丁酸甲酯、丁酸丁酯、丁酸己酯、丁酸辛酯、3,7-二甲基-6-辛烯醇丁酸酯、3-羟基丁酸叔丁酯的相对含量呈显著负相关(P<0.05)。AAT活性与辛酸乙酯、3-甲硫基丙酸乙酯的相对含量呈极显著正相关(P<0.01),与乙酸乙酯、正己酸乙酯、乳酸乙酯、3-羟基己酸乙酯、(Z)-巴豆酸乙酯、3-羟基十三烷酸乙酯的相对含量呈显著正相关(P<0.05);但与庚酸2-庚酯的相对含量呈极显著负相关(P<0.01),与3-羟基丁酸叔丁酯、己酸-1-甲基己酯的相对含量呈显著负相关(P<0.05)。ADH活性与正己酸乙酯、辛酸乙酯、3-甲硫基丙酸乙酯、3-羟基十三烷酸乙酯的相对含量呈显著正相关(P<0.05);但与庚酸2-庚酯的相对含量呈极显著负相关(P<0.01),与己酸-1-甲基己酯的相对含量呈显著负相关(P<0.05)。HPL活性与乳酸乙酯的相对含量呈极显著正相关(P<0.01),与乙酸乙酯、丁酸乙酯、乙酸己酯、3-羟基己酸乙酯、3-羟基丁酸乙酯、(Z)-巴豆酸乙酯、3-甲硫基丙酸乙酯的相对含量呈显著正相关(P<0.05);但与丁酸甲酯、丁酸丁酯、丁酸己酯、3,7-二甲基-6-辛烯醇丁酸酯、3-羟基丁酸叔丁酯、庚酸2-庚酯、己酸-1-甲基己酯的相对含量呈显著负相关(P<0.05)。
3 讨论
果实香气物质形成是一个动态过程,在贮藏过程中其种类和含量变化与果实品种和采后存贮条件密切相关。百香果果实香气主要是酯类物质,为果香型香气的主要成分,果汁中的酯类物质含量越高,香味越强烈。Macoris等[7]报道了百香果果肉共含77种挥发性化合物,主要以丁酸甲酯、乙酸丁酯、己醛、丁酸丁酯、反式-3-己烯乙酸酯、顺式-3-己烯-1-醇、己酸丁酯、丁酸己酯等酯类为主要挥发性化合物。潘葳等[10]研究鉴定了5个不同品种的百香果果汁中共含有68種香气成分,均以酯类物质含量最高,其次为醇类、酮类、萜烯类、烷类、醚类和杂环类;而香气物质含量较高的是丁酸乙酯、己酸乙酯、丁酸己酯等。陈庆等[27]研究也发现紫红百香果含有酯类43种、醇类11种、醛类3种、酮类8,其中酯类含量最高,而酯类物质则以己酸乙酯、丁酸乙酯、乙酸乙酯为主。韩素芳等[28]采用固相微萃取-气相色谱-质谱联用仪分析百香果香气成分,检出63种挥发性化合物,其中丁酸己酯、丁酸乙酯、己酸乙酯、乙酸乙酯相对含量较高。但前期研究均未阐明不同贮藏温度下百香果香气物质种类和含量的变化规律,实际上贮藏温度能显著影响香气物质代谢,在不同温度条件下其种类和含量具有较大差别。在本研究中,采用不同温度贮藏百香果果实,结果发现果汁香气成分均以酯类为主,其次为醇类、酮类、醛类、烯烃类、烷烃类、酸类等,且酯类物质在常温(25 ℃)和低温(6 ℃)贮藏条件下相对含量较高的均是丁酸乙酯、正己酸乙酯、丁酸己酯、乙酸乙酯、己酸己酯。本研究发现,低温贮藏并不影响百香果的主要香气成分组成,但影响着香气成分比例的变化。百香果总香气物质和酯类的相对含量在常温贮藏期间呈先上升后逐渐下降趋势,分别于2 d(99.43%)、4 d(60.32%)达到峰值;二者在低温贮藏期间呈逐渐上升趋势,分别于8 d(96.22%)、29 d(69.27%)达到最高值,因此低温延缓了百香果的香气挥发性物质的形成,并维持较高含量。这与邵青旭[29]发现10 ℃低温处理可减缓甜瓜果实酯类物质含量的降低速度结论相似,推测在低温条件下果实可能通过增加香气物质含量来抵抗胁迫以适应不良低温环境,这是果实在逆境条件下的一种自我保护机制[29]。
挥发性物质的代谢途径比较复杂,参与代谢关键酶也比较复杂。果实香气物质是由组织中一些前体物质在酶的催化作用下,通过一定的生化途径形成的。百香果主要香气物质是酯类,前人研究已证实,酯类代谢途径关键酶LOX、AAT、ADH和HPL在果实成熟过程中对酯类香气物质形成起重要作用[30-32]。本研究发现,低温贮藏前期LOX、AAT和HPL活性变化不大,在贮藏后期表现活跃,但活性峰值出现时间迟于常温贮藏,表明低温可以有效抑制酯类代谢途径关键酶活性。陈丽[18]、陶淑华等[33]研究均发现低温贮藏能够抑制猕猴桃中的LOX、HPL、ADH、AAT等关键酶活性,这与本研究结论一致。酯类代谢途径关键酶活性在低温贮藏后期表现活跃,这与香气物质尤其是酯类物质的相对含量变化趋势相符合。另外,本研究结果表明百香果酯类香气化合物与其代谢关键酶活性密切相关。在张莉会等[34]草莓酯类香气化合物及其相关酶活性研究中也发现酯类香气物质与LOX、AAT、ADH有着显著正相关性,与本研究的结论一致。由于酯类香气成分生成于以脂肪酸、氨基酸和单糖为前体的代谢途径。脂肪酸是大多数直链酯类香气成分的前体,LOX以不饱和脂肪酸为底物生成氢过氧化物,在HPL催化下生成己醛和己烯醛,然后在ADH作用下生成醇类物质,醇类物质作为受体,最后在AAT作用下合成酯类物质[35-36]。氨基酸是大多数支链酯类香气成分的前体,首先通过脱氨酶和氧化酶的转氨作用形成支链酮酸,然后在脱羧酶或脱氨酶作用下生成支链醇,最后支链醇与酰基在AAT的作用下形成支链酯类香气成分[37-38]。
果实香气形成是一个复杂的代谢过程,香气因水果种类或品种不同而存在差异,百香果果实香气形成的生理机制和基因表达模式尚未阐明,今后应对百香果香气的形成与代谢途径及相关酶生理功能进行重点研究,并通过香气物质合成相关酶基因克隆与表达分析,在分子水平上调控香气物质的合成,从而深刻认识百香果香气形成机理,最终达到控制特征香气合成、提高果实品质的目的。
4 结论
百香果在常温(25 ℃)和低温(6 ℃)贮藏期间,果汁中香气物质均以酯类为主,其相对含量分别占总香气物质的40.00%~60.32%、54.95%~69.27%,其次是醇类和酮类。在酯类物质中相对含量较高的化合物是丁酸乙酯、正己酸乙酯、丁酸己酯、乙酸乙酯、己酸己酯。百香果酯类物质相对含量在常温贮藏4 d时出现峰值(60.32%),在贮藏中后期(6~12 d)从55.80%降至40.00%;而在低温贮藏中酯类物质相对含量延至20 d时才出现峰值(69.27%),在贮藏中后期(10~20 d)维持在61.92%~69.27%,表明低温贮藏可以维持酯类物质较高的相对含量。对酯类代谢途径关键酶活性分析发现,LOX、AAT和HPL在低温贮藏前期活性变化不大,贮藏后期表现活跃,最高值出现时间迟于常温贮藏,表明低温可以有效抑制酯类代谢关键酶活性。酯类香气化合物与其代谢关键酶的相关性分析显示,LOX、AAT、ADH、HPL活性与酯类香气物质相对含量具有较强相关性。本研究为百香果采后品质保持和保鲜技术提供了理论依据。
参考文献
[1] Wyckhuys K, Korytkowski C, Martinez J, et al. Species composition and seasonal occurrence of Diptera associated with passionfruit crops in Colombia[J]. Crop Protection, 2012, 32: 90-98.
[2] Jimenez A M, Sierra, C A, Rodriguez-pulido F J, et al. Phy-sicochemical characterisation of gulupa (Passiflora edulis Sims. fo edulis) fruit from Colombia during the ripening[J]. Food Research International, 2011, 44(7): 1912-1918.
[3] 成文韜, 袁启凤, 肖图舰, 等. 西番莲果实生物活性成分及生理功能研究进展[J]. 食品工业科技, 2018, 39(16): 346-351.
[4] 崔忠吉. 广西百香果种植现状及存在问题[J]. 农家参谋, 2018, (19): 108, 94.
[5] 谢林婧, 林碧英, 郑诚乐. 福建百香果产业历史、现状及发展若干思考[J]. 福建热作科技, 2017, 42(4): 57-59.
[6] 张佳艳, 任仙娥. 西番莲果汁的研究进展[J]. 食品研究与开发, 2016, 37(11): 219-224.
[7] Macoris M S, Janzantti N S, Gattuti D S, et al. Volatile compounds from organic and conventional passion fruit (Passiflora edulis F. Flavicarpa) pulp[J]. Food Science and Technology, 2011, 31(2): 430-435.
[8] Porto-Figueira P, Freitas A, Cruz C J, et al. Profiling of passion fruit volatiles: An effective tool to discriminate between species and varieties[J]. Food Research International, 2015, 77: 408-418.
[9] Janzantti N S, Macorism S, Garrutid S, et al. Influence of the cultivation system in the aroma of the volatile compounds and total antioxidant activity of passion fruit[J]. LWT - Food Science and Technology, 2012, 46(2): 511-518.
[10] 潘 葳, 刘文静, 韦 航, 等. 不同品种百香果果汁营养与香气成分的比较[J]. 食品科学, 2019, 40(22): 277-286.
[11] 郭艳峰, 吴惠婵, 夏 雨, 等. 百香果不同发育阶段果汁挥发性成分研究[J]. 福建农业学报, 2017, 32(3): 299-304.
[12] 申济源. 基于LOX途径的果实香气物质形成与调控解析[D]. 杭州: 浙江大学, 2013: 2-5.
[13] Liu H, Song L, You Y, et al. Cold storage duration affects litchi fruit quality, membrane permeability enzyme activities and energy charge during shelf time at ambient temperature[J]. Postharvest Biology Technology, 2011, 60(1): 24-30.
[14] 王 龙, 周 鑫, 盛 蕾, 等. 冷藏对南果梨酯类香气合成关键酶活性及蛋白表达的影响[J]. 食品科学, 2017, 38(9): 207-212.
[15] Leone A, Bleve-zacheo T, Gerardi C, et al. Lipoxygenase involvement in ripening strawberry[J]. Journal of Agricul-tural and Food Chemistry, 2006, 54(18): 6835-6844.
[16] Anadreou A, Feussner I. Lipoxygenases: structure and reaction mechanism[J]. Phytochemistry, 2009, 70(13-14): 1504-1510.
[17] 梁银娜, 李 宝. 柿果实乙醇脱氢酶酶学特性研究[J]. 中国农业大学学报, 2011, 16(5): 65-70.
[18] 陈 丽. 美味猕猴桃采后果实风味物质变化的研究[D]. 杭州: 浙江工商大学, 2018: 6-8.
[19] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 105-107.
[20] 张 琳. 乙烯对1-MCP处理的猕猴桃香气与醇酰基转移酶活性及基因表达的影响[D]. 西安: 陕西师范大学, 2013: 21-22.
[21] 刘鑫泉. 菠萝蜜果实香味物质形成相关酶活性及基因表达分析[D]. 湛江: 广东海洋大学, 2016: 9-10.
[22] 陳 燕, 孙晓红, 孙国伟, 等. 顶空固相微萃取-气相色谱质谱分析蓝莓粗提物中的挥发性成分[J]. 食品工业科技, 2013, 34(20): 78-81.
[23] Ai J. Headspace solid phase microextration. Dynamics and quantitative analysis before reaching a partition equili-brium[J]. Analytical Chemistry, 1997, 69(16): 3260-3266.
[24] 张晓萌. 桃果实成熟过程中香气成分形成及其生理机制研究[D]. 杭州: 浙江大学, 2005: 4-6.
[25] Du L, Li J, Li W, et al. Characterization of volatile com-pounds of pu-erh tea using solid-phase microextractionand simultaneous distillation-extraction coupled with gas chro-matography-mass spectrometry[J]. Food Research Interna-tional, 2014, 57: 61-70.
[26] 张丽萍. 冷藏及1-MCP处理对南果梨挥发性香气物质代谢的影响及其调控[D]. 沈阳: 沈阳农业大学, 2013: 31-32.
[27] 陈 庆, 贾 强, 董 浩, 等. 紫红百香果果汁挥发性香气分析及仿香研究[J]. 现代食品科技, 2018, 34(12): 258-263.
[28] 韩素芳, 丁 明, 刘亚群, 等. 顶空固相微萃取-气相色谱-质谱测定百香果香气条件的优化[J]. 中国食品学报, 2010, 10(4): 278-284.
[29] 邵青旭. 低温贮藏对薄皮甜瓜风味品质的影响[D]. 沈阳: 沈阳农业大学, 2019: 1-2, 35-36.
[30] Both V, Brackmann A, Thewes F R, et al. Effect of storage under extremely low oxygen on the volatile composition of ‘Royal Gala apples[J]. Food Chemistry, 2014, 156: 50-57.
[31] Xi W P, Zhang B, Shen J Y, et al. Intermittent warming alleviated the loss of peach fruit aroma-related esters by regulation of AAT during cold storage[J]. Postharvest Biol-ogy and Technology, 2012, 74(6): 42-48.
[32] 周 鑫. 冷藏及1-MCP处理对南果梨酯类香气影响的分子机制及香气“唤醒”研究[D]. 沈阳: 沈阳农业大学, 2015: 7-8.
[33] 陶淑华, 陈 丽, 蒋镇烨, 等. 低温贮藏对美味猕猴桃布鲁诺果实主要挥发性物质和脂肪酸代谢的影响[J]. 核农学报, 2020, 34(2): 288-297.
[34] 张莉会, 汪 超, 廖 李, 等. 草莓干燥过程中酯类香气化合物及相关酶活性的变化[J]. 食品科学, 2020, 41(4): 172-177..
[35] Rowan D D, Allen J M, Fielder S, et al. Biosynthesis of straight-chain ester volatiles in red delicious and granny smith apples using deuterium-labeled precursors[J]. Journal of Agricultural and Food Chemistry, 1999, 47(7): 2553- 2562.
[36] 廖凤玲, 汪志辉, 熊 博, 等. 爱甘水梨果实发育过程香气形成与代谢关键酶活性的关系[J]. 华北农学报, 2014, 29(2): 152-155.
[37] Rowan D D, Lane H P, Allen J M, et al. Biosynthesis of 2-methylbutyl, 2-methyl-2-butenyl, and 2-methylbutanoate esters in red delicious and granny smith apples using deute-rium-labeled substrates[J]. Journal of Agricultural and Food Chemistry, 1996, 44(10): 3276-3285.
[38] 谭 卓. 基于脂肪酸代谢的冷藏南果梨香气变淡机理及调控研究[D]. 沈阳: 沈阳农业大学, 2018: 7-10.
责任编辑:崔丽虹

