3种独蒜兰属植物的光合特性
沈立明 戴中武 钟惠 代晓雨 翟俊文 吴沙沙
摘 要:为探明独蒜兰属植物在光合生理方面的差异,本研究以云南独蒜兰(Pleione yunnanensis)、美丽独蒜兰(P. pleionoides)和流苏独蒜兰(Pleione barbarae)为材料,测定其叶片的光响应曲线、CO2响应曲线和叶绿素含量(SPAD),探究其光合特性。结果表明:3种独蒜兰属植物均具有较强的耐阴性,且植株叶片SPAD值的高低与其光合速率有相关性。3种独蒜兰属植物之间的光补偿点(LCP)、光饱和点(LSP)、暗呼吸速率(Rd)、初始量子效率(a)、光呼吸速率(Rp)和CO2饱和点(CSP)均无显著差异。云南独蒜兰光合作用对较低浓度的CO2利用率高,更能适应低CO2浓度的环境;美丽独蒜兰表现出对光的适应范围较广,但在光合速率增加时所需的CO2浓度较高;而流苏独蒜兰对强光较敏感,易出现光抑制现象。此外,CO2的供应可能是影响其光合速率的主要因素之一,在生产栽培中注意遮荫,适当增加CO2浓度对3种独蒜兰属植物的光合作用有利。
关键词:独蒜兰属;光合特性;叶绿素含量;耐阴性;光抑制
中图分类号:S682.31 文献标识码:A
Abstract: The light response curve, CO2 response curve, and chlorophyll content of Pleione yunnanensis, P. pleionoides, and Pleione barbarae were measured, to study the photosynthetic characteristics and provide a certain theoretical basis for Pleione cultivation. Results showed that all the three species had shade resistance, and the SPAD value of plant leaves was related to its photosynthetic rate. The light compensation point (LCP), light saturation point (LSP), dark respiration rate (Rd), initial quantum efficiency (a), rate of photorespiration (Rp) and CO2 saturation point (CSP) among the three species were not significantly different. Photosynthesis of P. yunnanensis had a high utilization rate of lower CO2 and was more suitable for the environment of low CO2 concentration. P. pleionoides showed a wide range of light adaptation, but it required a higher concentration of CO2 to increase photosynthetic rate. Pleione barbarae was more sensitive to strong light and easy to occur light suppression phenomenon. Furthermore, the supply of CO2 may be one of the main factors affecting the increase in photosynthetic rate of plant leaves. To increase yield, shading is needed in cultivation, and appropriately increase the CO2 concentration will be beneficial to the photosynthesis of these three species.
Keywords: Pleione; photosynthetic characteristics; chlorophyll fluorescence parameters; shade-endurance; photoinhibition
DOI: 10.3969/j.issn.1000-2561.2021.05.022
獨蒜兰属(Pleione D. Don)隶属于兰科(Orchidaceae)树兰族(Trib. Epidendreae Humb., Bonpl. et Kunth),分布于海拔500~4 200 m的亚热带高山地区,地生或附生于树干、岩石表面的苔藓中,处于弱光的生长条件下[1]。该属植物不但极具观赏价值,且具有很高的药用价值,其中独蒜兰(P. bulbocodioides)和云南独蒜兰(P. yunnanensis)为药典中山慈菇的基原植物[2]。全球约有独蒜兰属植物27种和9个天然杂交种,主要分布在中国秦岭以南[3]。然而,目前独蒜兰属仅在欧美、日本及中国台湾有较广泛的栽培应用,英国已培育出445个品种,中国仅见中国科学院昆明植物研究所培育出17个新品种[4-5]。
独蒜兰属因其特殊的生长环境,使得目前中国大陆地区对它的栽培和育种技术无法满足其资源保护及市场需求[6]。光合作用作为一个易受环境影响的重要生理过程,决定了不同生境的植物具有不同的光合特性[7]。因此,可通过研究植物的光合特性来探究植物在引种栽培时环境变化中的光合生理[8-9]。此外,植物叶片叶绿素含量的高低是植物的生理指标之一,作为参与光合作用的重要色素及光反应中心,植株的生长状况和光合能力很大程度反映在植物叶片的叶绿素含量上[10]。但目前对独蒜兰属光合特性的研究还较少,仅见对独蒜兰(P. bulbocodioides)、陈氏独蒜兰(P. chunii)、黄花独蒜兰(P. forrestii)和台湾独蒜兰(P. formosana)光合特性的研究,而对于具有极高药用价值的云南独蒜兰还未见报道[11]。鉴于此,本研究通过测定云南独蒜兰、流苏独蒜兰(Pleione barbarae)、美丽独蒜兰(P. pleion-oides)叶片光合作用及SPAD值的相关参数,来探究其光合特性,旨在为云南独蒜兰的生产栽培提供一定的理论依据,同时通过进一步探明独蒜兰属植物在光合生理方面的差异,为该属植物的引种栽培及良种培育提供一定参考。
1 材料与方法
1.1 材料
1.1.1 試验材料 试验材料为2017年3月初从中国云南省引种的云南独蒜兰、美丽独蒜兰和流苏独蒜兰,测定所用植株生长健壮,长势一致,且均处于开花完成,叶片完全成熟的状态。
1.1.2 试验区概况 于2017年7月上旬,在福建省泉州市永春县呈祥乡(海拔1200 m,2527 N、11807 E)兰花高山催花基地内进行实验。当地年平均气温为16.4 ℃,年平均相对湿度78%,年平均降雨量1670 mm,属中亚热带季风气候,昼夜温差较大,夏季白天气温最高可达30 ℃,夜晚最低温15 ℃。
1.2 方法
1.2.1 光响应曲线测定 于晴天上午9:00~11:00进行,使用Li-6400便携式光合仪(Li-Cor, USA)进行测定,以LED红蓝光源,将光照强度(PAR,Photosynthetically Active Radiation)设定为600、550、500、450、400、350、300、250、200、150、100、50、0 μmol/(m2s) 13个梯度,其中CO2浓度统一设定为400 μmol/mol。采用自动测量系统Auto Prog,设定最大等待时间300 s、最小等待时间120 s,进行测量。每种测量进行3个有效重复,即每一种至少测定3株以确保收集3组有效数据,每株测定1片叶子(进行试验的3种独蒜兰属植物单株均只有1片叶片)。
1.2.2 CO2响应曲线测定 使用Li-6400便携式光合仪自动CO2响应曲线测定功能测定3种独蒜兰属植物的CO2响应曲线,每种测量进行3个重复,设定光强为400 μmol/(m2·s),设定CO2浓度梯度为50、100、150、200、300、400、600、800、1000、1200 μmol/mol,设定的最小及最大等待时间与测定光响应曲线的设定一致,测定对应的Pn值。
1.2.3 叶绿素相对含量分析测定 植物叶片叶绿素含量与其绿色度(SPAD值)具有显著相关性[12],利用SPAD-叶绿素检测仪测定植物叶片的叶绿素含量,是较为便捷且不损伤叶片的方法[13]。本研究采用SPAD-502 PLUS叶绿素计(MINOLTA,Japan)对此3种独蒜兰属植物叶片进行SPAD值测定,每片叶测定6个位置,每个种测定5株。
1.3 数据处理
利用WPS Office 2018软件整理原始数据及作图,SPSS Statistics 19软件的Duncans方法对数据进行多重比较分析,并利用直角双曲线修正模型[14]拟合此3种独蒜兰属植物的光响应曲线及CO2响应曲线,使用光合计算4.1.1软件计算光响应曲线和CO2响应曲线拟合值及光合参数。
2 结果与分析
2.1 光响应曲线
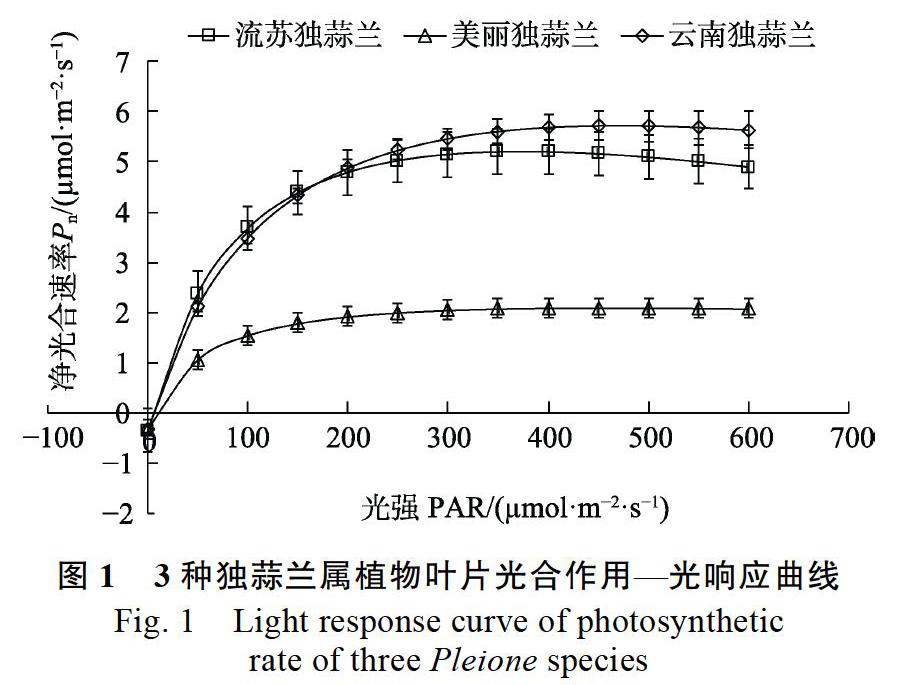
流苏独蒜兰、美丽独蒜兰、云南独蒜兰的光响应曲线拟合方程系数(R2)分别为0.990、0.916和0.994。拟合结果由图1可知,3种独蒜兰属植物的Pn在PAR由0 μmol/(m2·s)至100 μmol/(m2·s) 时都随着PAR的增强而基本呈线性上升趋势;当PAR继续增强,Pn的增长速率持续减慢,直至达到光饱和。
3种独蒜兰属植物的光响应曲线变化趋势存在差异,其中流苏独蒜兰和云南独蒜兰的光响应曲线变化趋势较为接近,且均在PAR增强到一定值时Pn开始下降,可能因为光照过强发生了光抑制;而美丽独蒜兰在PAR由0 μmol/(m2·s)增强至600 μmol/(m2·s)时,Pn逐渐趋于稳定,未出现下降趋势。当PAR为0 μmol/(m2·s)时,流苏独蒜兰、美丽独蒜兰和云南独蒜的呼吸作用强度基本一致。
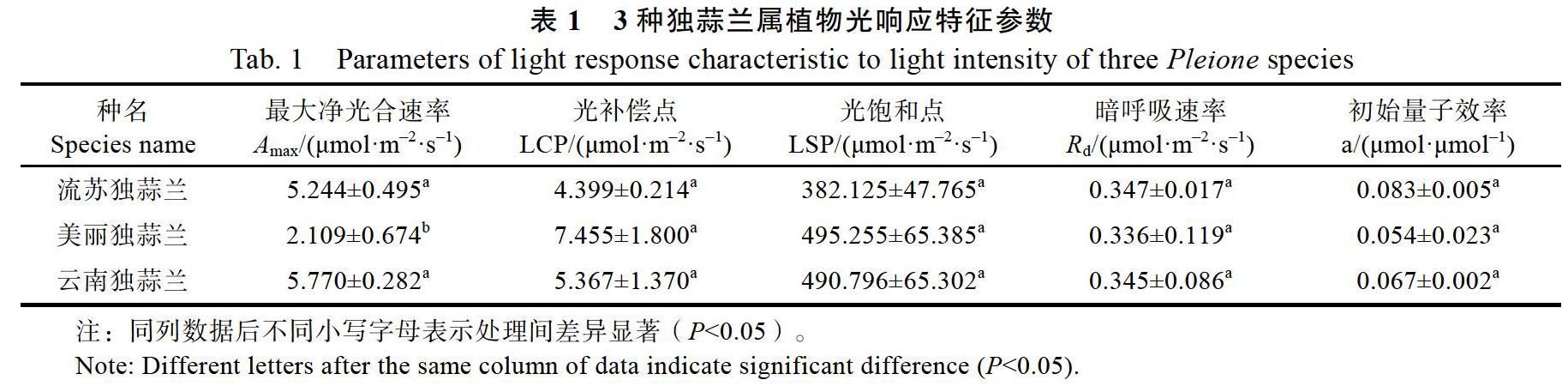
由表1可知,当CO2浓度为400 μmol/mol时,3种独蒜兰属植物的光补偿点、光饱和点、暗呼吸速率和初始量子效率均无显著差异。此外,最大净光合速率(Amax)表现最小的为美丽独蒜兰,而流苏独蒜兰和云南独蒜兰无显著差异。
2.2 CO2响应曲线
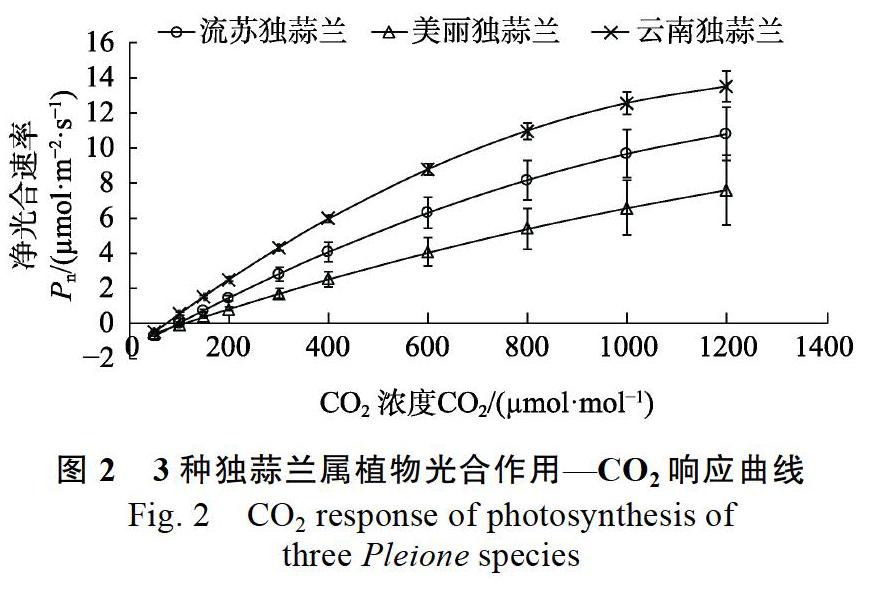
流苏独蒜兰、美丽独蒜兰和云南独蒜兰CO2响应曲线的拟合方程系数(R2)分别为0.992、0.993和0.999,曲线的拟合效果较好。由图2可知,3种独蒜兰属植物的Pn增长趋势在CO2浓度为50~1200 μmol/mol时,基本都呈线性上升趋势,且3种植物都未达到CO2饱和状态。其中云南独蒜兰的Pn增长趋势最快;流苏独蒜兰的Pn增长趋势居中;美丽独蒜兰的Pn增长趋势最慢,且在CO2浓度为50~1200 μmol/mol时,其增长趋势未出现减弱。
表2反映光合作用对胞间CO2浓度响应的特征参数,可以看出3种独蒜兰属植物间的最大净光合速率(Amax)、光呼吸速率(Rp)和CO2饱和点(CSP)均无显著差异。美丽独蒜兰的初始羧化效率(CE)最小,为0.010 μmol/(m2·s);流苏独蒜兰居中,为0.016 μmol/(m2·s);云南独蒜兰最大,是美丽独蒜兰的2.2倍。此外,云南独蒜兰的CO2补偿点(CCP)最小,仅为74.977 μmol/mol,与流苏独蒜兰及美丽独蒜兰差异显著,而美丽独蒜兰的CO2补偿点与流苏独蒜兰无显著差异。
2.3 叶绿素含量
由图3可知,3种独蒜兰属植物的叶片SPAD值表现为云南独蒜兰与美丽独蒜兰差异显著,其中云南独蒜兰(45.207)最大,美丽独蒜兰(38.333)最小。流苏独蒜兰则表现居中(42.207),与云南独蒜兰及美丽独蒜兰差异不显著。
3 讨论
光合作用通过光系统I和II将太阳能转化为化學能,为生命提供能量[15]。植物在进行光合作用的过程中,当光能吸收量大于其光化学反应所需的利用量,且这些过剩的光能未能耗散时,就会出现光抑制现象,而光抑制的程度取决于光系统Ⅱ反应中心与光合机构保护机制的运转破坏两方面的平衡状态[16]。本研究中,3种独蒜兰属植物均在光强达到光饱和点后,出现不同程度的Pn下降情况,流苏独蒜兰在光强达到光饱和点后,最先出现光抑制现象,表明其光系统在光强增强时受光抑制程度较强,对强光最为敏感,而美丽独蒜兰最晚出现光抑制现象能维持较高的光合速率,说明其进行光合作用适应的光强范围较广。另一方面,当植物进行光合作用所需的光能过剩时,植物可通过叶黄素循环以热能形式耗散掉过多的光能,并利用光呼吸将释放的NH3重新固定及从叶绿体将还原性物质运输至线粒体来消耗还原力[17-18]。研究表明,植物的光呼吸能力越强,它对高光的耐受性也就越强,如失去光呼吸功能的拟南芥(Arabidopsis thaliana)突变体的光抑制表型表现更强[19],本研究中3种独蒜兰属植物的光呼吸速率无显著差异,且远不及耐强光植物的光呼吸速率[20],可见这3种植物较低的光呼吸速率可能与其较弱的强光耐受性相关。
植物生存所需的最低光照,即耐阴性,是一个至关重要的生活史特征[21]。有研究表明,光饱和点在405~810 μmol/(m2·s),且光补偿点在8.1~ 24.3 μmol/(m2·s)的植物耐阴性强[22]。当光强达到植物的光补偿点时,呼吸消耗的有机物与光合作用制造的相等,光补偿点越低植物利用弱光的能力越强;光饱和点则表现植物对强光的适应能力,光饱和点越高的植物可在越强的光下正常生长发育[23]。本研究中3种独蒜兰属植物的光补偿点无显著差异,均不超过24.3 μmol/(m2·s),光饱和点也均小于810 μmol/(m2·s),说明这3种独蒜兰属植物利用弱光的能力强,具有较强的耐阴性,与李云霞等[11]研究的另外4种独蒜兰属植物的结果基本一致。
初始羧化效率反映植物胞间CO2浓度为50 μmol/mol时植物Rubisco的量及酶活性,初始羧化效率越高,植物光合作用对低浓度CO2的利用能力越强[24],3种独蒜兰属植物中美丽独蒜兰的初始羧化效率最小,其光合作用利用CO2的效率较低;云南独蒜兰的初始羧化效率最高,其Rubisco的量及酶活性均高于美丽独蒜兰和流苏独蒜兰,表明云南独蒜兰对CO2的利用率高,在低CO2浓度的环境下生长发育不易受抑制。CO2补偿点反映植物呼吸消耗与光合同化作用相当时的CO2浓度,CO2饱和点则反映植物利用高CO2浓度的能力,这2个参数是判断植物是否具有高光合效率的一种指标[25]。本研究中云南独蒜兰CO2补偿点为最低,且低于之前已发表的4种独蒜兰属植物,进一步表明云南独蒜兰对CO2的利用率高[11]。此外,这3种独蒜兰属植物间的CO2饱和点与最大净光合速率均无显著差异,可见对高CO2浓度的利用能力一定程度上也是影响其光合速率的因素之一。
暗呼吸速率体现植物黑暗条件下呼吸消耗有机物的程度[26],云南独蒜兰、流苏独蒜兰和美丽独蒜兰的暗呼吸速率无显著差异,表明在黑暗条件下,其呼吸消耗程度基本一致。初始斜率表现被测植物的初始量子效率[14],反映植物将光能转化为电子流的最大能力[23]。本研究中,3种独蒜兰属植物的初始量子效率无显著差异,表明其光能利用率相近。此外,光饱和状态下这3种植物表现的最大净光合速率均小于CO2饱和状态的最大净光合速率,表明CO2的供应在很大程度上是限制其光合速率的一个因素。
叶绿素作为绿色植物的基本色素,对于光合作用光能的吸收、传递以及转化起着重要作用[27]。研究表明,植物叶绿素仪测定的SPAD值与植物叶绿素含量呈正相关,SPAD值作为间接指标能够很好地反映植物叶片的叶绿素含量[28]。本研究中,美丽独蒜兰的叶片SPAD值在3种独蒜兰属植物中最低,在光响应曲线中表现的最大净光合速率也最低,同时云南独蒜兰的叶片SPAD值最高,其最大净光合速率也高于美丽独蒜兰,说明独蒜兰属植物的光合速率与叶绿素含量存在一定程度的相关性。有学者认为植物光抑制现象产生的一部分原因是由于植物叶片中含有过多的叶绿素[29],其中Nakajima和Itayama[30]在对微藻(Microalgae)的研究中发现通过减少微藻捕光色素的含量有助于提高微藻光合产量,周振翔等[31]也曾通过研究表明叶绿素含量高的野生型水稻(Oryza sativa)比叶绿素含量相对较低的突变体水稻在高光强下更易出现光抑制,因而本研究中美丽独蒜兰表现的光饱和点最高,不易出现光抑制现象,可能与其相对较低的叶片SPAD值有关。
综上,本研究中3种独蒜兰属植物的叶片SPAD值高低与其光合速率有一定程度的相关性。其较强的耐阴性可能是由长期生长在阴凉的林中树干或被苔藓覆盖的岩壁,与环境长期适应所产生。除此之外,流苏独蒜兰对强光的适应力差,易出现光抑制现象;美丽独蒜兰对光的适应范围较广,其光系统减弱强光对光合活力伤害的能力较强,但在增加光合速率时所需的CO2浓度较高;而云南独蒜兰光合作用对较低浓度的CO2利用率最高,更能适应低CO2浓度的环境。因此,在生产栽培中注意遮荫,适当增加CO2浓度将有利于此3种独蒜兰属植物进行光合作用。光合作用是植物生命中不可或缺的能量转化过程,影响着植株的生长发育,光合生理的研究对独蒜兰属植物的生产栽培及引种育种具有重要意义。
参考文献
[1] 张 燕, 李思锋, 黎 斌. 独蒜兰的生物学特性及栽培技术[J]. 陕西农业科学, 2010, 56(1): 267-268.
[2] Wu X Q, Li W, Chen J X, et al. Chemical constituents and biological activity profiles on Pleione (Orchidaceae)[J]. Molecules, 2019, 24(17): 1-26.
[3] Chen S C, Liu Z J, Zhu G H, et al. Orchidaceae: Flora of China: Vol.25[M]. Beijing & Missouri Botanical Garden, Science Press, 2009: 45-167.
[4] 江鸣涛, 张艺祎, 李云霞, 等. 云南独蒜兰×陈氏独蒜兰种子萌发与幼苗生长研究[J]. 江苏农业科学, 2018, 46(4): 110-113.
[5] 戴中武, 沈立明, 吴小倩, 等. 基于层次分析法对十六种独蒜兰属植物观赏价值综合评价[J]. 北方园艺, 2020(5): 73-79.
[6] 刘 虹, 吴瑞云, 陈 雁. 独蒜兰[J]. 生物学通报, 2010, 45(12): 50.
[7] 尚海琳, 李方民, 林 玥, 等. 桃儿七光合生理特性的地理差异研究[J]. 西北植物学报, 2008, 28(7): 1440-1447.
[8] Xia J B, Zhang S Y, Zhang G C, et al.Critical responses of photosynthetic efficiency in Campsis radicans (L.) Seem to soil water and light intensities[J]. African Journal of Bio-technology, 2011(10): 17748-17754.
[9] 鲁 肃, 张宇清, 吴 斌, 等. 水分胁迫下油蒿光合光响应过程及其模拟[J]. 北京林业大学学报, 2014, 36(1): 55-61.
[10] 杨笑笑, 左琪琪, 杨 磊, 等. 蝴蝶兰叶片叶绿素含量对栽培基质含水量和施肥量的响应[J]. 安徽农业科学, 2015, 43(27): 48-50.
[11] 李云霞, 张艺祎, 郭艳珊, 等. 4种独蒜兰属植物光合特性比较研究[J]. 云南农业大学学报(自然科学), 2018, 33(5): 891-897.
[12] 艾天成, 李方敏, 周治安, 等. 作物叶片叶绿素含量与SPAD值相关性研究[J]. 湖北农学院学报, 2000(1): 6-8.
[13] 蹇 黎, 朱利泉, 张以忠, 等. 贵州兰花SPAD值和叶绿素含量测定与分析[J]. 安徽农业科学, 2009, 37(35): 17462-17464.
[14] 叶子飘. 光合作用对光和CO2响应模型的研究进展[J]. 植物生态学报, 2010, 34(6): 727-740.
[15] Nürnberg Dennis J, Jennifer M, Stefano S, et al. Photochem?istry beyond the red limit in chlorophyll f–containing photo?systems[J]. Science, 2018, 360(6394): 1210-1213.
[16] Demmig-Adams B, Adams Iii W W. Photoprotection and other responses of plants to high light stress[J]. Annual re-view of plant biology, 1992, 43(1): 599-626.
[17] Yamamoto H Y, Chichester C O, Nakayama T O. Bio-synt-hetic origin of oxygen in the leaf xanthophylls[J]. Archives of Biochemistry & Biophysics, 1962, 96(3): 645-649.
[18] Igamberdiev A U, Lea P J. ChemInform Abstract: The Role of peroxisomes in the integration of metabolism and evolu-tionary diversity of photosynthetic organisms[J]. Chemin-form, 2002, 60(7): 651-674.
[19] Takahashi S, Bauwe H, Badger M. Impairment of the photorespiratory pathway accelerates photoinhibition of photosystem II by suppression of repair but not acceleration of damage processes in Arabidopsis[J]. Plant Physiology, 2007, 144(1): 487-494.
[20] 王海珍, 韓 路, 徐雅丽, 等. 胡杨异形叶光合作用对光强与CO2浓度的响应[J]. 植物生态学报, 2014, 38(10): 1099-1109.
[21] Valladares F, Niinemets ülo. Shade tolerance, a key plant feature of complex nature and consequences[J]. Annual Re-vi?ew of Ecology Evolution And Systematics, 2008, 39(1): 237-257.
[22] 汪小飞, 靳文文. 扇脉杓兰耐阴性的测定与分析[J]. 南京林业大学学报(自然科学版), 2014, S1: 57-61.
[23] 叶子飘, 胡文海, 闫小红, 等. 基于光响应机理模型的不同植物光合特性[J]. 生态学杂志, 2016, 35(9): 2544-2552.
[24] 潘学军, 李德燕, 张文娥. 贵州葡萄属野生种光合特性的研究[J]. 植物遗传资源学报, 2011, 12(1): 145-149.
[25] 陈 旅, 楊途熙, 魏安智, 等. 不同花椒品种光合特性比较研究[J]. 华北农学报, 2016, 31(4): 153-161.
[26] 李学礼. 总光合速率、净光合速率与呼吸速率的辨析[J]. 时代教育, 2017(20): 131-132.
[27] 许大全. 叶绿素含量的测定及其应用中的几个问题[J]. 植物生理学通讯, 2009, 45(9): 896-898.
[28] 李 辉, 白 丹, 张 卓, 等. 羊草叶片SPAD值与叶绿素含量的相关分析[J]. 中国农学通报, 2012, 28(2): 27-30.
[29] Ort D R, Merchant S S, Alric J, et al. Redesigning photo-synthesis to sustainably meet global food and bioenergy demand[J]. Proceedings of the National Academy of Sci-ences, 2015, 112(28): 8529-8536.
[30] Nakajima Y, Itayama T.Analysis of photosynthetic productivity of microalgal mass cultures[J]. Journal of Applied Phycology, 2003, 15(6): 497-505.
[31] 周振翔, 李志康, 陈 颖, 等. 叶绿素含量降低对水稻叶片光抑制与光合电子传递的影响[J]. 中国农业科学, 2016, 49(19): 3709-3720.
责任编辑:白 净

