新型冠状病毒S蛋白抗体的制备及初步应用
徐康维,何蕊,权娅茹,苏喆,王剑锋,赵慧,李长贵
1.中国食品药品检定研究院呼吸道病毒疫苗室,北京102629;2.北京生物制品研究所有限责任公司质量检定室,北京100176;3.天津市药品检验研究院生化室,天津300070
新型冠状病毒的大流行严重危害人类健康影响社会发展[1]。自疫情暴发以来,世界各地研究人员一直在努力开发新型冠状病毒肺炎(coronaVirus Disease 2019,COVID-19)疫苗,目前已有上百种疫苗处于临床前或临床开发阶段,包括重组亚单位疫苗、腺病毒载体疫苗、核酸疫苗、新型纳米颗粒疫苗、纯化灭活病毒疫苗等[2-4]。其中灭活病毒疫苗具备应用历史长、工艺成熟、有效性及安全性良好等优点,广泛用于预防和控制新发传染病中,如脊髓灰质炎疫苗、流感疫苗等[5-7]。
新型冠状病毒编码S蛋白、包膜蛋白(envelope,E)、膜蛋白(membrane,M)和核衣壳(nucleocapsid,N)4种结构蛋白[8-10]。S蛋白在病毒吸附及进入宿主细胞的过程中起重要作用,可诱导机体产生高效中和抗体(NAbs),同时也是新型冠状病毒疫苗的主要靶蛋白[11-12]。之前研究报道,新型冠状病毒灭活疫苗接种非人灵长类动物主要产生针对S蛋白的抗体,并可对抗重症急性呼吸综合征冠状病毒2(severe acuterespiratory synd-romecoronavirus2,SARS-CoV-2)起到保护作用[13]。临床研究也显示,新型冠状病毒灭活疫苗在18~59岁健康受试者中具有良好耐受性、免疫原性及安全性[14-15]。本研究通过制备新型冠状病毒重组S蛋白羊和兔抗血清,建立检测新型冠状病毒灭活疫苗抗原含量的双抗体夹心ELISA方法,并初步对新型冠状病毒灭活疫苗产品中S蛋白含量进行定量检测。
1 材料与方法
1.1 实验动物 普通级山羊(体重约20 kg,雄性)和普通级新西兰白兔(体重约2 kg,雄性)均购自北京金牧阳实验动物养殖有限责任公司,并委托该公司进行实验动物饲养、免疫及采血,动物生产许可证号:SCXK(京)2020-0003,实验动物许可证号:SYXK(京)-2020-0007。
1.2 病毒及原液 新型冠状病毒灭活疫苗原液及微量中和试验用新型冠状病毒野病毒(CZ01)购自北京科兴中维生物技术有限公司。
1.3 主要试剂及仪器 重组新型冠状病毒Spike蛋白(S1+S2,无血清培养的昆虫细胞表达,以下简称Spike蛋白)购自北京义翘神州科技有限公司,货号:40589-V08B1;HRP标记的羊抗兔IgG购自荷兰Nordic Mubio公司;Aqua Max4000洗板机购自美国Molecular Devices公司;Thermo Scientific Multiskan Ascent酶标仪购自美国Thermo公司;蛋白G纯化树脂及AKTA pure蛋白纯化仪均购自美国GE公司。
1.4 抗体制备
1.4.1 羊抗S蛋白多克隆抗体的制备 用200μg S蛋白与弗氏完全佐剂混合后,肌肉注射免疫2只山羊,2周后使用100μg S蛋白与弗氏不完全佐剂混合,进行第2次免疫,之后隔周进行1次加强免疫。共免疫4次。免疫前和每次免疫后1周动脉采血分离血清,检测抗体效价。
1.4.2 兔抗S蛋白多克隆抗体的制备 用50μg S蛋白与弗氏完全佐剂混合后,皮下注射免疫4只家兔,2周后使用25μg S蛋白与弗氏不完全佐剂混合,进行第2次免疫,之后隔周进行1次加强免疫。共免疫3次。免疫前和每次免疫后1周动脉采血分离血清,检测抗体效价。
1.5 抗血清EL I S A效价检测 采用间接ELISA法。用PBS缓冲液(pH 7.2)将新型冠状病毒灭活疫苗原液稀释至蛋白含量为1μg/mL,加至96孔板,100μL/孔,4℃静置过夜;PBS-T洗涤5次,加入封闭液(1%BSA,PBS溶解),200μL/孔,室温封闭1 h;用封闭液将羊或兔抗血清从900倍开始进行3倍系列稀释,室温孵育2 h;PBS-T洗涤5次,加入HRP标记的抗羊或抗兔IgG,室温孵育1 h;TMB底物显色,1 mol/L H2SO4终止反应,用酶标仪测定A450/630值。以大于阴性对照孔A值2.1倍的对应抗血清稀释倍数,作为抗血清效价。
1.6 抗血清中和效价检测 采用微量中和试验。用199培养基将免疫前后的羊和兔血清样品进行4倍稀释,56℃水浴灭活30 min;将灭活后血清加至96孔培养板中,每份样品加2孔,50μL/孔,用199培养基从8倍开始进行2倍系列稀释,共12个稀释度;加入100 CCID50/50μL新型冠状病毒野病毒(CZ01株),50μL/孔,37℃培养箱静置2 h;加入(1.2~2.0)×105个 /mL Vero细胞,100μL/孔,置37℃,5%CO2培养箱培养5 d;显微镜下观察细胞病变,以半数细胞出现病变的稀释度计为该血清的中和抗体效价。
1.7 抗体特异性检测 采用免疫印迹试验。用10%Bis-Tris预制胶和MES电泳缓冲液对新型冠状病毒疫苗灭活原液进行还原电泳,上样量10μL,150 V电泳40 min。用干式转膜仪7 V转膜15 min,将蛋白电转至PVDF膜,用3%奶粉(含0.1%Tween20的PBS缓冲液)室温封闭1 h;加入羊抗体或兔抗体(分别1∶4 000和1∶2 000稀释),室温摇床孵育2 h;PBS-T洗涤3次,每次10 min,加入HRP标记的兔抗羊IgG或HRP标记的羊抗兔IgG(分别1∶10 000和1∶20 000稀释),室温摇床孵育1 h;PBS-T洗涤3次,每次10 min,加入ECL显色后,用化学发光仪进行检测。
1.8 多克隆抗体的纯化 PBS平衡蛋白G亲和层析柱,用PBS对抗血清进行2倍稀释后,上样;PBS洗涤柱子至基线平稳后,用0.1 mol/L pH 2.7甘氨酸溶液洗脱;收集洗脱液,用1 mol/L pH 9.0 Tris溶液平衡pH值后,置10 kD透析袋内,用PBS缓冲液进行透析。
1.9 新型冠状病毒灭活疫苗原液双抗体夹心EL I S A检测方法的初步建立及应用 用碳酸盐包被液(pH 9.6 NaHCO3缓冲液)将已纯化羊多克隆抗体进行15 000倍稀释,加至96孔板,100μL/孔,4℃包被过夜;PBS-T洗涤5次,1%BSA(PBS溶解)37℃封闭1 h;用1%BSA-T(含0.05%Tween20的PBS缓冲液)将新型冠状病毒灭活疫苗原液按总蛋白含量,从64μg/mL进行2倍系列稀释,共12个稀释度,加至封闭后的96孔板,100μL/孔,37℃孵育2 h;PBS-T洗涤5次,加入兔多克隆抗体(1%BSA-T 1∶3 000稀释),37℃孵育1 h;PBS-T洗涤5次,加入HRP标记的羊抗兔IgG(1%BSA-T 1∶5 000稀释),37℃孵育1 h;PBS-T洗涤5次,加入TMB底物,室温显色15 min;1 mol/L H2SO4终止反应,用酶标仪测定A450/630值。用建立的方法对A、B两个厂家各3批新型冠状病毒灭活疫苗原液进行检测。
1.10 结果分析 使用EXCEL 2016和SoftMax 5.0软件进行分析处理并绘图。
2 结果
2.1 抗血清EL I S A效价 结果显示,2只山羊血清抗体效价均在第3次免疫后达到最高,第4次免疫后未再升高;1和2号羊血清抗体效价分别为220 000和70 000,采用1号羊血清进行后续试验。1和2号家兔免疫3次后,血清抗体效价均达到220 000,将两只家兔血清混合,进行后续试验;3和4号家兔3次免疫后血清抗体效价略低,均为70 000。见图1。
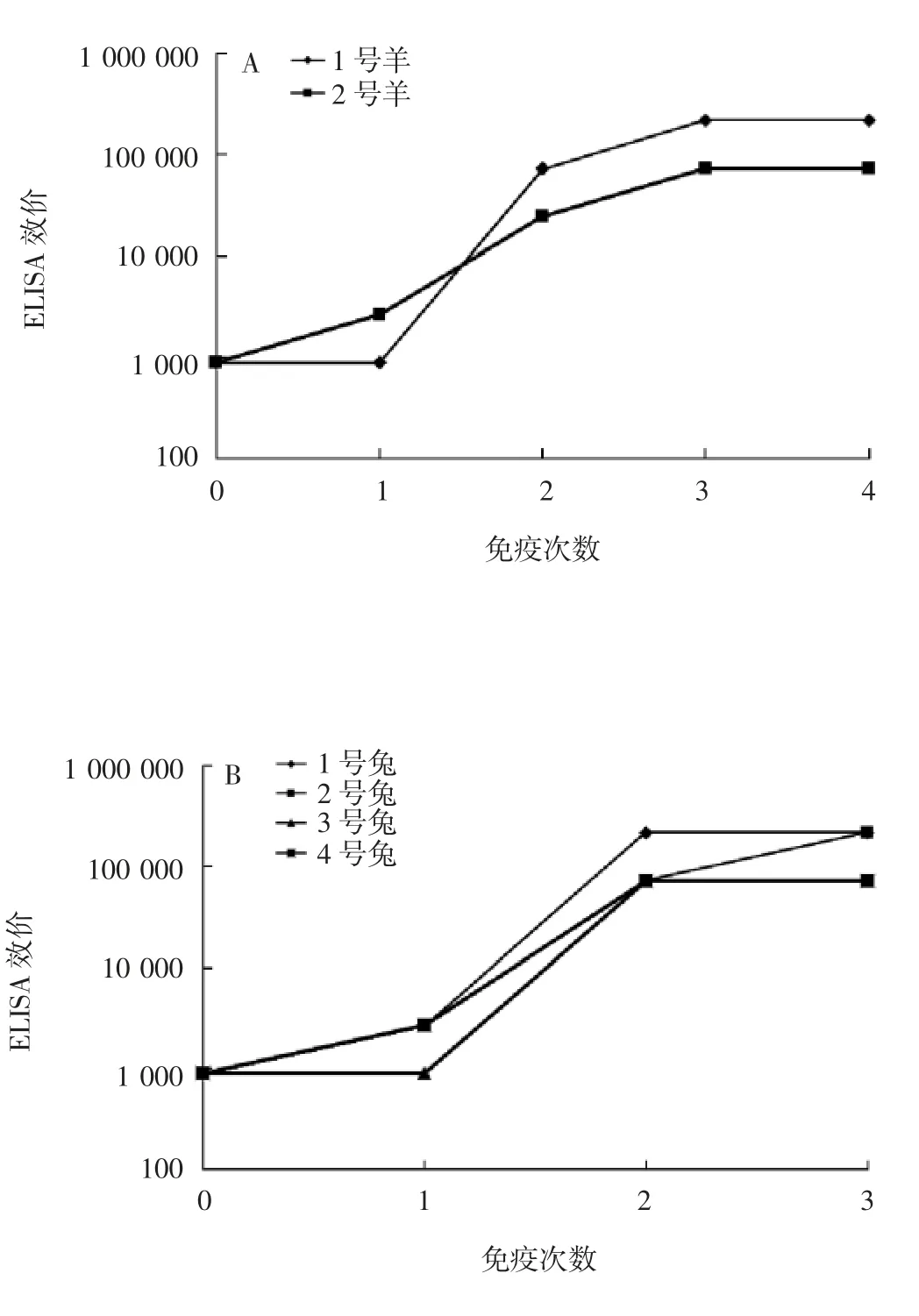
图1 间接ELISA法检测新型冠状病毒重组S蛋白免疫后羊(A)、兔(B)抗血清效价Fig.1 Determination of titers of goat(A)and rabbit(B)antisera against recombination S protein of SARS-CoV-2 by indirect ELISA
2.2 抗血清中和效价 结果显示,2只山羊在初次免疫后1周,均可检测到较低水平中和抗体,第2次免疫后,中和抗体效价增长显著,第3次免疫后,仅略有增长,而第4次免疫后无增长;1号羊中和抗体效价较高,为1 536。4只家兔在初次免疫后,同样均可检测到较低水平中和抗体;第2次免疫后,中和抗体效价显著增长,1号兔达到最高值4 096,第3次免疫后,2号兔也达到4 096;3和4号兔3次免疫后中和抗体效价均为768。见图2。
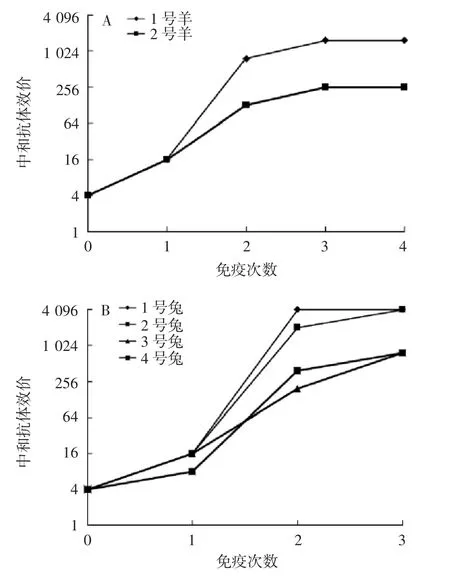
图2 微量中和试验检测新型冠状病毒重组S蛋白免疫后羊(A)、兔(B)抗血清中和效价Fig.2 Determination of titers of goat(A)and rabbit(B)antisera against Sprotein of SARS-CoV-2 by microneutralization assay
2.3 抗体特异性 结果显示,羊和兔抗体均可与新型冠状病毒灭活疫苗原液S蛋白特异性结合,出现2条条带,S蛋白表观相对分子质量约190 000,而S1、S2亚基相对分子质量接近,不能在电泳中得到区分,表观相对分子质量约90 000。见图3。
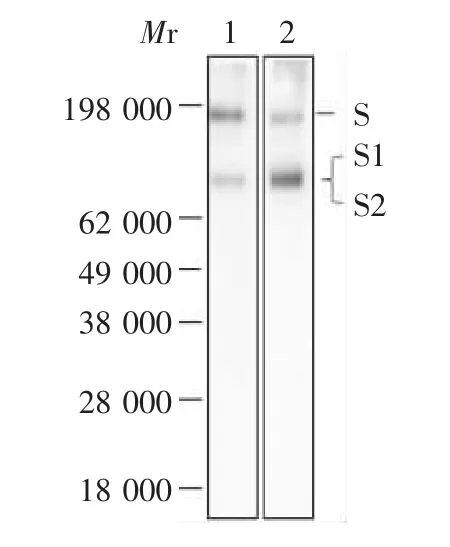
图3 免疫印迹试验检测新型冠状病毒重组S蛋白免疫后羊、兔抗体特异性Fig.3 Test for specificity of goat and rabbit antibodies against recombinant Sprotein by Western blot
2.4 双抗体夹心EL I S A方法的初步建立及应用 新型冠状病毒灭活疫苗原液蛋白含量在0.031~64μg/mL范围内,呈典型四参数曲线,线性较好,R2>0.99,见图4。该方法可用于A、B两个厂家各3批新型冠状病毒灭活疫苗原液抗原含量检测,见表1。
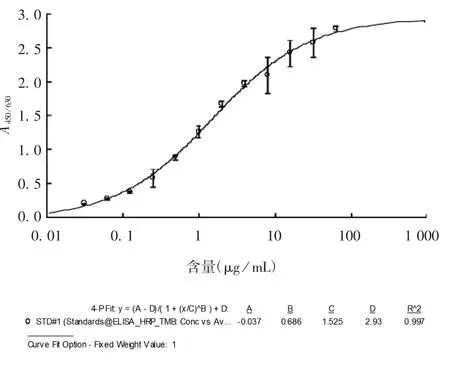
图4 不同抗原浓度下的标准曲线Fig.4 Standard curve at various antigen concentrations

表1 两个厂家新型冠状病毒灭活疫苗原液抗原含量检测结果Tab.1 Determination results of antigen contents in bulks of inactivated SARS-CoV-2 vaccine from two manufacturers
3 讨论
本研究中选择新型冠状病毒重组S蛋白作为免疫原,对羊和兔进行免疫,得到了较高效价的抗血清,并通过蛋白G纯化树脂处理进行纯化,得到S蛋白抗体。免疫印迹结果显示,两抗体均能与灭活疫苗蛋白特异性结合,出现相对分子质量分别约190 000和90 000的2条带。新型冠状病毒全长S蛋白理论相对分子质量为142 000,其表面的部分S蛋白可被furin蛋白酶切割成理论相对分子质量分别为75 000和67 000的S1和S2两个亚基。由于S蛋白的高度糖基化,其表观相对分子质量大于理论相对分子质量,本研究结果也与之前报道的一致[16-17]。
本研究采用羊抗体作为包被抗体,兔抗体作为显示抗体,初步建立了双抗体夹心ELISA方法,该方法线性良好,R2>0.99,并对两个厂家各3批次新型冠状病毒灭活疫苗原液抗原含量进行了检测。本研究制备的抗体已分发至我国多家新型冠状病毒灭活疫苗及重组疫苗研发生产企业,用于抗原检测方法的建立及质量控制研究。

