焦化厂PAHs污染土壤中微生物群落多样性特征
王荔,张腾飞,杨苏才∗,刘志号,苟雅玲,赵倩云,孙仲平,乔鹏炜
1.工业场地污染与修复北京重点实验室,轻工业环境保护研究所
2.煜环环境科技有限公司
多环芳烃(PAHs)具有致癌、致畸、致突变和生物积累、放大等特征,是焦化厂、加油站、储油库等场地中常见的一类持久性有机污染物[1-2],已被美国国家环境保护局(US EPA)列入优先控制污染物名录[3]。土壤环境中PAHs污染来源较广,焦化厂中含PAHs的石油类化合物的遗撒或渗泄漏是重要来源之一[4]。目前已开发出多种有机污染土壤的修复技术,微生物修复技术因其安全、经济、环保等优势,被认为是很有潜力的原位修复技术[5-6]。
受PAHs污染的土壤,其微生物群落组成往往会发生变化[7]:一方面,微生物对有机污染物适应性的遗传机制表明,污染环境中的微生物可以进行选择性富集,逐渐形成能够降解有机污染物的优势菌群;另一方面,优势菌群利用包气带土壤中的PAHs作为微生物可利用碳源或形成共代谢[8]。因此,研究焦化厂土壤中微生物群落结构特征及其影响因素,对PAHs污染土壤微生物修复技术的研发具有重要指导意义[9-11]。
目前,有关石油类污染土壤的微生物学研究大多集中于污染土壤的细菌群落结构解析或PAHs降解菌筛选方面[12-13],对微生物群落结构影响因素的探究较少,但土壤的理化性质及污染物浓度是影响土壤微生物功能多样性的关键因素[14]。因此,笔者以华北某焦化厂为研究对象,随机选取30个土壤样品(0~10 m深度)进行PCR荧光定量和高通量测序,使用统计方法分析土壤中细菌丰度、群落结构与土壤理化指标之间的关系,旨在为焦化厂土壤修复技术研发提供理论依据。
1 材料与方法
1.1 土壤样品的采集与保存
所选华北某焦化厂建于20世纪70年代,占地面积约20 hm2,2018年11月停产搬迁。选择5个采样点(记为A、B、C、D、E)进行土壤样品采集,每个点采样深度分别为 -0.5~0、-2.5~-2.0、-4.5~-4.0、-6.5~-6.0、-8.5~-8.0、-10.5~-10.0 m,用编号1~6表示。采集的土壤样品用无菌袋密封好,放在含有冰袋的样品保存箱中,迅速送回实验室,过2 mm筛后储存于-20℃环境中以备后续分析测试。
1.2 土壤理化性质及PAH浓度测定
土壤PAHs浓度依据文献[15]测定:取2 g干燥土壤样品放入40 mL聚四氟乙烯离心管中,分别加入正己烷和二氯甲烷各15 mL,超声30 min,高速离心10 min,此过程重复3次。离心所得液体经无水硫酸钠过滤后经旋转蒸发仪和氮吹仪浓缩,用二氯甲烷定容至1 mL,然后取200μg液体加入内标物待测。检测仪器为气相色谱-质谱联用仪(GC∕MS),色谱柱为HP-5MS。测定条件:进样口温度为290℃,设置分流进样,分流比为2∶1,进样量为1.0 μL;升温程序为起始温度40℃,保持2 min,以10℃∕min升至240℃,保持3 min,再以5℃∕min升至320℃,保持10 min;质谱为EI电子源,选择Scan模式。土壤pH采用2.5∶1.0的水土比,用pH仪(PHS-3C型)测定,含水率采用烘干法测定[16];土壤总有机碳(TOC)浓度采用TOC分析仪(Elementar,德国)测定,全氮、速效钾、有效磷浓度分别采用凯氏定氮法、火焰光度法及Olsen法测定[17]。
1.3 土壤微生物DNA提取及微生物指标分析
根据土壤DNA提取试剂盒(DNeasy Power Soil Kit)的使用说明,从0.5 g土壤样品中提取微生物总DNA。微生物高通量测序分析委托北京赛奥吉诺生物科技有限公司进行。利用实时荧光定量PCR,检测细菌的基因拷贝数(N),PCR扩增条件参照Gou等[17]方法进行,细菌数量以lgN计。16S rDNA基因的扩增引物为1369F(5′-CGGTGAATACGTTCYCGG)∕1492R(5′-TACGGYTACCTTGTTACGACT),探针为TM1389F(CTTGTACACACCGCCCGTC)。借助Illumina MiSeq v3测序平台研究土壤微生物群落组成,并在门水平上分析与比较污染土壤中细菌群落组成的变化。
1.4 数据处理
使用Excel和SPSS 19.0软件进行相关数据的统计分析,采用CANOCO 4.5软件中的冗余分析(redundancy analysis,RDA)确定环境因子对土壤微生物群落组成的影响。
2 结果与讨论
2.1 土壤样品理化性质
30个土壤样品的理化性质如表1所示。由表1可知,土壤pH、含水率与有机质、有效磷、全氮和速效钾浓度在各土壤样品间存在显著差异。其中,土壤pH为7.22~8.65;TOC浓度为0.61%~4.71%,平均值为1.05%;含水率为0.90%~22.29%,平均值为14.00%;有效磷浓度为0.9~13.4 mg∕kg,平均值为6.9 mg∕kg;全氮浓度为0.12~0.93 g∕kg,平均值为0.47 g∕kg;速效钾浓度为4.18~266.00 mg∕kg,平均值为98.95 mg∕kg。

表1 土壤样品理化性质Table 1 Physicochemical properties of soil samples
土壤样品中PAHs浓度如表2所示。由表2可知,A、E采样点为轻污染区,PAHs浓度为2.05~38.12 mg∕kg;B、D采样点为中污染区,PAHs浓度为2.36~173.64 mg∕kg;C采样点为重污染区,PAHs浓度为2.81~1 256.21 mg∕kg。 整体而言,土壤中PAHs浓度随采样深度增加而降低。土壤中2~3环PAHs在不同采样点占比为9.84%~64.80%,4环PAHs占比为12.06%~56.34%,5~6环PAHs占比为21.34%~73.91%。相对于2~3环PAHs,土壤中4环以上PAHs污染较重。可能是因为低分子量的PAHs易挥发降解,不易积累;高分子量PAHs蒸气压高且生物有效性低,在土壤中积累较多[18]。

表2 土壤样品中PAHs浓度Table 2 PAHs concentrations in soil samples mg∕kg
2.2 土壤中细菌丰度
土壤环境中微生物丰度可反映土著细菌数量的变化规律[19]。5个采样点各分层土壤样品的细菌丰度如图1所示。由图1可知,不同采样点细菌丰度差异较大,轻污染区A、E采样点土壤细菌数量的lgN分别为5.33~7.31和6.60~7.92;中污染区B和D采样点的lgN分别为7.10~7.75和5.48~8.89;高污染区C采样点的lgN为6.63~8.25。

图1 土壤样品中细菌丰度Fig.1 Microbial abundance in soil samples
研究[20]表明,土壤中细菌丰度与土壤环境因子相关性越大,表明微生物对环境变化越敏感。土壤中细菌丰度与土壤各环境因子相关系数如表3所示。由表3可知,土壤中细菌丰度与采样深度呈负相关(R2=-0.739,P<0.01)。Ekelund等[21]的研究表明,表层土壤细菌丰度远高于深层土壤,且随着采样深度增加,细菌丰度随之降低;Taylor等[22]对美国艾奥瓦州和密歇根州的土壤进行表层—中层—深层剖面微生物量分析,发现微生物量随土壤深度增加而显著减少,上述研究与本研究结论一致。本研究中TOC、全氮浓度与细菌丰度呈明显正相关(R2分别为0.403和0.405,P<0.05),不少学者在其他土壤剖面中观察到相似的细菌丰度变化趋势,认为较高的TOC和氮浓度有助于增加土壤微生物量[23-25]。
土壤细菌丰度与PAHs、不同环数PAHs浓度的相关性分析结果表明,细菌丰度与PAHs浓度相关性不显著。排除PAHs浓度异常偏高的C2和C3样品(PAHs浓度分别为1 256.21和925.47 mg∕kg)后,土壤中细菌丰度与PAHs浓度(R2为0.463,P<0.05)、不同环数PAHs浓度均呈正相关(表3)。这可能是因为PAHs虽为降解菌提供可利用生长基质,但微生物对有机污染物的耐受性存在阈值,超过阈值的高浓度PAHs有明显生物毒性[26-28]。土壤中微生物数量与烃类化合物污染程度存在密切关系,一定浓度的PAHs污染可以刺激优势菌群的生长,但当PAHs污染程度较重时,则对微生物产生抑制作用[29]。
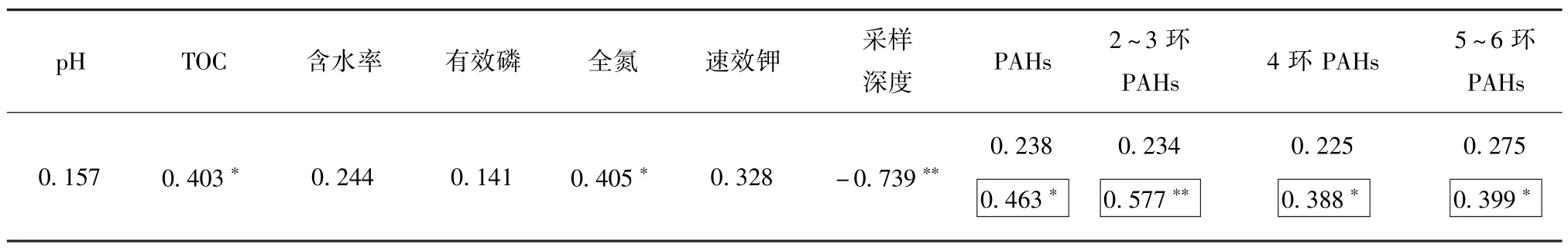
表3 细菌丰度与土壤各环境因子相关系数Table 3 Correlation coefficients between bacterial abundance and soil environmental factors
2.3 土壤微生物群落多样性
不同采样点土壤中细菌类群门水平的相对丰度如图2所示。由图2可知,各采样点土壤微生物群落结构和分布有显著差异。通过门水平下细菌群落组成的比较,能够初步明确土壤样品的优势门类群[30]。变形菌门(Proteobacteria)在土壤样品中占有绝对优势地位,其次是绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和酸杆菌门(Acidobacteria),这5个门细菌数量占门水平分类微生物数量的64%~97%。Sutton等[7]发现Proteobacteria、Firmicutes、Actinobacteria、Acidobacteria和Chloroflexi是烃类污染土壤的主要细菌类群。报道称在有氧或缺氧条件下,参与PAHs代谢和遗传调控的降解菌大多属于这5个门[14,31-32]。值得一提的是,该焦化厂土壤中Proteobacteria相对丰度占比最高达90%,这可能是因为土壤被PAHs污染后,微生物之间发生水平基因转移或在微生物染色体内进行基因重排、突变、复制,由此驯化得到能够降解PAHs的优势细菌[8]。假单胞菌(Pseudomonas)和鞘氨醇单胞菌(Sphingomonads)已被证实是芳香烃的优势降解细菌,可利用脂肪烃类或稠环芳烃类作为唯一碳源和能量来源去除PAHs[33]。Bell等[34]研究表明,Proteobacteria是石油污染土壤的主导微生物,直接参与烃类物质降解。Gou等[35]研究表明,受PAHs污染严重的土壤中,降解PAHs的主要细菌群体为Proteobacteria。此外,Proteobacteria多为化能异养型,具有较高氮素转化和利用能力,通过添加硝酸盐电子受体可刺激该类微生物的生长[36],为有机污染场地微生物修复提供必备条件。

图2 土壤样品中不同细菌类群门水平的相对丰度Fig.2 Relative abundance at phylum level of different bacterial groups in soil samples
2.4 优势细菌类群与环境因子冗余分析
基于土壤细菌类群(门)OTU聚类结果与环境变量进行冗余分析[37],结果如图3所示。由图3可知,该焦化厂土壤环境因子共解释细菌群落变异的33.59%,其中第1主轴(RDA1)和第2主轴(RDA2)分别解释18.31%和15.28%。环境因子与样本相关程度大小依次为pH>K(速效钾)>HIGH(4~6环PAHs)>PAHs>N(全氮)>LOW(2~3环PAHs)>SWC(含水率)>DEPTH(采样深度)>TOC>P(有效磷)。可见,pH与速效钾、PAHs和全氮浓度是影响采样区土壤细菌群落组成的主要驱动因子。Proteobacteria、Bacteroidetes丰度与PAHs、2~3环PAHs、4~6环PAHs、全氮、速效钾、有效磷、TOC浓度呈正相关;Chloroflexi、Acidobacteria丰度与pH、含水率呈正相关;Firmicutes和Actinobacteria丰度与采样深度呈正相关。
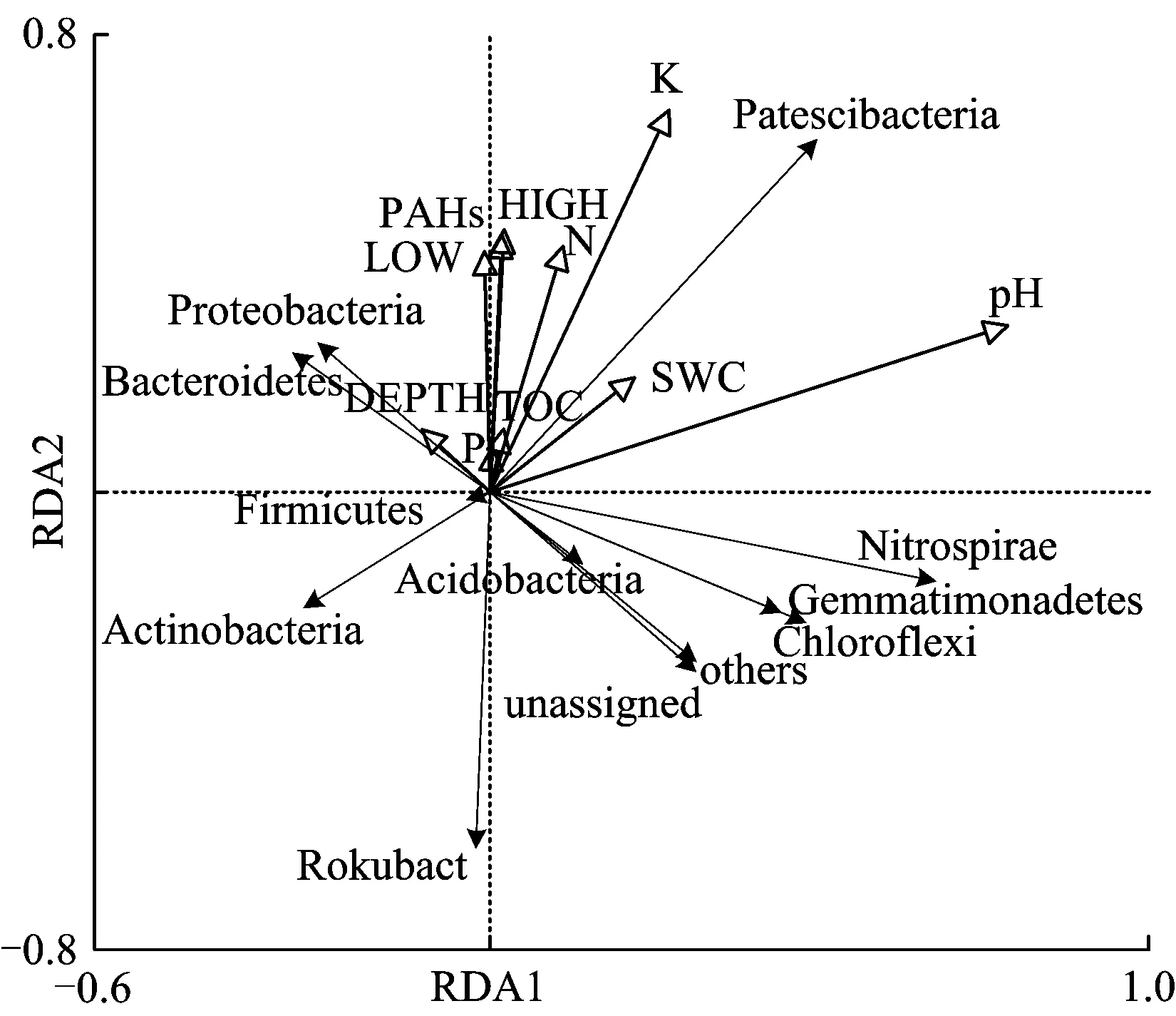
图3 环境因子与细菌群落组成关系的冗余分析Fig.3 Redundancy analysis of relationship between environmental factors and bacterial community composition
国内外有不少学者已关注到土壤理化性质和污染物浓度对不同细菌类群的形成有至关重要的作用[38-40]。土壤含水率、pH、有效磷、全氮、速效钾是土壤微生境的基本组成,对细菌生存有显著影响[41]。其中,pH是影响细菌群落结构的重要驱动因素[42]。本研究冗余分析表明,微生物群落结构受土壤pH影响明显。此外,PAHs可为微生物提供可利用碳源和生长基质,也是影响土壤微生物群落结构的关键因素[43-44]。Proteobacteria、Bacteroidetes丰度与PAHs、2~3环PAHs、4~6环PAHs浓度呈正相关,表明这2个门细菌受PAHs浓度影响较大。Proteobacteria是PAHs的优势降解菌[45],Zhang等[46]研究发现,有氧条件下,α-Proteobacteria和δ-Proteobacteria能有效降解菲;在缺氧条件下,降解菲的优势菌主要为γ-Proteobacteria。β-Proteobacteria能在PAHs污染老化土壤中富集,并在有氧和缺氧环境下均显示较强活性[43]。Proteobacteria作为本研究污染场地土壤的主导微生物,其相对丰度占全部细菌比例最高(达90%),可见,Proteobacteria可能在该焦化厂污染土壤PAHs降解代谢中起到不可忽视的作用。
3 结论
(1)焦化厂土壤样品中细菌数量的lgN为5.33~8.89,其中,表层土壤细菌丰度远高于深层土壤;土壤中细菌丰度与采样深度呈明显负相关,与土壤PAHs、TOC、全氮浓度呈明显正相关。
(2)焦化厂土壤样品中微生物的主要细菌类群(门)为 Proteobacteria、Chloroflexi、Actinobacteria、Firmicutes和Acidobacteria,其占门水平分类细菌数量的64%~97%,其中PAHs优势潜在降解菌Proteobacteria相对丰度占比最高达90%。
(3)焦化厂土壤细菌群落结构特征是PAHs污染和环境因子共同作用的结果,土壤pH与速效钾、PAHs、全氮浓度是该焦化厂土壤细菌群落组成的主要驱动因子;PAHs优势潜在降解菌Proteobacteria丰度受PAHs浓度影响较大,且呈正相关。

