WDR5在肺腺癌中的表达和预后提示作用研究
孙平 徐俊
肺癌是目前全球发病率最高的癌症之一,也是全球癌因性死亡的首要原因之一[1]。据文献报道,每年的新增肺癌病例数正在不断增加[2]。通常临床上将肺癌分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞型肺癌(non small cell lung cancer,NSCLC)两大类,其中NSCLC约占所有肺癌的75%~85%[3]。NSCLC主要包括腺癌、鳞癌、大细胞肺癌等组织学类型。近年来,腺癌的比例逐渐增多并超过了鳞癌成为最常见的肺癌组织类型,约占所有肺癌的40%[1]。肺腺癌的预后较差,全球每年因肺腺癌病死的患者数超过50万例[4]。WD 重复域蛋白5(WD repeat-containingprotein 5,WDR5)是WD-40蛋白家族的主要成员[5],参与各种细胞生理过程[6]。近年来有多项研究着眼于WDR5基因在肿瘤细胞中的作用,并取得了不小的进展。如有研究发现在低氧刺激的肿瘤微环境乳腺癌细胞模型中,WDR5可诱导上皮-间充质转化的发生[7]。另外,WDR5还在胃癌、结直肠癌、白血病、前列腺癌等[8-11]多种肿瘤中通过多种途径发挥作用。目前,国内外尚鲜见涉及肺腺癌组织中WDR5表达及其临床意义的相关实验研究。因此本研究通过免疫组化方法检测肺腺癌及癌旁组织中的WDR5的表达,分析WDR5表达与肺腺癌发生、发展的关系,探讨WDR5表达水平对患者预后评估的价值。
1 对象和方法
1.1 对象 选取2010年1月1日至2014年2月8日于杭州市第三人民医院胸外科就诊且术后病理检查结果证实为肺腺癌的患者93例,其中男41例,女52例,年龄 20~84(60.5±10.7)岁,60岁及以上 50 例,60岁以下43例。所有患者术前均未接受放疗或化疗。本研究经本院医学伦理委员会批准,所有患者均知情同意。
肿瘤分期依据AJCC第七版临床分期。癌旁正常组织标准:距肿瘤边缘>2 cm,且病理结果为正常组织。手术切除肺腺癌组织标本经10%中性甲醛溶液固定后送病理科,连续石蜡切片后行HE染色,所有病理切片均经至少2位病理医师分别确诊。病理分级根据UICC 2010年第七版肺癌病理分期标准。
1.2 主要试剂及仪器 兔抗人WDR5单克隆抗体购自英国Abcam公司;EnvisionTM试剂盒以及二氨基联苯胺盐酸盐(DAB)显色试剂盒均购自丹麦DAKO公司;超薄石蜡切片机以及病理组织烘漂处理仪购自德国Leica公司;光学显微镜(型号:BX41)以及病理大体标本成像系统均购自日本OLYMPUS公司。
1.3 实验方法 选取所有患者肺腺癌及其对应癌旁正常组织石蜡块进行免疫组织化学染色(EnVision法),以抗体稀释液替代WDR5抗体作为空白对照,以乳腺癌组织切片作为阳性对照。
1.4 免疫组化阳性结果判定标准 肺腺癌及其癌旁正常组织WDR5染色阳性表现为镜下肿瘤细胞胞质和细胞核出现棕黄色或棕褐色颗粒。首先在100倍光镜下挑选实质肿瘤区域,然后在200倍光镜下随机挑选5个视野并拍照。根据染色强度进行评分:阴性=0,弱阳性=1,中等阳性=2,强阳性=3。阳性染色细胞数分级为:<10%(阴性=0),10%~<30%(弱阳性=1),30%~<50%(中等阳性=2),≥50%(强阳性=3)。计算每个视野的得分之和,取其平均值作为WDR5的相对表达水平:≥3时判定为WDR5相对高表达,<3时判定为WDR5低表达。
1.5 统计学处理 采用SPSS 20.0统计软件。计数资料用率表示,组间比较采用χ2检验。采用Cox比例风险回归模型对患者的生存情况作单因素、多因素分析,采用Kaplan-Meier法绘制生存曲线,采用log-rank检验比较WDR5高表达与低表达患者1、3及5年生存率。P<0.05为差异有统计学意义。
2 结果
2.1 肺腺癌组织和癌旁正常肺组织中WDR5的表达水平比较 53例(57.0%)患者肺腺癌组织中WDR5相对高表达,40例(43.0%)WDR5相对低表达;30例(32.3%)癌旁正常组织中WDR5相对高表达,63例(67.7%)WDR5相对低表达,与癌组织比较差异有统计学意义(P<0.01),见图1(插页)。此外,WDR5相对高表达的30例癌旁正常组织相对应的癌组织全部呈WDR5相对高表达。
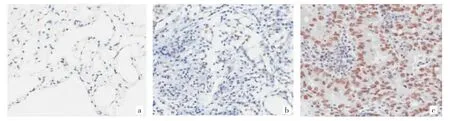
图1 肺腺癌组织和癌旁正常肺组织中WD重复域蛋白5(WDR5)的表达情况(a:癌旁正常组织WDR5相对低表达,×200;b:肺腺癌组织WDR5相对低表达,×200;c:肺腺癌组织WDR5相对高表达,×200;免疫组化染色)
2.2 WDR5在肺腺癌组织中的表达与临床特征的关系 肺腺癌组织中WDR5的表达与患者的性别、年龄、肿瘤直径、T分期、病理分级均无关(均P>0.05);但与N分期和肿瘤分期均相关(均P<0.01)。在WDR5相对高表达组(53例)中,淋巴结转移阳性35例、阴性18例,Ⅰ/Ⅱ期43例、Ⅲ/Ⅳ期10例;而WDR5相对低表达组(40例)中,淋巴结转移阳性14例、阴性26例,Ⅰ/Ⅱ期19例、Ⅲ/Ⅳ期21例;两组比较差异均有统计学意义(均P<0.01),见表1。

表1 WDR5在肺腺癌组织中的表达与临床特征的关系[例(%)]
2.3 肺腺癌预后影响因素分析 单因素分析结果显示,WDR5表达、N分期和肿瘤分期均是肺腺癌患者预后的影响因素(均P<0.01),见表2。进一步多因素分析结果显示,WDR5表达和N分期是肺腺癌患者预后的独立影响因素(均P<0.01),见表3。

表2 肺腺癌预后影响因素的单因素分析

表3 肺腺癌预后影响因素的多因素分析
2.4 肺腺癌组织中WDR5的表达与预后的关系 本组患者中有3例生存时间仅为2个月,其中1例肺腺癌组织中WDR5相对高表达,余2例WDR5相对低表达。53例WDR5相对高表达患者的平均1年生存率为86.8%,3年生存率为41.5%,5年生存率为9.4%;40例WDR5相对低表达患者的平均1年生存率为95.0%,3年生存率为80.0%,5年生存率为55.0%,两者比较差异有统计学意义(P<0.01),见图2。上述结果提示WDR5的表达与肺腺癌患者的预后相关。

图2 肺腺癌组织中WD重复域蛋白5(WDR5)高表达与低表达患者的生存曲线
3 讨论
我国肺癌的发病率和死亡率均居所有恶性肿瘤前列[12],其中肺腺癌约占所有肺癌的40%[13]。尽管新的治疗手段及药物在不断的提出并应用,但肺癌的死亡率仍然没有明显改善[1]。大部分肺癌患者诊断时就已经处于中晚期[14],其中NSCLC初次确诊患者中ⅢA期占16%,ⅢB期占 8%,Ⅳ期患者占 41%[2,15]。因此,探索肺癌进展的分子机制,对改善肺癌预后至关重要。
WDR5是人组蛋白甲基转移酶(mixed lineage leukaemia,MLL)1~4组蛋白第三亚基四号赖氨酸甲基转移酶复合物的核心亚基[16],在恶性肿瘤中扮演了重要角色。在促进肿瘤发生、发展方面,WDR5可以将MLL募集到增强子上并调节其活性,导致白血病基因和白血病的激活[17]。WDR5通过维持肿瘤细胞的DNA复制,促进胰腺导管腺癌的细胞增殖以及肿瘤发展[18]。WDR5在人类前列腺癌组织中过度表达,其不仅诱导前列腺癌细胞的增殖,并且能驱动前列腺癌细胞发展出去势抗性[19]。在促进肿瘤转移方面,WDR5可诱导乳腺癌细胞表皮-间充质转换现象的发生[7]。另外,WDR5可以上调淋巴管生成因子的表达,从而导致膀胱癌组织内淋巴管生成以及淋巴结转移[20]。然而,WDR5基因在肺癌内的研究正处于初始阶段,这将是肺癌基础研究的一个重要方向。
本研究主要涉及的是WDR5基因在肺腺癌内的表达特征以及其与肺癌临床病例特征和预后间的相关性研究,这是研究WDR5基因在肺癌发生、发展中作用的初步探索。本研究显示,WDR5在肺腺癌组织中的表达水平高于癌旁正常肺组织。WDR5高表达与更高的N分期、肿瘤分期相关。但WDR5的表达与性别、年龄、T分期、病理分级和肿瘤直径无相关性。提示WDR5在肺腺癌中扮演了促癌基因的角色,其通过促进肺腺癌的淋巴结转移来促进肺腺癌的生物学进展。此外,Cox单因素和多因素分析结果均表明WDR5高表达与更差的预后相关,提示WDR5是肺腺癌的独立危险因子,进一步研究WDR5如何促进肺腺癌进展意义巨大。生存分析的结果同样表明,相较于低表达WDR5基因的肺腺癌患者来说,WDR5基因表达较高的患者通常拥有更差的预后。
综上所述,WDR5在肺腺癌中的表达明显升高,并与淋巴转移及更差的预后相关,提示WDR5基因可能通过促进肺腺癌转移来参与肿瘤进展,是肺腺癌可靠的预后指标以及潜在的治疗靶点。

