MTHFD2对人肝癌细胞凋亡的影响及其作用机制研究
严万能 马海洁 乐婷 陈冬冬 李世波 张国强 王婕
肝癌是全球常见的恶性肿瘤之一,其中肝细胞癌(hepatocellular carcinoma,HCC)死亡人数居世界癌症致死人数第3位,发病率列第6位[1]。随着近代分子生物学研究的进展,分子靶向治疗已成为除手术、放疗、化疗以外的第4种主要肿瘤治疗方式,并且相比传统化疗药物具有靶向性强和不良反应少的优点。目前索拉非尼和仑伐替尼已成为治疗晚期HCC的一线靶向用药,但其耐药性导致患者的5年生存率并不理想[2-3]。因此,寻找更加有效的HCC治疗靶标有着重要的临床意义。
在HCC发生、发展过程中,肝脏的一系列特异性代谢功能受损的同时又获得了新的代谢特征,肿瘤细胞恶性程度随之升高[4],其中叶酸循环是主要的代谢失调通路之一[5]。叶酸循环涉及的主要代谢酶有亚甲基四氢叶酸脱氢酶1(methylenetetrahydrofolate dehydrogenase 1 like,MTHFD1L)、亚甲基四氢叶酸脱氢酶2(methylenetetrahydrofolate dehydrogenase 2,MTHFD2)及丝氨酸羟甲基转移酶2(serine hydroxymethyl transferase 2,SHMT2)等,其中MTHFD2是一种位于线粒体中的烟酰胺腺嘌呤二核苷酸磷酸依赖性双功能酶,在线粒体叶酸代谢中呈高表达水平[6]。近年来多项研究表明MTHFD2的过表达可促进乳腺癌、结肠癌、胶质瘤等类型肿瘤的发生和发展,而关于MTHFD2对HCC细胞凋亡进程的影响仍是未知[7-10]。因此,本研究探讨MTHFD2对人HCC细胞凋亡的影响及其分子机制,以期为HCC患者的临床治疗研究开辟新的方向。
1 材料和方法
1.1 材料
1.1.1 细胞系与培养方式 人HCC细胞系HepG2和SMMC-7721均来自舟山医院细胞分子生物实验室;FBS与胰酶均购自美国Gibco公司,DMEM高糖培养基购自美国Hyclone公司。培养方式为含10%FBS的DMEM高糖培养基于37°C、5%CO2的细胞培养箱内培养,48 h后0.25%胰酶消化传代。
1.1.2 抗体 兔源单克隆抗体MTHFD2(1∶1 000)、酶原型聚二磷酸腺苷-核糖聚合酶(Pro PARP)、剪切型聚二磷酸腺苷-核糖聚合酶(Cleaved PARP)、酶原型半胱天冬酶 3(Pro Caspase-3)、剪切型半胱天冬酶 3(Cleaved Caspase-3)、酶原型半胱天冬酶 7(Pro Caspase-7)、剪切型半胱天冬酶7(Cleaved Caspase-7)、p53正向凋亡调节因子(Puma)、BH3交叉域互作介导蛋白(Bim)、BH3交叉域死亡受体激动蛋白(Bid)、BH3关联死亡启动子(Bad)、BH3交叉域互作杀伤蛋白(Bik)、BH3关联 K 蛋白(Bak)、BH3关联 X蛋白(Bax)、辣根过氧化物酶标记山羊抗兔IgG二抗均购自美国Cell Signaling Technology公司;β-actin购自美国Sigma-Aldrich公司。
1.1.3 试剂 MTHFD2-siRNA#1、MTHFD2-siRNA#2、Puma-siRNA、阴性对照剂Ctrl-siRNA均由广州锐博生物有限公司合成;Lipo3000转染试剂购自美国Thermo Fisher公司;流式细胞凋亡检测试剂盒购自美国BD公司;CCK-8检测试剂盒购自中国Biosharp生物有限公司;ECL检测试剂盒购自美国Thermo Fisher公司。siRNA序列如下:MTHFD2-siRNA#1 5'-GGAAGGAG CAGCAGTCATT-3',MTHFD2-siRNA#2 5'-GGATCAGTATTCCATGTTA-3';Puma-siRNA 5'-GCCUG UAAGAUACUGUAUA。
1.2 方法
1.2.1 细胞分组 将对数生长期的HepG2和SMMC-7721细胞随机分为siMTHFD2#1组、siMTHFD2#2组和siCtrl组3组。各组常规培养24 h,用Lipo3000分别转染 MTHFD2-siRNA#1、MTHFD2-siRNA#2 及 Ctrl-siRNA。另将对数生长期的SMMC-7721细胞随机分为siMTHFD2+siPuma组、siMTHFD2组、siPuma组和 siNC组4组,培养24 h后分别进行MTHFD2-siRNA和Puma-siRNA共转染、MTHFD2-siRNA转染、PumasiRNA转染、Ctrl-siRNA转染。
1.2.2 MTHFD2、凋亡通路相关蛋白、B淋巴细胞瘤-2(Bcl-2)家族蛋白表达水平检测 采用Western blot法。转染72 h后收集不同处理组的细胞,RIPA裂解液提取细胞总蛋白。经过10%SDS-PAGE凝胶电泳后,将蛋白转至0.45 μm PVDF膜上。5%脱脂奶粉封闭1 h,一抗4°C孵育过夜,TBST洗膜5 min,3次后二抗室温孵育1 h,TBST洗膜5 min,3次。ECL发光液孵育,显影曝光后利用Image J 1.8.0进行灰度分析。目的蛋白表达水平=目的蛋白条带灰度值/β-actin内参条带灰度值。实验重复3次,取平均值。
1.2.3 细胞凋亡率检测 采用流式细胞术。转染72 h后收集不同处理组的细胞,预冷PBS洗涤后加入结合缓冲液混匀。每组细胞各加膜粘连蛋白5(Annexin V)和碘化丙啶(propidium iodide,PI)染液,室温避光孵育20 min后流式细胞仪检测,以Annexin V阳性的凋亡细胞比例作为凋亡率进行统计。实验重复3次,取平均值。
1.2.4 细胞增殖能力检测 采用CCK-8实验。将转染72 h后不同处理组的细胞以2×103个/孔种于96孔板,每组设3个复孔,放入细胞培养箱中培养。分别于24、48、72、96 h加入 10%CCK-8试剂,37 °C 培养 2 h后利用酶标仪于450 nm处检测光密度(OD)值,绘制细胞生长曲线。实验重复3次,取平均值。

2 结果
2.1 3组HepG2和SMMC-7721细胞中MTHFD2表达水平比较 HepG2和SMMC-7721细胞中siMTHFD2#1组和siMTHFD2#2组的MTHFD2表达水平均明显低于siCtrl组,差异均有统计学意义(均 P<0.01),见表 1、图 1。

图1 3组HepG2和SMMC-7721细胞中亚甲基四氢叶酸脱氢酶2(MTHFD2)表达的电泳图

表1 3组HepG2和SMMC-7721细胞中MTHFD2表达水平比较
2.2 3组HepG2和SMMC-7721细胞凋亡率比较 HepG2和SMMC-7721细胞中siMTHFD2#1组和siMTHFD2#2组的细胞凋亡率均明显高于siCtrl组,差异均有统计学意义(均 P<0.01),见表 2、图 2。
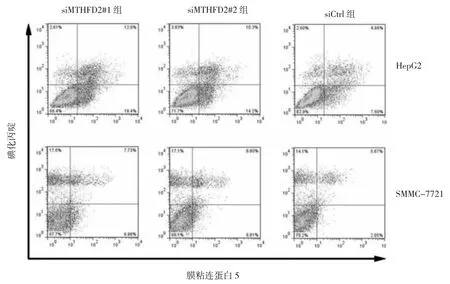
图2 3组HepG2和SMMC-7721细胞凋亡率的流式细胞图

表2 3组HepG2和SMMC-7721细胞凋亡率比较(%)
2.3 3组HepG2和SMMC-7721细胞凋亡通路相关蛋白表达水平比较 与siCtrl组比较,siMTHFD2#1组和siMTHFD2#2组HepG2和SMMC-7721细胞的Cleaved Caspase3/Pro Caspase3、Cleaved Caspase7/Pro Caspase7 比值均明显升高,siMTHFD2#1组和siMTHFD2#2组SMMC-7721细胞的Cleaved PARP/Pro PARP比值均明显升高,差异均有统计学意义(均 P<0.05)。见图 3、表 3、4。

表3 3组HepG2细胞凋亡通路相关蛋白表达水平比较

表4 3组SMMC-7721细胞凋亡通路相关蛋白表达水平比较

图3 3组HepG2和SMMC-7721细胞凋亡通路相关蛋白表达的电泳图(Pro为酶原型蛋白;Cleaved为剪切型蛋白;PARP为聚二磷酸腺苷-核糖聚合酶;Caspase-3为半胱天冬酶3;Caspase-7为半胱天冬酶7)
2.4 3组SMMC-7721细胞Bcl-2家族蛋白表达水平比较 与siCtrl组比较,SMMC-7721细胞siMTHFD2#1组和siMTHFD2#2组中Puma表达水平均明显升高,差异均有统计学意义(均 P<0.01),3 组 Bim、Bid、Bad、Bik、Bak、Bax表达水平比较差异均无统计学意义(均P>0.05),见表 5、图4。

图4 3组SMMC-7721细胞Bcl-2家族蛋白表达的电泳图(Bcl-2为B淋巴细胞瘤-2;Puma为p53正向凋亡调节因子;Bim为BH3交叉域互作介导蛋白;Bid为BH3交叉域死亡受体激动蛋白;Bad为BH3关联死亡启动子;Bik为BH3交叉域互作杀伤蛋白;Bak为BH3关联K蛋白;Bax为BH3关联X蛋白)
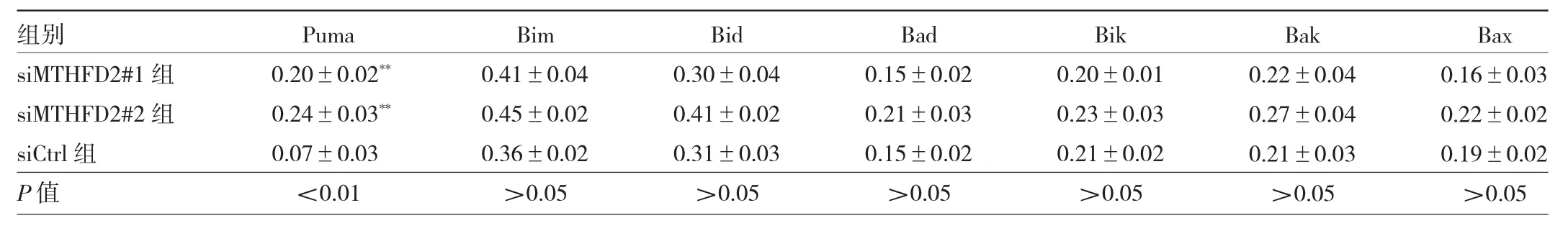
表5 3组SMMC-7721细胞Bcl-2家族蛋白表达水平比较
2.5 4组SMMC-7721细胞增殖能力比较 在96 h的时间点,siMTHFD2组OD值低于siNC组,而siMTHFD2+siPuma组的OD值则明显高于siMTHFD2组,差异均有统计学意义(均 P<0.01),见表 6、图 5。

图5 4组SMMC-7721细胞增殖能力比较(OD为光密度)

表6 4组SMMC-7721细胞增殖能力比较
2.6 4组SMMC-7721细胞凋亡率比较 siMTHFD2组凋亡率高于siNC组,siMTHFD2+siPuma组则明显低于siMTHFD2组,差异均有统计学意义(均P<0.01),见表7、图 6。
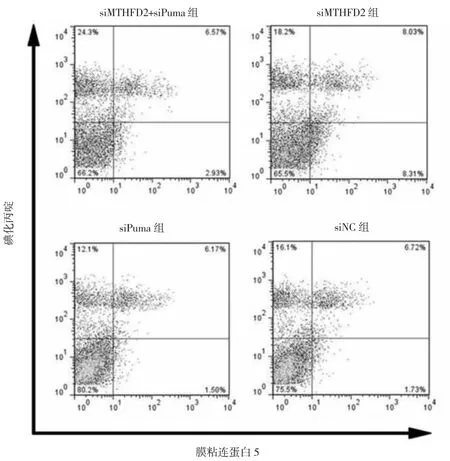
图6 4组SMMC-7721细胞凋亡率的流式细胞图

表7 4组SMMC-7721细胞凋亡率比较(%)
3 讨论
MTHFD2作为线粒体叶酸循坏代谢中的关键酶,目前在结肠癌、肺癌、胶质瘤等癌症中均有其关于细胞增殖、凋亡、耐药等方面的研究,但目前对HCC细胞凋亡过程中MTHFD2功能及调控机制的探讨仍是空白[11-12]。本研究结果发现,敲低MTHFD2表达后人HCC细胞HepG2和SMMC-7721都呈现出明显的凋亡表型,细胞凋亡关键因子Cleaved PARP、Cleaved Caspase-7、Cleaved Caspase-3的表达均被激活,表明敲低MTHFD2表达能促进HCC细胞凋亡。
细胞凋亡是一种细胞的程序化死亡进程,Bcl-2蛋白家族与p53蛋白是多数细胞中重要的凋亡调节因子。Puma属于Bcl-2蛋白家族BH3亚族,是p53诱导细胞进入凋亡过程中的关键下游蛋白,介导由线粒体细胞色素C释放所激活的内源性凋亡途径。有研究表明激活p53-Puma-BAX/Bcl-2通路将导致非小细胞肺癌凋亡并抑制细胞生长[13]。本课题组研究发现,敲低MTHFD2表达后HCC细胞的Puma表达水平明显上升,进一步将Puma表达下调后,MTHFD2敲低所导致的促凋亡现象被明显抑制,在分子水平上揭示MTHFD2是通过调控Puma表达从而促进HCC细胞凋亡。这可能是由于肿瘤细胞自身的代谢特性使其长时间处于高浓度活性氧的环境中,当活性氧剂量增加则会进一步激活p53蛋白,从而抑制细胞周期,启动凋亡进程[14]。而MTHFD2能通过平衡叶酸代谢中的氧化还原反应降低活性氧含量,从而抑制了p53-Puma信号轴,最终阻断肿瘤细胞的凋亡进程[15]。
由于HCC早期诊断、治疗和相关基础研究的发展,其术后生存率已有一定提高,但HCC的整体治疗效果仍较差,因此寻找能够有效阻滞肿瘤细胞恶性进程,进而提高HCC患者生存率的分子靶标也成为了亟待解决的临床研究课题。Pikman等[16]的研究小组在急性髓系白血病(AML)中的研究中表明,靶向MTHFD2能够抑制AML细胞生长和集落形成,延长患者生存期。Kawai等[17]研究结果报道,口服的MTHFD2抑制剂DS18561882能够在小鼠乳腺癌细胞异体移植模型中有效抑制肿瘤的生长。而本研究揭示,MTHFD2敲低后能够通过下游分子Puma诱导HCC细胞进入凋亡程序,这一研究结果表明MTHFD2具有成为治疗HCC有效分子靶标的潜在临床应用价值。在后续的研究中,本研究团队将在动物水平和临床样本两方面进行进一步论证,充分解析MTHFD2在HCC中的功能及相关分子机制。
综上所述,敲低MTHFD2的表达能够促进HCC细胞凋亡,这可能是通过上调Puma的表达水平来实现的。提示MTHFD2可作为靶点进而应用于临床HCC治疗,为肿瘤患者的临床治疗研究开辟了新的方向。

