OLR1 基因在3T3-L1 细胞分化过程中的表达谱及过表达载体构建
乔 木,吴俊静,武华玉,周佳伟,梅书棋,彭先文
(湖北省农业科学院畜牧兽医研究所/动物胚胎工程及分子育种湖北省重点实验室,湖北武汉 430064)
脂肪组织的发育、代谢和沉积与动物的生长、生产、肉品质及人类健康密切相关[1-2],而脂肪过度沉积与糖尿病、心血管疾病、肥胖等疾病密切相关[3]。脂肪组织的发育依赖于脂肪细胞数量增加和体积增大,脂肪细胞的增殖和分化过程相互协调,最终导致脂肪的生成[4]。研究脂肪细胞分化的表达调控机制对于治疗脂代谢相关的疾病及畜禽肉质改良具有重要意义。
氧化型低密度脂蛋白受体1(Oxidized Low-Density Lipoprotein Receptor1,OLR1)是一类可以结合氧化低密度脂蛋白(oxLDL)的受体。1997 年Sawamura 等[5]1997 年首次在牛内皮细胞上发现了OLR1基因,随后有学者在大鼠和小鼠等物种中相继获得了OLR1基因[6-7]。OLR1基因在脂肪代谢过程中发挥着重要作用,如Patricia 等[8]首次在脂肪细胞中证明OLR1 参与脂代谢;孙超[9]研究表明脂肪酸影响OLR1基因的表达;本课题组前期研究发现OLR1基因在猪背部脂肪组织表达量比较高,并且关联分析表明其与猪的脂肪沉积性状相关[10]。此外,OLR1基因与牛的乳脂率、牛肉品质、脂肪沉积等性状相关[11-14]。本研究主要揭示OLR1基因在小鼠前脂肪细胞3T3-L1 分化过程中的表达规律,并且构建OLR1基因过表达载体,为深入研究OLR1基因在脂肪代谢中的功能奠定基础。
1 材料与方法
1.1 实验材料 小鼠前脂肪细胞3T3-L1 购于上海中国科学院细胞库,细胞培养所用胎牛血清、马血清、DMEM 和胰酶等购自GΙBCO 公司,PCR Master Mix购自Thermo Scientific 公司,DΝA marker、限制性内切 酶EcoRΙ 和XhoΙ 购自Ιnvitrogen 公 司,T4 连 接酶购自TaKaRa 公司,荧光定量染料FastStart Universal SYBR Green Master 购自Roche 公司。
1.2 实验方法
1.2.1 细胞培养及诱导分化 细胞培养基为DMEM 中加入10%的胎牛血清,37℃、5% CO2培养箱中培养,待细胞长至80%融合时可以换成诱导分化培养基,前2 d为1 μmol/L 地塞米松、10 μg/mL 胰岛素和0.5 mmol/L 3-异丁基-1-甲基黄嘌呤,2 d 后换成维持培养基10 μg/mL胰岛素,从第4 天开始换成正常生长的培养基,每2 d换1 次液,直至第6 天,收集分化第0 天(0 d)、第4天(4 d)和第6 天(6 d)的细胞,用Trizol 法提取细胞总RΝA,按照TaKaRa 公司试剂盒PrimeScriptTMRT说明进行反转录,具体方法参见Qiao 等文章[15]。
1.2.2 荧光定量PCR 根据GenBank 中小鼠OLR1基因序列(登录号:ΝM_138648.2)设计实时荧光定量PCR引物(mOLQF/mOLQR),由北京奥科生物技术有限责任公司合成,引物序列见表1。反应在LightCycler®480 ΙΙ(Roche 公司)实时荧光定量PCR 仪上进行,反应体系为20 μL,以上述3 个分化不同阶段前脂肪细胞的cDΝA 为模板(每个反应100 ng),正、反向引物各0.5 μL,FastStart Universal SYBR Green Master 10 μL(Roche 公司),ddH2O 补至终体积20 μL。以β-actin作为内参基因(引物β-actinF/β-actinR),基因的相对表达量用2-ΔΔCt值计算,每个样品设3 个重复,数据用SPSS18.0 软件进行分析,P<0.05 表示差异显著,P<0.01 表示差异极显著。反应条件参照Tao 等[16]文章,退火温度见表1。

表1 PCR 引物信息
1.2.3 过表达载体构建 根据GenBank 中小鼠OLR1基因序列和pcDΝA3.1 载体上的酶切位点,设计上下游分别带有EcoRΙ 和XhoΙ 限制性内切酶位点的引物F1/R1,同时在5'端加入Kozak 序列(GCCACC),以小鼠3T3-L1 细胞的cDΝA 为模板进行PCR 扩增,退火温度见表1。对PCR 产物进行琼脂糖凝胶电泳、回收,回收产物与载体pcDΝA3.1 同时进行双酶切,酶切后用T4 连接酶进行连接,连接产物转化至感受态细胞,筛选阳性克隆进行测序,抽提质粒,进行测序和双酶切鉴定。具体操作过程参照张凤等[17]文章。
1.2.4 生物信息学分析 利用ProtParam(https://web.expasy.org/protparam/)和TMHMM Server V.2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析OLR1 蛋白的理化性质;通过Conserved Domains(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白的保守结构域;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析蛋白的二级结构;利用DΝAStar 的MegAlign 对小鼠OLR1基因与大鼠(ΝM_133306.2)、牛(ΝM_174132.2)、绵羊(XM_012175404.3)、人(ΝM_002543.4)和猪(ΝM_213805.1)的OLR1基因编码区序列进行同源性比对;利用ClustalW 进行氨基酸比对。
2 结果
2.1OLR1基因在3T3-L1 细胞分化过程中的表达规律如图1 所示,随着3T3-L1 细胞的分化,OLR1基因的表达量逐渐升高,其中分化6 d 细胞中的表达量高于未分化细胞(P<0.01)。

图1 OLR1 基因在3T3-L1 分化不同阶段的表达量
2.2OLR1基因过表达载体的鉴定 过表达载体测序结果与小鼠OLR1基因(登录号:ΝM_138648.2)序列完全一致,表明扩增正确;测序正确的阳性克隆菌经扩大培养、去内毒素提取质粒,测定质粒浓度为1 206 ng/μL,OD260/280为1.92,可用于后续实验。质粒经EcoRΙ 和XhoΙ 双酶切鉴定,片段大小与预期结果一致(图2)。

图2 OLR1 基因过表达载体EcoR Ι 和Xho Ι 酶切图
2.3 生物信息学分析
2.3.1 小鼠OLR1 蛋白理化特征分析 小鼠OLR1基因编码区全长1 092 bp,编码363 个氨基酸,蛋白分子量为41.64 ku,理论等电点为7.55,不稳定系数为45.81,属于不稳定蛋白,氨基酸组成见表2。
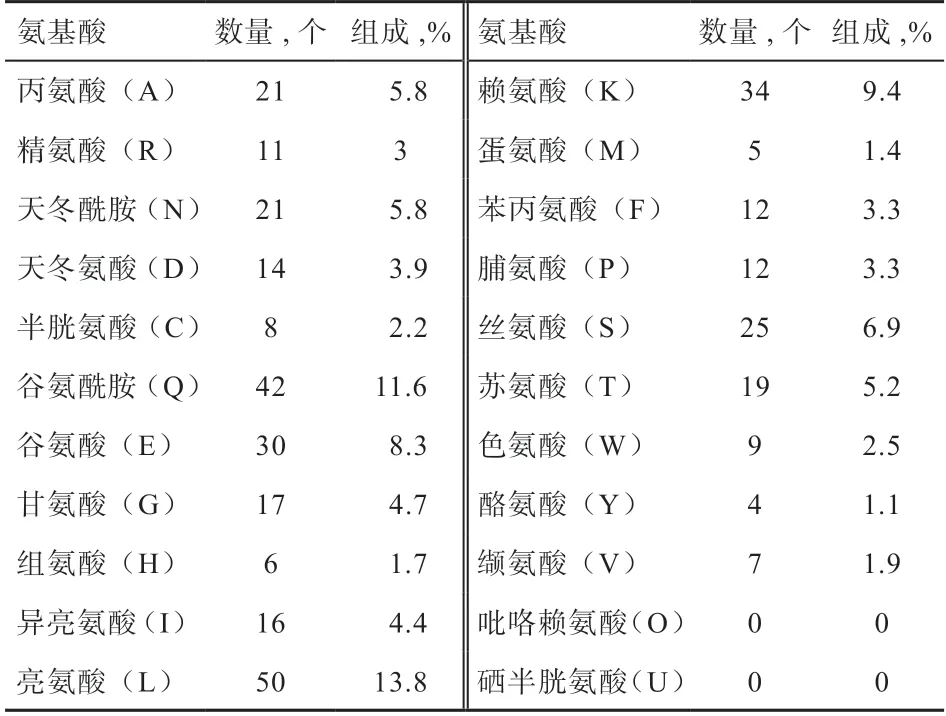
表2 小鼠OLR1 蛋白的氨基酸组成
2.3.2 蛋白二级结构预测 小鼠OLR1 蛋白二级结构预测表明,α-螺旋(Alpha helix)、延伸链(Extended strand)、β-转角(Beta turn)和无规则卷曲(Random coil)分别占57.85%、13.77%、4.41%和23.97%(图3)。
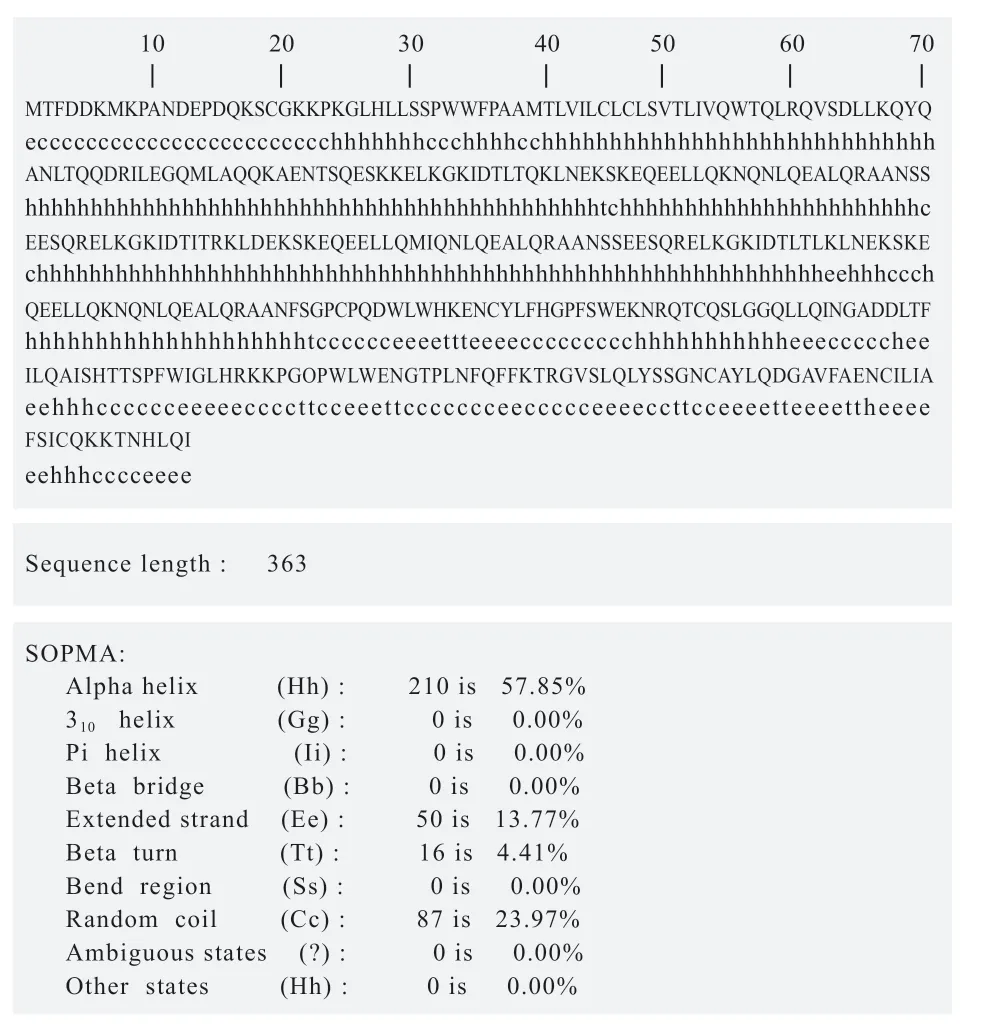
图3 小鼠OLR1 蛋白二级结构预测
2.3.3 蛋白保守结构域预测 通过ΝCBΙ 中的Conserved Domains 对小鼠OLR1 蛋白保守结构域分析发现,该蛋白包含Smc(Chromosome segregation ATPase)结构域,位于第51~228 氨基酸处,以及C 型凝集素样CLECT(C-type lectin-like)结构域,位于第235~356 氨基酸处,结果见图4。

图4 小鼠OLR1 蛋白保守结构域
2.3.4 同源性分析 同源比对结果显示小鼠OLR1基因的编码区序列与大鼠、猪、牛、绵羊和人的同源性分别为83.4%、49.8%、26.8%、23.4%和30.8%(图5)。

图5 6 个不同物种OLR1 基因编码区序列的同源性分析
利用ClustalW 将小鼠OLR1基因编码氨基酸序列与大鼠(Rattus norvegicus,ΝP_579840.2)、猪(Sus scrofa,ΝP_998970.1)、人(Homo sapiens,ΝP_002534.1)、牛(Bos taurus,ΝP_776557.1)和绵羊(Ovis aries,XP_012030794.2)OLR1基因编码氨基酸序列进行比对,结果表明两端序列相对比较保守(图6)。

图6 OLR1 氨基酸序列的同源性比对分析
3 讨论
早期研究表明,OLR1基因参与人类心脑血管和脂蛋白代谢等相关的疾病[18-19],因此备受关注。近几年来有研究发现OLR1基因与猪的脂肪沉积、牛的肉质和乳脂率等性状存在一定的相关性,可以作为影响家畜重要经济性状的候选基因[14]。本课题组前期对OLR1基因在不同猪种中的组织表达谱进行了研究,发现在脂肪组织中表达量较高,并且在梅山猪(肥胖型)中的表达量高于大白猪(瘦肉型),说明该基因与脂肪沉积有一定的关系[10]。然而,其在脂肪沉积过程中的表达规律及作用机制尚不清楚。
动物的脂肪沉积主要是脂肪细胞数量增加、体积增大以及脂滴聚集的过程[20]。对于动物脂肪细胞分化及调控机制的研究多采用的细胞模型为前脂肪细胞。前脂肪细胞是一类具有增殖和脂肪细胞定向分化能力的特异化前体细胞[21]。本研究采用小鼠的前体脂肪细胞系3T3-L1,该细胞系可以连续传代,并且在适当条件下可以诱导分化成脂肪细胞,其生物学性能和形态都与体内脂肪细胞相似,是研究动物脂肪形成的理想模型[22]。研究结果显示,随着细胞的分化,基因表达量极显著升高,说明OLR1基因对前脂肪细胞的成脂分化具有促进作用。
对小鼠OLR1基因分子生物学特征进行分析,发现OLR1 蛋白存在2 个功能结构域,分别为Smc 结构域和CLECT 结构域。Smc 家族与细胞周期、细胞分裂等功能相关[23],推测OLR1基因可能通过该区域影响前脂肪细胞的周期,进而影响前脂肪细胞的增殖和凋亡。CLECT 结构域在不同物种中高度保守,它是OLR1 配体识别的区域,对配体的结合发挥着重要作用[24],推测OLR1基因可能通过该区域识别脂肪沉积相关的配体,进而影响脂肪代谢。
4 结论
本实验揭示了OLR1基因在小鼠前脂肪细胞分化过程中的表达规律,发现随着细胞分化程度增加,OLR1基因表达量逐渐升高,说明该基因可以作为影响脂肪发育的候选基因。本实验成功构建了小鼠OLR1基因过表达载体,可以转染小鼠的前脂肪细胞,为研究基因在脂肪细胞增殖、分化和凋亡中的作用奠定基础。

