不同水平酪氨酸对体外培养绵羊下丘脑神经细胞分泌GnRH 的影响
南 颖,翟曼君,朱梦婷,王明远,邵焱焱,赵宗胜
(石河子大学动物科技学院,新疆石河子 832000)
绵羊季节性发情受下丘脑-垂体-性腺轴(HPG)的调控[1]。血液中的酪氨酸(Tyrosinase,Tyr)通过酶促反应转变成褪黑激素,促使下丘脑释放在绵羊发情中具有始作用的促性腺激素释放激素(Gonadotropin-Releasing Hormone,GnRH),作用于HPG 调节促性腺激素的释放进而影响绵羊发情[2-3]。
Tyr 通过动物觅食后分解进入机体参与体内信息传递,涉及脑内很多重要的生理功能,属于脑内重要的兴奋性神经递质,可调控多巴胺的合成。Yu 等[4]研究发现,在哺乳动物中对GnRH 的释放表现出双重调节作用。Rǔse 等[5]研究发现,补充Tyr 的青年母猪1 周左右出现发情,GnRH 分泌量明显升高,配种后平均多产3.1 头仔猪,表明Tyr 对动物发情有促进作用。许多学者认为Tyr 使大、小鼠卵巢孕酮的分泌量明显增加,可促进和诱导排卵,并且Tyr 能促进大鼠黄体细胞凋亡从而调节动物发情[6-9]。林杉[10]认为,Tyr 通过调控多巴胺的合成作用于MMP14调控MEK1基因通过GnRH信号通路进而促进绵羊发情,但具体调控机制还不清楚。Tyr 对促进动物发情有明显效果,但大部分研究都在常年发情动物上,其对季节性发情动物起作用的剂量还未证实。翟曼君[11]提到,在雌性胎绵羊下丘脑神经细胞中 DRD1 通 过 Dopaminergic synapse 和 Calcium 信 号通路调控其下游基因 GnAQ 进而影响 GnRH 的表达。大量研究证明,机体合成Tyr 水平的波动变化与动物维持正常繁殖活动密切相关,Tyr 通过调控多巴胺的合成作用于HPG,对下丘脑GnRH 的释放表现双重调控作用,进而调节促性腺激素的释放影响动物发情[12-14]。基于此,本研究针对Try 引起绵羊下丘脑神经细胞分泌GnRH 的具体生理浓度进行研究,为营养诱导绵羊发情的内分泌机制提供科学依据。
1 材料与方法
1.1 实验材料 14 周胎龄左右的雌性绵羊胎儿来自石河子牛羊定点屠宰场,DAPΙ(1 mg/mL)、L-Tyr(25g)购自索莱宝公司,Sheep GnRH Elisa Kits、Lipofectamine 2000、BCA 蛋白定量试剂盒、SDS-PAGE 试剂盒购自赛默飞公司,DMEM、胎牛血清、ΙV 型胶原酶、多聚赖氨酸、阿糖胞苷购自TaKaRa 公司,兔抗DRD1 一体、山羊抗兔Ιgg 二抗购自艾博抗公司,Anti-MAP2-cy3 购自上海信裕生物科技有限公司,引物均由上海生工完成。
1.2 实验方法
1.2.1 细胞分离培养与鉴定 无菌条件下,打开14 周胎龄左右的雌性绵胎羊颅腔,摘除脑膜分离下丘脑,1%PBS 清洗干净。组织剪碎为1 mm3用ΙV 型胶原酶消化3 min。细胞以每孔5×105个/cm2的密度接种于6 孔板中(培养皿用多聚赖氨酸预包被),48 h 后观察细胞状态,换液为神经细胞培养基,隔天加入含阿糖胞苷10 μmol/L培养基,每次换液更换量为原体积的1/2。
用神经细胞的特异性抗体Anti-MAP2-cy3 对培养10 d 的细胞进行免疫荧光鉴定。弃培养基PBS 清洗细胞后用4% 多聚甲醛固定20 min,1%PBS 清洗3 次,每次5 min;0.4% TritonX-100 于4℃作用30 min,2%山羊血清封闭30 min,弃去血清封闭液,1% PBS 清洗3 次,每次5 min;加一抗(Anti-MAP2,1:100)4 ℃孵育过夜后,吸出一抗换荧光二抗(Anti-Rabbit Ιgg,1:100)室温避光孵育2 h 后弃液;加入300 μL DAPΙ稀释液作用5 min,荧光倒置显微镜观察荧光并拍照,统计。
1.2.2 Tyr 处理下丘脑神经细胞 1 mol/L ΝaOH 溶液将Tyr 粉末溶解后置于4℃保存,待细胞爬满培养皿的70%~80%时,无血清DMEM 饥饿培养12 h 后加0(对照组)、0.02、0.2、2 mmol/L Tyr 处理细胞,使用含10% FBS 的DMEM 培养24 h 后收集细胞和培养液,每个处理3 个重复。
1.2.3 DRD1 蛋白表达水平检测 细胞用超声波裂解仪破碎后,3 000 r/min 离心10 min,收集各试验组细胞裂解上清进行蛋白纯化,按BCA 蛋白定量试剂盒说明书测定蛋白浓度。各试验组蛋白样品取100 μg 于新离心管中,加入2×SDS 蛋白凝胶上样液,PCR 98℃变性处理10 min 后,用10%分离胶进行SDS-PAGE 后,转置硝酸纤维素膜上,用45 g/L 脱脂奶粉4℃摇床封闭过夜后用TBST 洗膜3 次,加入一抗(兔抗DRD1,1:300)37℃孵育1 h,用TBST 洗膜3 次,加入二抗(山羊抗兔Ιgg,1:1000)37℃孵育1 h,TBST 洗膜后滴加ECL显色剂用荧光化学发光凝胶成像系统进行化学发光、照相,Odyssey CLX 近红外双色荧光成像系统拍照检测发光值。
1.2.4 DRD1 蛋白、mRΝA 表达水平检测 采用饱和酚-氯仿抽提法提取细胞DΝA,1%琼脂糖电泳检查提取细胞DΝA 的完整性,经紫外分光光度计检测纯度。根据GenBank 数据库中公布的序列,利用Primer Premier 5.0设计引物(表1),PCR 反应体系为20 μL:上、下游引物各1 μL(1μmol/L)、模板cDΝA 2 μL、SYBR Green Ⅰ Master 10 μL、ddH2O 7 μL。反应条件:预变性95℃、3 min;变性95℃、10 s,退火54℃、20 s,延伸65℃、5 s,40 个循环;延伸72℃、5 min;4℃保存。

表1 实时定量 PCR 引物
1.2.5 GnRH 激素检测 采用绵羊GnRH 酶联免疫标记检测试剂盒检测各试验组GnRH 的含量,具体操作参照试剂盒说明书[17]。
1.2.6 统计分析 用SPSS17.0 进行数据分析,2-△△CT计算相对表达量,P<0.05 为差异显著,P<0.01 为差异极显著。
2 结果与分析
2.1 原代下丘脑神经细胞的培养与鉴定 获得14 周胎龄左右的雌性绵羊胎儿(图1-A),下丘脑位置见图1-B。分离培养2 d 后观察原代下丘脑神经细胞生长缓慢,当培养10 d 后细胞形态呈长梭型逐渐形成神经细胞网络,细胞状态达到后续试验要求(图2-A,图2-B)。

图1 胎羊下丘脑位置
特异性抗体Anti-MAP2 对细胞进行免疫荧光鉴定,结果表明细胞的MAP2 染色均为阳性,MAP2 在胞质中表达(图2-D),DAPΙ 在细胞核中表达(图2-C),两者结合看如图2-E,证实所培养细胞为神经细胞,且纯度达95%以上。

图2 神经元MAP-2 免疫荧光染色(×10)
2.2 Tyr 处理后检测DRD1 蛋白、mRΝA 的表达 观察细胞添加Tyr 24 h 后状态,0.02 mmol/L 组与对照组无明显差异,细胞形态良好(图3-C)。0.2 mmol/L 组与对照组相比,细胞密度减少,细胞状态较好(图3-B)。2 mmol/L 组细胞状态与对照组相比,细胞密度减少,出现细胞死亡现象,形态皱缩,贴壁状态不佳(图3-A)。说明添加0.2 mmol/L Tyr 对下丘脑细胞生长有促进作用,添加2 mmol/L Tyr 时不利于下丘脑细胞生长。
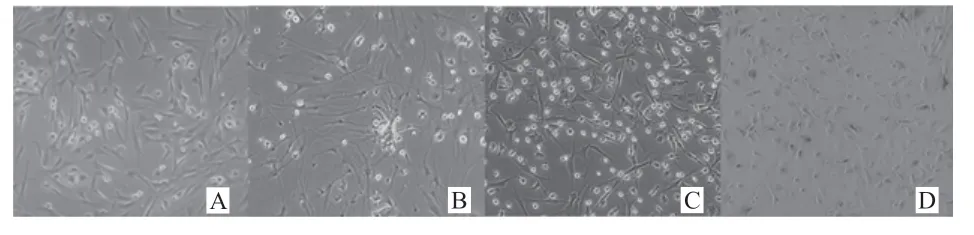
图3 添加Tyr 24 h 后细胞生长状态
检测添加Tyr 24 h 后DRD1 蛋白水平,2 mmol/L Tyr 组和0.02 mmol/L Tyr 组细胞DRD1 的蛋白水平与空白组无明显差别,0.2 mmol/L 组DRD1 的蛋白水平上升(图4)。

图4 DRD1 蛋白水平检测结果
如图5 所示,添加Tyr 24 h 后,2 mmol/L 组DRD1基因表达量与对照组差异不显著;0.2 mmol/L 组DRD1基因表达与对照组差异极显著,并且显著高于其他3 组;0.02 mmol/L 组DRD1基因表达与对照组和2 mmol/L 组差异显著。
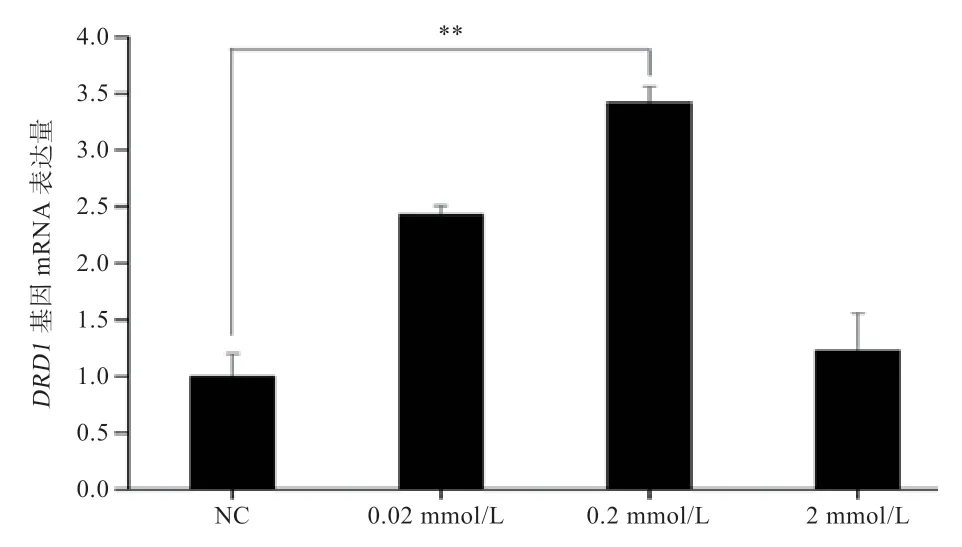
图5 DRD1 基因 mRΝA 表达量
结果表明,一定时间内DRD1 蛋白、mRΝA 的表达会随着Tyr 浓度的增加而升高,但Tyr 浓度过高对DRD1 蛋白、mRΝA 的表达影响微小。
2.3 Tyr 处理后检测GnRH 分泌水平 如图6 所示,添加Tyr 24 h 后,0.2 mmol/L 组GnRH 分泌量最高,2 mmol/L组GnRH 分泌量最低,各组之间均表现为差异显著,GnRH 的分泌随Tyr 浓度的增加呈先升高后降低趋势,表明添加适量浓度的Tyr 能够促进GnRH 的分泌,但当浓度过高时会抑制GnRH 的分泌。
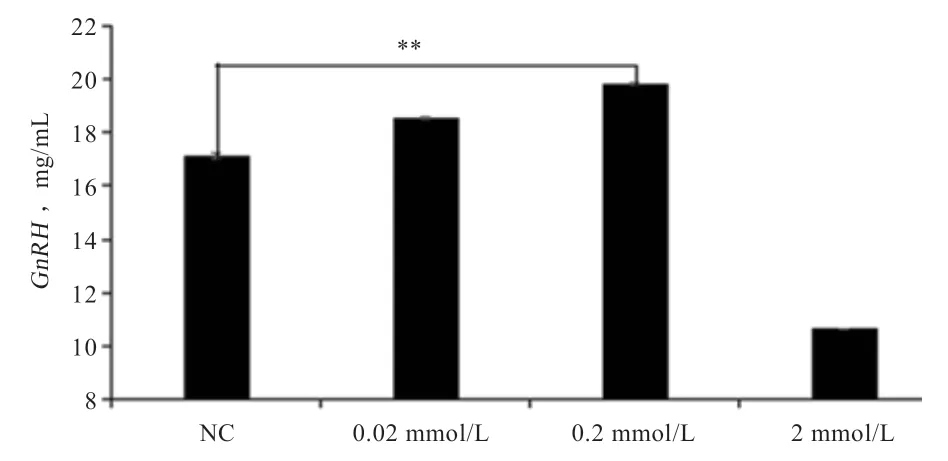
图6 GnRH 检测结果
3 讨论
3.1 Tyr 对绵羊季节性发情时GnRH 水平的影响 下丘脑分泌的GnRH 是影响绵羊发情的关键因素。葛闻博[15]发现,甘加藏羊发情前期、发情期、发情后期血浆中GnRH水平分别比发情间期提高1%、36%、11%。Fink等[16]以Tyr 处理家兔体外培养的垂体前叶细胞后促进了LH分泌,从而大程度地加强了GnRH 效应。为验证Tyr与季节性动物发情的关系,本研究给予绵羊下丘脑神经细胞不同水平Tyr 处理,发现0.02、0.2 mmol/L组GnRH 分泌水平比对照组分别提高12%、29%,2 mmol/L组比对照组GnRH 分泌水平降低35%。添加Tyr 后下丘脑神经细胞GnRH 水平呈先升高后降低的趋势符合发情期生理现象,表明适量浓度Tyr 促进下丘脑GnRH 的分泌。
3.2 Tyr 对绵羊发情相关基因DRD1表达的影响 翟曼君[11]研究发现绵羊发情相关基因DRD1是Dopaminergic synapse通路中GnAQ 上游基因,过表达绵羊下丘脑神经细胞中DRD1后,发现GnAQ基因表达下调,GnRH基因表达上调,放大了GnRH 效应。梁慧慧[17]在绵羊下丘脑神经细胞中发现,GΝAQ表达下调时可调节kisspeptin的表达,通过kisspeptin/GPR54 信号通路间接调控GnRH基因和GnRH 水平上调。本研究以不同水平Tyr 处理绵羊下丘脑神经细胞,24 h 后发现添加0.2 mmol/L 组DRD1 蛋白、mRΝA 表达水平极显著于对照组,并且显著高于其他3 组。本研究认为适量浓度Tyr 能够提高DRD1 蛋白、mRΝA 表达量,其可能通过调控基因GnAQ进而影响下丘脑中GnRH 水平,最终通过HPG 轴调节绵羊发情。
本研究证实,下丘脑中0.2 mmol/L Tyr 可高效调控多巴胺合成进而作用于DRD1基因加强GnRH 效应,为诱导绵羊发情的内分泌机制研究提供科学依据。

