青杄转录因子基因PwNF-YB8的克隆与功能分析*
苗雅慧 鞠 丹 梁珂豪 王爱斌 刘峻玲 张凌云
(北京林业大学林学院 森林培育与保护教育部重点实验室 北京 100083)
核因子Y(Nuclear Factor Y, NF-Y)也叫亚铁血红素激活蛋白(heme activator protein, HAP)或CCAAT盒结合因子(CCAAT box binding factor),是真核生物中普遍存在的转录因子,由NF-YA/B/C 3个亚基组成(Mantovani, 1999)。一般地,NF-YB在细胞质中先与NF-YC组合成二聚体,再进入细胞核中与NF-YA装配成三聚体,进而与顺式作用元件CCAAT框结合调控下游基因的表达(Frontinietal., 2004)。NF-YB是具有组蛋白(H2B)折叠结构域的一类NF-Y亚基,先后从大鼠(Rattusnorvegicus)(Maityetal., 1990)、小鼠(Musmusculus)(Hooftetal., 1990)、酵母(Saccharomycescerevisiae)(Olesenetal., 1991) 、拟南芥(Arabidopsisthaliana)(Edwardsetal., 1998)等真核生物中被鉴定出来。在酵母和哺乳动物中NF-Y是单个基因编码,而在植物中则由多个基因组成的基因家族编码。目前为止,在水稻(Oryzasativa)中鉴定出了11个NF-YB基因(Thirumuruganetal., 2008),在拟南芥和矮牵牛(Petunia×hybrida)均鉴定出13个NF-YB基因(Siefersetal., 2009; Weietal., 2020),高粱(Sorghumbicolor)中则有19个NF-YB基因(Maheshwarietal., 2019)。
NF-YB广泛参与了植物的生长发育过程,如种子发育、花期调控、光合作用等过程。比如,陆地棉(Gossypiumhirsutum)GhNF-YB22在胚中高表达; 玉米(Zeamays)ZmNF-YB2/6/7/10/14和蓖麻(Ricinuscommunis)RcNF-YB2/12在种子发育过程中高表达,参与了植物胚发生和种子发育过程(Chenetal., 2018; Wangetal., 2018b; Zhangetal., 2016)。水稻OsNF-YB3与叶绿素生物合成相关(Miyoshietal., 2003); 小麦(Triticumaestivum)TaNF-YB3作为一个正调控转录因子参与光合作用过程 (Stephensonetal., 2011); 玉米ZmNF-YB16能够正向调节光合作用过程,过表达后改善营养和生殖阶段玉米植株的抗旱胁迫能力,提高玉米籽粒产量(Wangetal., 2018a)。在长日照条件下,拟南芥atnfyb2突变体的花期延迟,而过表达AtNF-YB2的拟南芥植株花期提前(Caietal., 2007); 在拟南芥和番茄(Solanumlycopersicum)中过表达毛果杨(Populustrichocarpa)PtNF-YB1,可以促进早期开花(Wangetal., 2019b)。此外,在拟南芥中过表达AtNF-YB1,可以提高植物的光合速率、促进植株水势升高,同时延迟花期,而突变体植株与野生型的花期无显著差别,表明NF-YB基因在生长和发育中的多重作用和可能存在的功能冗余(Nelsonetal., 2007; Wenkeletal., 2006)。除参与植物的生长发育外,NF-YB在植物逆境胁迫响应方面也发挥了重要作用。在干旱和ABA胁迫下,美洲黑杨(Populusdeltoides)PdNF-YB7的表达量升高,在拟南芥中过表达PdNF-YB7后,其耐旱性和水分利用率显著提高(Hanetal., 2013); 在美洲黑杨中过表达PdNF-YB21,促进了根的生长、木质部导管高度木质化和增大,植株耐旱性显著增强(Zhouetal., 2020); 大蒜(Alliumsativum)AsNF-YC8在ABA处理、NaCl和PEG胁迫诱导下,转录水平变化明显; 过表达AsNF-YC8的烟草(Nicotianatabacum)植株,在盐和干旱条件下,其显示出更强的耐受性(Sunetal., 2017)。NF-YB不仅可以由单个亚基行使功能,也可以由多个亚基互作来共同发挥效应。拟南芥AtNF-YB2/3和AtNF-YC3/4/9能够在体内发生互作, 在CONSTANS(CO)介导的开花过程中发挥作用(Kumimotoetal., 2010; Wenkeletal., 2006); AtNF-YA4/YB3/YC2可以与bZIP28互作,参与到内质网的应激反应过程中(Liuetal., 2010)。在水稻中,NF-YB(HAP3)亚基OsHAP3A能够与HAP5的特定成员相互作用(Thirumuruganetal., 2008);OsNF-YB1/9、OsNF-YC8/9/10/11/12在水稻胚乳中高表达,且YB亚基与YC亚基之间存在相互作用(Eetal., 2018); NF-Y异源三聚体复合物NF-YB1-YC12-bHLH144能够调节稻米品质(Belloetal., 2019)。虽然NF-YB基因的功能已经在一些模式植物和作物中有较多研究,但在针叶树种中的研究却相对滞后。
青杄(Piceawilsonii)是我国重要的造林树种,适应性较强,在园林绿化及工业生产中占有重要地位(许家春等, 2004)。然而其繁育周期长,相对于其较强的抗寒性,青杄喜湿、抗旱性差,利用分子手段揭示青杄自身发育特性及抗逆机理具有重要意义。本课题组前期研究了NF-Y家族中的NF-YC亚基PwHAP5在花粉管发育及逆境响应中的作用,发现其参与了花粉管的导向调节,同时该基因受干旱、盐胁迫诱导(Lietal., 2013; Yuetal., 2011)。本研究在课题组早期获得的PwNF-YB8的cDNA序列基础上,进一步对其进行功能研究。利用qRT-PCR分析青杄PwNF-YB8在不同组织以及不同逆境胁迫下的相对表达情况,酵母双杂交系统、双分子荧光互补试验分析青杄PwNF-YB8与PwHAP5的互作情况,探究其在花粉萌发中的作用。利用农杆菌介导法将PwNF-YB8异源过表达至拟南芥中,对其进行抗逆表型分析。本研究有利于揭示NF-Y类转录因子在青杄中发挥的功能及作用,为进一步研究青杄的生长及抗逆机制提供理论依据。
1 材料与方法
1.1 试验材料及试剂
青杄花粉于中国科学院植物研究所(北京)采集,根、茎、针叶采集后先于液氮中速冻,后存于-80 ℃备用,青杄种子为本实验室留存。逆境响应试验所用为萌发后于温室培养正常生长8周的青杄幼苗。pEASY-T1、Taq PCR Mastermix(KT201) 、荧光定量PCR试剂盒(SYBR FAST qPCR Kit)、多糖多酚总RNA提取试剂盒和反转录试剂盒(KR106)购于天根生物有限公司; 大肠杆菌(Escherichiacoli)感受态DH5α和无缝克隆(CV1901)试剂盒购于北京艾德莱生物科技有限公司; 限制性内切酶及T4DNA连接酶等购自Fermentas公司; 鲑鱼精购于北京华越洋公司; NaCl、醋酸锂、DMSO和X-α-gal购于SIGMA公司; 其他试剂购于AMERSCO公司。PwHAP5T载体、pGBKT7、pGADKT7、pCAMBIA1205载体、35S∷SPYNE、35S∷SPYCE为实验室留存。CRISPR/Cas 9载体pCBC-DT1DT2、PHEE401E为中国农业大学陈其军教授惠赠,pSUPER1300载体为中国农业大学傅璎教授惠赠。
1.2 青杄PwNF-YB8的cDNA全长获得及编码蛋白的序列分析
在实验室前期研究工作中,曾利用构建青杄均一化cDNA文库及EST序列分析,得到大量有效EST序列(张盾等, 2012),随后根据青杄转录组数据(Guoetal., 2020),筛选获得1个NF-Y转录因子基因,将其命名为PwNF-YB8。利用天根公司多糖多酚总RNA提取试剂盒(DP441)提取青杄总RNA,并利用其反转录试剂盒(KR106)合成cDNA第1链。根据此序列设计引物YB8(表1)以青杄cDNA模板进行PCR扩增,将扩增产物胶回收后连接T载体,转化大肠杆菌DH5α感受态后进行测序验证。

表1 试验所用引物①Tab.1 Primers used in this experiment
利用DNAMAN6.0进行PwNF-YB8核酸序列拼接和蛋白翻译预览。用NCBI的Blast(http:∥www.ncbi.nlm.nih.gov/)和InterPro(http:∥www.ebi.ac.uk/interpro/)预测PwNF-Y8保守结构域。ProtParam(http:∥web.expasy.org/protparam/)分析氨基酸组成及理化性质预测。Protscale(http:∥web.expasy.org/protscale/)预测蛋白疏水性并用FoldIndex(http:∥bip.weizmann.ac.il/fldbin/findex)预测蛋白跨膜情况。在NCBI上查找PwNF-YB8的同源蛋白并用DNAMAN6.0进行多序列比对,系统发育树用MEGA10基于邻接法(Neighbour-Joining)构建。
1.3 PwNF-YB8基因表达特性分析
采用天根公司多糖多酚总RNA提取试剂盒(DP441)提取青杄根、茎、针叶及花粉总RNA,并使用其反转录试剂盒(KR106)合成cDNA第1条链。将各组织的cDNA模板浓度经均一化后,利用天根公司的荧光定量PCR试剂盒(SYBR)在Step One PlusTMReal-Time荧光定量PCR仪上检测PwNF-YB8在不同组织中的相对表达情况。利用SqRT-PCR和qRT-PCR对青杄不同组织(根、茎、针叶、花粉)中PwNF-YB8基因的表达量进行分析。青杄延伸因子蛋白基因EF1-α作为内参基因(Yuetal., 2011),内参特异引物为EF1-α,qRT-PCR引物为YB8-RT(表1)。试验设置3次生物学重复和3次技术重复。
逆境胁迫响应试验参考张通等(2014)的方法,略有改动。大体步骤如下: 选取长势相同的8周龄青杄幼苗,置于42 ℃高温处理,处理时间分别为0、2、4、6、8、12 h; 用20%(质量比)PEG溶液、200 mmol·L-1NaCl盐溶液、100 mmol·L-1脱落酸分别处理青杄幼苗0、2、4、6、8、12 h,对照组采用清水处理。将幼苗置于21 ℃、光周期/暗周期16 h/8 h、空气湿度60%条件中。每个处理设置3个重复。处理后青杄幼苗于液氮速冻处理,存于-80 ℃备用。提取青杄根、茎和针叶的总RNA,反转录后进行荧光定量PCR试验检测PwNF-YB8的表达量,均利用2-△△Ct法分析数据。
1.4 突变体载体和过表达载体构建、拟南芥的转化与筛选
突变体载体利用CRISPR/Cas 9技术构建,参照Xing等(2014)方法,步骤如下: 1) 四引物PCR扩增,体系为1 μL pCBC-DT1T2,DT1-BsF-4、DT1-F0-4、DT2-R0-8、DT2-BsR-8各0.5 μL,Taq Mix酶10 μL,ddH2O补齐至20 μL。反应条件为95 ℃高温变性5 min; 95 ℃高温30 s, 60 ℃退火30 s,72 ℃延伸50 s,35个循环; 72 ℃10 min。PCR产物使用Omega胶回收试剂盒(D2500-01)进行纯化。2) PCR-酶切体系: PHEE401E 2 μL,PCR反应后片段2 μL,10×BSA 1.5 μL,10×NEB T4 Buffer 1.5 μL,T4 Ligase (NEB) 1 μL,Bsa I (NEB) 1 μL,ddH2O补足至50 μL。反应程序如下: 37 ℃ 5 h,50 ℃ 5 min,80 ℃ 10 min。随后将反应产物转化大肠杆菌送测,测序成功后转化根癌农杆菌(Agrobacteriumtumefaciens)。过表达载体: 构建PwNF-YB8 CDS全长到pCAMBIA1205载体上,以EcoRⅠ和KpnⅠ为内切酶,设计引物YB8-1205(表1),将融合载体转入到农杆菌GV3101感受态。
通过花序侵染法转化拟南芥(Cloughetal., 1998)。拟南芥突变体筛选: 1)侵染、筛选获得阳性植株。野生型植株侵染后收种,将种子播种在含抗生素(50 μg·mL-1羧苄青霉素+40 μg·mL-1潮霉素)的MS固体培养基中,能够长出2片子叶和2片真叶的拟南芥即为T0代阳性苗。2)筛选无抗性背景突变体植株。将T0代阳性苗播种到MS培养基中,得到T1代阳性苗并进行分株收种。随后将T1代阳性苗的种子播种于筛选培养基中,若不能生长,则说明该突变体无抗性背景,可以扩繁使用。并进一步设计靶点前后的引物Crispr 8-F 和Crispr 8-R进行测序鉴定。过表达筛选: 侵染后得到的T0代种子播种在筛选培养基中,当阳性植株长出2片子叶和2片真叶后,将其移到土里继续生长。3周后提取阳性植株的基因组DNA,以YB8-1205为引物(表1)进行PCR鉴定,根据鉴定结果逐株收集T1代植株的种子作为不同的株系(Line),筛选至T3代稳定纯合的阳性植株。以野生型(WT)和空载体(VC)株系作为对照,通过qRT-PCR检测各过表达株系中PwNF-YB8的表达量,选取拟南芥Actin2/8基因作为内参基因(Zhangetal., 2018)。每次试验分别设置3次技术重复、3次生物学重复。Actin2/8和YB8-RT引物序列见表1。
1.5 PwNF-YB8的亚细胞定位分析
以含有PwNF-YB8基因CDS序列的T载体为模板,用YB8-1205(表1)作引物进行PCR、胶回、酶切、连接,随后将目的片段构建至pCAMBIA1205载体。将重组载体转化大肠杆菌DH5α并培养。质粒提取使用北京艾德莱公司的大型/大量质粒提取试剂盒(PL14),使质粒浓度达1 μg·μL-1,利用基因枪轰击洋葱(Alliumcepa)表皮细胞(Yuetal., 2011)。将轰击后的洋葱表皮置于MS培养基中暗处理1天,随后使用激光共聚焦显微镜观察拍照。
为了排除GFP位置差异对目的片段定位产生影响,分别使用2种表达载体(pSUPER1300载体和pCAMBIA1205载体)瞬时转化烟草叶片。在pSUPER1300载体中,GFP位于目的片段的C端,在pCAMBIA1205载体中,GFP位于目的片段的N端。将PwNF-YB8构建到含有GFP标签的表达载体上,用基因枪轰击洋葱表皮细胞和瞬时转化烟草叶片的方法,研究PwNF-YB8在细胞中的定位。以转化空pCAMBIA1205载体和pSUPER1300载体的烟草叶片为阴性对照,以转化RACK1A-RFP载体的烟草为阳性对照(RACK1A-RFP同时定位于细胞质、细胞膜和细胞核)进行共转(Nakashimaetal., 2008)。
将构建好的重组质粒转入GV3101农杆菌感受态中,通过PCR鉴定出阳性菌落后留存。在相应工作浓度抗生素的YEB培养基中划线培养活化农杆菌。培养约2天后,在超净工作台中用枪头蘸取少量农杆菌加到含有5 mL相应抗性的YEB培养液的离心管中,在28 ℃、180 r·min-1的摇床里培养,至OD值处于1.0~1.2之间。将农杆菌菌液在4 500 r·min-1下离心5 min后弃掉上清液,随后加入1 mL烟草注射缓冲液振荡混匀,再次离心,重复1次。随后向离心管中加入200 μL烟草注射缓冲液并吹打振荡混匀。另取一新2 mL离心管加入菌液,并分次适量加入烟草注射缓冲液,调OD为0.8左右。将混合菌液静置于离心管中2.5 h后注射烟草叶片。注射后的烟草在16 h光照/8 h黑暗、25 ℃条件下培养48 h后,在共聚焦显微镜下观察拍照。
1.6 PwNF-YB8转录激活活性及与PwHAP5的互作分析
PwNF-YB8引入SmaⅠ和BamHⅠ的酶切位点,PwHAP5引入NdeⅠ和BamHⅠ的酶切位点,以相应T载体为模板进行扩增,获得加入上述酶切位点的PwNF-YB8、PwHAP5完整编码序列,经过双酶切后用T4DNA连接酶分别与pGBKT7、pGADKT7载体连接,获得酵母表达载体pGBKT7-YB8和pGADKT7-HAP5。按Clontech公司酵母双杂交手册,将pGBKT7-YB8和pGADKT7-HAP5分别转化酵母AH109感受态中。自激活活性试验中,试验组为pGBKT7-YB8+pGADT7,以pGBKT7+pGADT7为阴性对照,以pGBKT7-p53+pGADT7为阳性对照。均匀涂在SD/-Trp-Leu二缺板上,生长3~4天后,分别挑选单克隆菌落并用无菌水稀释,分别吸取3 μL左右的菌液滴于SD/-Trp-His-Ade三缺板中。酵母双杂交验证互作试验中,阳性对照采用pGBKT7-p53+pGADKT7-T,阴性对照采用pGBKT7-YB8+pGADKT7、pGBKT7+pGADKT7-HAP5,试验组为pGBKT7-YB8+pGADKT7-HAP5。用醋酸锂介导法将4组载体分别转入酵母AH109感受态中,先涂布于SD/-Leu-Trp固体平板,待菌株生长良好后转入SD/-Ade-His-Leu-Trp固体平板,观察菌落生长状况。将试验组和对照组酵母分别涂布于含X-α-gal(4 mg·mL-1)的SD/-Ade-His-Leu-Trp四缺板上,培养3~4 天观察菌落颜色变化。
双分子荧光互补重组载体通过艾德莱公司的无缝克隆(CV1901)试剂盒进行载体构建。利用BamHⅠ、KpnⅠ双酶切线性化35S∷pSPYNE和35S∷pSPYCE载体,反应体系为2×OneStep Cloning Mix 5 μL,线性化载体与插入片段摩尔比2∶1,ddH2O补足至10 μL。50 ℃下反应30 min,随后吸取5 μL反应产物转化大肠杆菌,测序成功后转化农杆菌。以转入35S∷pSPYNE+35S∷pSPYCE的农杆菌为空对照,以转入35S∷pSPYNE∶PwNF-YB8+35S∷pSPYCE、35S∷pSPYCE∶PwHAP5+35S∷pSPYNE农杆菌为阴性对照,以转入35S∷pSPYCE∶PwHAP5+35S∷pSPYNE∶PwNF-YB8的农杆菌为试验组。烟草注射与培养方法同1.5,48 h后在激光共聚焦显微镜下观察YFP荧光信号。
1.7 青杄花粉体外萌发试验
将青杄花粉从-80 ℃冰箱中取出并置于-20 ℃冰箱中复苏12 h,随后再放入4 ℃冰箱中适应12 h,萌发试验开始前2~3 h取出在室温条件下备用。取0.02 g花粉置于5 mL花粉液体培养基中,在25 ℃、120 r·min-1的摇床里避光萌发。将不同时间萌发的花粉置于光学显微镜下统计萌发数量(当花粉管伸长长度大于花粉直径时即视为萌发)及此时的花粉管长度。每组试验设置3次重复,每次重复统计250个花粉萌发情况,统计出不同萌发时间下花粉萌发率及花粉管长度的平均值。于正常萌发的0、6、12、18、24、30、36 h 取样,硼酸及钙离子处理时分别在萌发0、12、24 h取样。
1.8 转PwNF-YB8基因拟南芥的种子萌发试验及幼苗根长统计
以野生型(WT)和转空载体(VC)植株为对照,统计突变体、过表达PwNF-YB8拟南芥种子萌发率。将各株系拟南芥种子先用5%的NaClO溶液浸泡消毒20 min,再用无菌水清洗8次,之后播到MS培养基上,每株系播种100粒种子。以MS培养基为对照,盐处理浓度为50、100、150 mmol·L-1,甘露醇处理浓度为100、200、300 mmol·L-1,统计不同株系种子在不同处理下的萌发率及子叶绿化率(Zhangetal., 2018)。试验重复3次。
将野生型(WT)、转空载体(VC)、突变体及过表达PwNF-YB8拟南芥各株系种子先播种到MS培养基上,种子萌发后转移到不同胁迫条件的MS培养基上竖直培养,各株系分别选取10株幼苗。盐胁迫浓度依次设置为50、100、150 mmol·L-1,甘露醇处理浓度依次设置为100、200、300 mmol·L-1。待萌发幼苗在各梯度浓度MS培养基生长8天后,统计幼苗根长。试验设置3次重复。
1.9 数据处理及分析
利用SPSS 20.0软件进行方差分析,单因素方差分析采用Dunnett检验,P<0.05为差异显著。利用Sigma Plot 10.0进行作图。
2 结果与分析
2.1 青杄PwNF-YB8基因序列分析及同源性比对
通过本实验室青杄转录组数据获得PwNF-YB8基因(GenBank 登录号: MT230480)的cDNA序列,长度为927 bp,编码区489 bp,共编码162个氨基酸。55 bp处为起始密码子ATG,541 bp处为终止密码子TGA,并在末端发现Poly(A)19尾巴(图1)。此基因编码的蛋白具有NF-YB转录因子保守结构域(IPR003956)、NF-YB结合位点(IPR003957)等NF-YB家族的典型特征。PwNF-YB8蛋白理论分子量18.05 kDa,预测的等电点pI为5.67。通过HNN对PwNF-YB8蛋白的二级结构预测显示,其由α螺旋(α-helix,41.98%)、延伸链(extended strand,6.79%)和大量无规则卷曲(random coil,51.23%)组成。信号肽和跨膜结构分析结果显示,PwNF-YB8蛋白为易溶、亲水性较强蛋白且不含跨膜肽段。

图1 青杄PwNF-YB8 核酸序列及编码蛋白氨基酸序列Fig. 1 Nucleotide sequence and deduced protein amino acid sequence of PwNF-YB8 in Picea wilsonii
将青杄PwNF-YB8编码的氨基酸序列在NCBI上进行Blast,选取7个其他物种中的同源基因。多序列比对发现PwNF-YB8在进化上比较保守,并且和白云杉(Piceaglauca)PgNF-YB8序列完全相同(图2A),预测青杄与白云杉进化上来源于同一祖先。在用MEGA10构建系统发育树的过程中发现青杄除了与白云杉聚为一类外,还与模式植物拟南芥的遗传距离较近(图2B)。

图2 PwNF-YB8与同源蛋白的多序列比对及进化树分析Fig. 2 Multiple sequence alignment and evolutionary tree analysis of PwNF-YB8 and homologous proteinsA: 多序列比对结果,相似度用3种颜色标记(黑色=100%,粉色≥75%,蓝色≥50%),粗线段表示NF-YB保守结构域,图中螺旋结构域(α1,α2,α3,αc)用黑色框表示,其中每2个螺旋结构间形成环(L1,L2,L3),位于L2的精氨酸和位于α3的天冬氨酸在NF-YB与NF-YC相互结合上起作用,位于α2中的2个谷氨酸对NF-YA的结合发挥功能; B: 系统进化树。A: Homologous protein multiple sequence alignment Conserved percent: Black=100%, Pink≥75%, Blue≥50%; The thick line indicates the NF-YB conserved domain, the helical domains (α1, α2, α3, αc) in the figure are represented by black boxes, in which a loop (L1, L2, L3) is formed between every two helical structures; Arginine located at L2 and aspartic acid placed α3 act on the binding of NF-YB and NF-YC, and the two glutamic acids located in α2 play a role in the binding of NF-YA. B: Phylogenetic tree analysis.
2.2 青杄PwNF-YB8的表达特性分析
PwNF-YB8在青杄各组织内均有表达。其中,在花粉中表达量最高,其次是在针叶中(图3A)。分别测定在盐胁迫(200 mmol·L-1NaCl)、干旱(20%PEG)、高温(42 ℃)、ABA(100 mmol·L-1)及不同处理时间(0、2、4、6、8、12 h)下PwNF-YB8的表达变化,结果(图3B)表明,PwNF-YB8在盐胁迫及干旱胁迫下有明显响应。盐胁迫处理后,PwNF-YB8的表达呈现出先上升后下降的趋势,在盐处理6 h后转录水平升至最高,为对照表达量的8.24倍。在干旱条件下,4 h时达到对照的2.08倍,其他时间内差异不明显。在高温胁迫处理下,PwNF-YB8基因无显著诱导表达。在ABA处理下,PwNF-YB8的表达呈现出先下降后上升的趋势,在处理12 h后相对表达量最高。

图3 青杄PwNF-YB8的表达特性分析Fig. 3 The expression of PwNF-YB8 in Picea wilsonii不同字母表示在Dunnett检验下差异显著(P<0.05)。下同。Different letters indicate significant difference under Dunnett’s test (P<0.05). The same below.
2.3 PwNF-Y8的亚细胞定位分析
为了排除GFP位置差异对目的片段定位产生影响,分别使用2种表达载体(pSUPER1300载体和pCAMBIA1205载体)瞬时转化烟草叶片(图4A)。基因枪轰击洋葱表皮细胞,以转入空载体的洋葱细胞作为阴性对照(图4B)。结果显示,阴性对照组空载体GFP信号定位于细胞膜、细胞质和细胞核; 试验组中,PwNF-YB8和GFP的融合蛋白定位于细胞核、细胞质中,表明PwNF-YB8在细胞中均有表达,且GFP的连接位置并不影响其定位情况(图4C)。
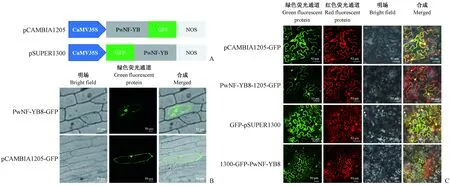
图4 PwNF-YB8的亚细胞定位Fig. 4 Subcellular localization of PwNF-YB8标尺Bar: 50 μm.A: 2种PwNF-YB8-GFP融合蛋白表达载体示意图; B: 基因枪轰击洋葱表皮细胞定位图; C: 瞬时转化烟草细胞定位图。A: Schematic diagram of two PwNF-YB8-GFP fusion protein expression vectors; B: Location map of onion epidermal cells bombarded by gene gun; C: Location map of transiently transformed tobacco cells.
2.4 PwNF-YB8与PwHAP5互作
首先检测PwNF-YB8的转录自激活活性,构建PwNF-YB8全长载体,试验组为pGBKT7-YB8+pGADT7,以pGBKT7-p53+pGADT7为阳性对照,以pGBKT7+pGADT7为阴性对照。结果显示,pGBKT7+pGADT7、pGBKT7-p53+pGADT7、pGBKT7-YB8+pGADT7均能在SD/-Trp-Leu板上生长,说明重组载体成功转到了酵母菌株中,但只有阳性对照组能够在SD/-Trp-Leu-His板上生长,说明PwNF-YB8无转录激活活性(图5A)。互作试验中试验组为pGBKT7-YB8+pGADT7-HAP5,以pGBKT7-p53+pGADT7为阳性对照,以pGBKT7-YB8+pGADT7、pGBKT7+pGADT7为阴性对照。结果显示,对照组和试验组的酵母菌落均能在SD/-Leu-Trp二缺板上生长,表明重组质粒转化成功,试验组和阳性对照组能够在SD/-Ade-His-Leu-Trp四缺板上生长且在X-α-gal的染色下变蓝,证明PwNF-YB8和PwHAP5互作(图5B)。

图5 PwNF-YB8的转录激活活性分析及与PwHAP5的互作Fig. 5 Analysis of transcriptional activation activity of PwNF-YB8 and its interaction with PwHAP5A: PwNF-YB8转录激活活性; B: 酵母双杂交PwNF-YB8与PwHAP5的互作; C: PwNF-YB8与PwHAP5的双分子荧光互补试验分析, 标尺=50 μm。A: PwNF-YB8 transcriptional activation activity; B: Yeast two-hybrid PwNF-YB8 and PwHAP5 interaction; C: PwNF-YB8 and PwHAP5 bimolecular fluorescence complementary experiment analysis, Bar=50 μm.
在烟草叶片中进行双分子荧光互补试验(图5C),进一步验证PwNF-YB8与PwHAP5的互作。将编码PwNF-YB8及PwHAP5蛋白的核酸序列分别构建到nYFP和cYFP(即荧光蛋白的N端和C端)上,获得nYFP-PwNF-YB8、cYFP-PwHAP5载体。农杆菌介导转化烟草细胞后,在激光共聚焦显微镜下观察是否产生YFP荧光信号。结果发现仅试验组PwNF-YB8与PwHAP5 共转的组合可以检测到明显的YFP荧光信号,其他对照组合并未检测到黄色荧光信号,表明PwNF-YB8和PwHAP5蛋白可以发生互作。
2.5 PwNF-YB8参与青杄花粉萌发过程且受钙、硼离子诱导
利用青杄花粉萌发试验检测花粉质量。花粉萌发过程中,从花粉一端萌发出花粉管,并随萌发时间而逐渐伸长(图6A)。0~6 h,花粉萌发数很少,12~24 h是萌发的高峰期,到24 h基本萌发完全萌发率达70%,之后的12 h过程中萌发率上升较慢,36 h时萌发率为75%左右(图6B)。在花粉正常萌发过程中,对PwNF-YB8基因表达量进行检测,结果发现,其在花粉萌发过程中变化明显,且在花粉萌发36 h时表达量最高(图6C)。

图6 青杄花粉萌发及PwNF-YB8在花粉萌发过程中的表达Fig. 6 Germination of Picea wilsonii pollen and expression of PwNF-YB8 in the process of pollen germinationA: 正常萌发过程花粉形态; B: 花粉萌发过程中花粉管长度及萌发率统计; C: 花粉萌发过程中PwNF-YB8的相对表达量; D: 氯化钙和硼酸诱导下PwNF-YB8的相对表达量分析。A: Pollen morphology during normal germination; B: Statistics of pollen tube length and germination rate during pollen germination; C: Relative expression of PwNF-YB8 during pollen germination; D: Relative expression of PwNF-YB8 induced by calcium chloride and boric acid.
青杄花粉萌发受到钙离子及硼离子诱导,因此检测0.1%(W/W) CaCl2和0.1%(W/W) H3BO3诱导花粉过程中PwNF-YB8表达量变化。结果发现,钙离子诱导下,PwNF-YB8表现为先下降后略微上升; 硼离子作用下,PwNF-YB8的表达量下降(图6D)。
2.6 拟南芥突变体和转基因植株的获得及鉴定
通过CRISPR/Cas 9技术敲除PwNF-YB8在拟南芥中的同源基因AtNF-YB8,得到突变体nfyb8-cas9#1、nfyb8-cas9#12。DNA水平检测证明在特定突变位点处发生了碱基突变,基因靶位点突变成功,获得突变体(图7A),测序峰图结果显示增加的碱基处为单一峰,证明已经获得纯合突变体(图7B)。对突变位置进行比对,发现突变位点均在突变体植株外显子上。经蛋白序列比对发现,突变体植株编码的AtNF-YB8蛋白序列提前终止(图7C),可以作为植物试验材料进行后续的表型试验。
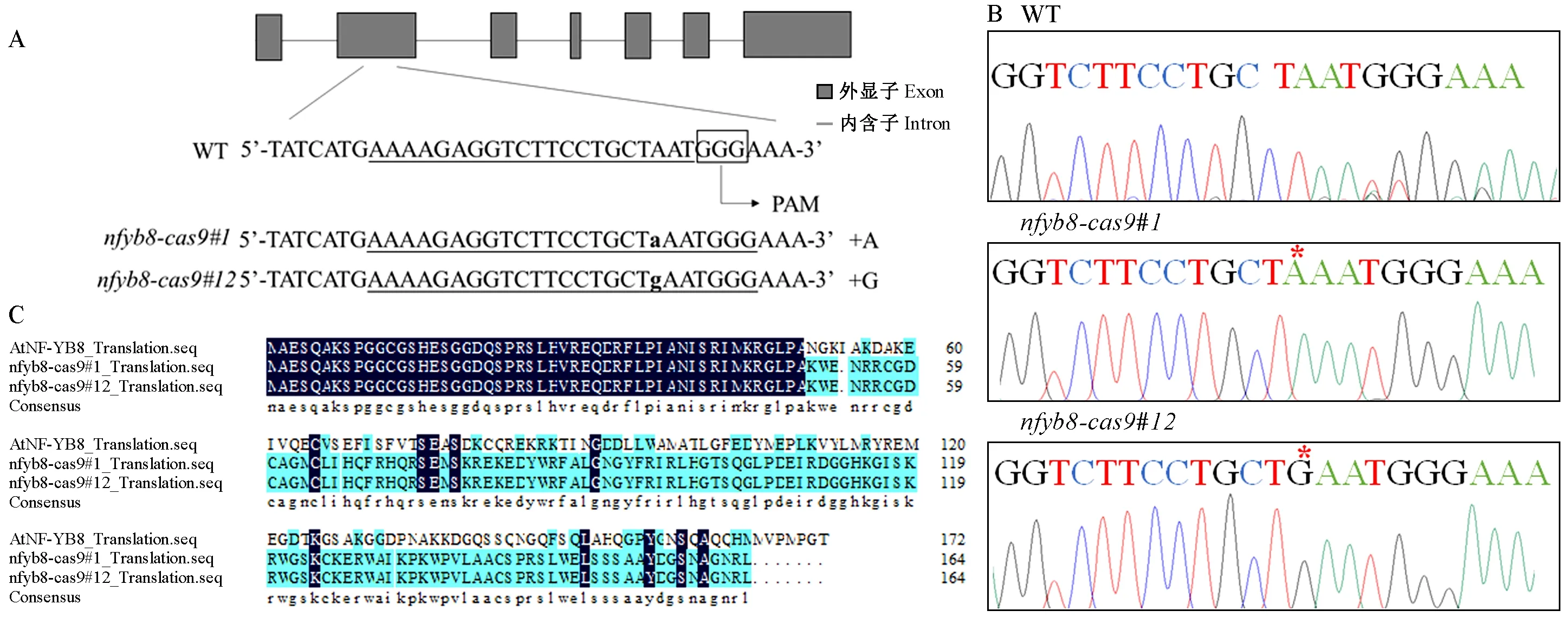
图7 拟南芥突变体植株测序峰及拟南芥野生型植株、突变体植株蛋白序列Fig. 7 Sequencing peak map of Arabidopsis thaliana mutant plants and protein sequence of A. thaliana wild-type plants and mutant plantsA: AtNF-YB8基因靶位点突变模式; B: 拟南芥突变体植株测序峰图(*表示测序峰图中突变体植株与野生型植株测序峰图相比增加的碱基所在位置); C: 拟南芥突变体编码AtNF-YB蛋白序列。A: AtNF-YB8 gene target site mutation pattern; B: Sequencing peak map of Arabidopsis mutant plants(* indicates the location of the increased bases in the sequencing peak map of the mutant plant compared to the wild type plant); C: Arabidopsis mutant encoding AtNF-YB protein sequence.
采取农杆菌介导的花序侵染法,经DNA水平检测后共获得6株PwNF-YB8转基因株系(图8A); qRT-PCR结果表明Line4(L4)和Line5(L5)表达量相对较高,因此作为进一步试验的材料。结果显示,在L4和L5株系中,PwNF-YB8基因成功转入到拟南芥植株中(图8B)。

图8 转基因PwNF-YB8拟南芥植株的获得与鉴定Fig. 8 Obtaining and identification of transgenic PwNF-YB8 plants of Arabidopsis thalianaA: 过表达株系的PCR鉴定(M: DNA marker; Col: 拟南芥野生型植株; P: 以鉴定正确的PwNF-YB8∶1205阳性质粒为模板的扩增情况; 1-6: 不同阳性植株); B: 野生型(WT)和过表达株系(P8-L4, P8-L5)中PwNF-YB8的表达量分析。A: PCR identification of overexpressing lines(M: DL2000 marker; Col: Negative control; P: Positive control; 1-6: Different positive plants); B: PwNF-YB8 expression analysis in wild type(WT) and overexpressing lines(P8-L4, P8-L5).
2.7 转基因拟南芥植株在干旱胁迫下的表型分析
种子萌发试验结果表明,所有株系的拟南芥种子萌发率随甘露醇浓度的升高而降低。在MS培养基中,突变体植株的萌发率略低,而野生型、转空载体(VC)和过表达株系间的萌发率无显著差异。在100、200和300 mmol·L-1甘露醇浓度下,突变体植株表现出较高的敏感性,萌发率显著低于其他株系。在100、200 mmol·L-1的甘露醇浓度下,L4和L5株系的萌发率显著低于野生型。在300 mmol·L-1的甘露醇浓度下,所有株系的萌发率明显下降,此时过表达株系与野生型、VC株系的萌发率无显著差异,而突变体植株的萌发率相较于其他株系显著降低(图9A、C)。子叶绿化率统计结果显示在MS培养基中,所有株系的子叶绿化率均达到100%; 在100 mmol·L-1甘露醇处理条件下,野生型植株、VC株系的子叶绿化率显著高于其他株系,突变体株系和L5株系子叶绿化率较低,L4和L5株系间差异显著; 在200 mmol·L-1甘露醇处理条件下,野生型植株、VC的子叶绿化率仍然显著高于其他株系,突变体植株子叶绿化率最低,L4与L5株系之间差异显著,过表达株系与野生型、VC植株的子叶绿化率差异显著(图9D)。

图9 不同甘露醇浓度下拟南芥不同株系的种子萌发率和幼苗根长Fig. 9 Seed germination rate and seedling root length of different lines of Arabidopsis thaliana under different concentrations treatments of mannitolWT: 野生型株系; VC: 空载体株系; P8-L4, P8-L5: 过表达株系; nfyb8-cas9#1, nfyb8-cas9#12: 突变体株系。下同。A, C: 甘露醇处理下萌发率统计; D: 甘露醇处理下子叶绿化率统计; B, E: 甘露醇处理下幼苗根长统计。WT: Wild type; VC: Empty vector control; P8-L4, P8-L5: Overexpressing plants; nfyb8-cas9#1, nfyb8-cas9#12: Mutant plants. The same below. A, C: Statistics of germination rate under mannitol treatment; D: Statistics of cotyledon greening rate under mannitol treatment; B, E: Statistics of seedling root length under mannitol treatment.
拟南芥幼苗根长试验结果表明,随着施加甘露醇的浓度增加,所有株系的根长随甘露醇浓度的升高而缩短。在MS培养基中,突变体植株的根长明显短于其他株系,野生型、VC和过表达株系之间根长无显著差异。在100、 200、 300 mmol·L-1的甘露醇浓度下,L4和L5株系的根长显著长于野生型和VC株系,相比之下突变体株系对甘露醇处理更敏感,与其他株系差异显著(图9B、E)。
2.8 转基因拟南芥植株在盐胁迫下的表型分析
拟南芥种子萌发试验结果显示,盐处理下突变体植株显示出更高的敏感性,种子萌发率显著低于其他株系。例如在150 mmol·L-1NaCl浓度下,野生型植株、VC株系、L4、L5株系的最终萌发率分别为92.0%、90.0%、92.3%、94.3%,而2个突变体株系nfyb8-cas9#1、nfyb8-cas9#12的萌发率分别为46%、72.7%(图10A、B)。

图10 不同盐浓度下拟南芥不同株系的种子萌发率和幼苗根长Fig. 10 Seed germination rate and seedling root length of different lines of Arabidopsis thaliana under different concentrations treatments of NaClA, B: 盐处理下萌发率统计; C, D: 盐处理下幼苗根长统计。A, B: Statistics of germination rate under salt treatment; C, D: Statistics of seedling root length under salt treatment.
随后利用不同浓度的NaCl模拟盐胁迫来探究转基因拟南芥幼苗对盐胁迫的耐受性。在0 mmol·L-1浓度下突变体根长最短,在50、100 mmol·L-1浓度下对照组与突变体根长无显著差异,而转基因L4和L5幼苗的根长明显长于野生型、转空载体及突变体株系(图10C、D)。以上结果表明在一定浓度的盐胁迫下,异源过表达植株相较于其他株系显示出更优的耐受性。
3 讨论
本研究从青杄中克隆得到PwNF-YB8基因,对其编码的氨基酸进行分析发现,该基因存在典型的NF-YB转录因子保守位点和结合位点,属于NF-Y转录因子家族。多序列对比显示,PwNF-YB8蛋白结构保守,二级结构包括4个螺旋结构和3个无规则卷曲组成的helix-loop-helix结构。这种高度保守的结构域在NF-Y转录因子和DNA结合、NF-Y与其他蛋白相互作用中至关重要(Mantovani, 1999; Romieretal., 2003)。NF-YB转录因子中位于α2中的2个谷氨酸对与NF-YA的结合发挥功能,位于L2的精氨酸和位于α3的天冬氨酸在NF-YB与NF-YC相互结合上起作用。一般而言,NF-Y可形成异源三聚体发挥作用。例如,拟南芥DPB3-1(NF-YC10)可以与NF-YA2和NF-YB3形成转录复合物,三聚体与DREB2A在热应激反应过程中协同增强热应激诱导的基因表达,增强植株的耐热性(Satoetal., 2014)。在菜豆(Phaseolusvulgaris)×根瘤菌(Rhizobium)的互作研究中发现,NF-Y异源三聚体(PvNF-YC1、PvNF-YB7及PvNF-YA1)能够参与共生结节发生过程(Ripodasetal., 2019)。近年来,一些研究表明NF-Y也可作为miRNA的靶基因,或与miRNA基因启动子结合发挥作用。例如,GmNF-YA3可作为miR169的靶基因在植物干旱胁迫中起到正向调控作用(Nietal., 2013),菊花(Chrysanthemum×morifolium)CmNF-YB8能够与cmo-MIR156基因的启动子结合,通过直接调节衰老途径中cmo-MIR156的表达来影响开花时间(Weietal., 2017),PwNF-YB8是否也会以类似方式发挥作用有待进一步研究。系统发育树(图2B)可以发现,青杄PwNF-YB8与白云杉NF-YB没有发生分离,与模式植物拟南芥AtNF-YB8比较接近,而与木本植物毛果杨的PtNF-YB发生了分离,表明青杄PwNF-YB8在功能上与白云杉一致,预示NF-YB8在云杉家族中比较保守,而在功能上可能与毛果杨存在差异。
NF-YB类亚基与NF-YC类亚基间常通过互作发挥功能。例如: 水稻OsNF-YC12和OsNF-YB9可以与OsGI一起形成功能复合体,在水稻调控网络中发挥功能,调控水稻的穗序(Dasetal., 2019)。同样地,水稻OsNF-YC2和OsNF-YC4可以与OsNF-YB8、OsNF-YB10或OsNF-YB11转录因子相互作用,从而调节水稻光周期开花反应(Kimetal., 2016)。但不是所有YB与YC类亚基都能够互作(Hackenbergetal., 2012a; Thirumuruganetal., 2008),如AtNF-YC12可以与13个AtNF-YB互作,而AtNF-YC13则不与AtNF-YB互作。本课题组在前期的研究中,在筛选Ca2+诱导的青杄花粉cDNA文库时得到了一种NF-YC类转录因子,并将其命名为PwHAP5,随后证实该转录因子能够与PwFKBP12互作,参与花粉管的导向调节(Yuetal., 2011)。同时筛选出3个NF-YB亚基基因,分别命名为PwNF-YB3/8/13,根据NF-Y在植物体内的异源三聚体作用模式推测其可能与PwHAP5互作。通过酵母双杂交试验发现只有PwNF-YB8能与PwHAP5互作,故在此基础上进一步通过双分子荧光互补技术验证了二者的互作。qRT-PCR显示PwNF-YB8在花粉萌发过程中,表达量变化显著,且在36 h达到最高,PwNF-YB8也受到钙离子、硼离子诱导。这些结果显示PwNF-YB8通过与PwHAP5互作可能在青杄花粉发育过程中协同发挥作用。
NF-Y转录因子广泛参与了植物应对非生物胁迫的过程。在拟南芥与玉米中分别过表达AtNF-YB1和ZmNF-YB2的植株,相较于野生型表现出更强的干旱胁迫耐受性(Nelsonetal., 2007)。同样地,异源过表达美洲黑杨PdNF-YB7的拟南芥植株,其耐旱性及水分利用率显著提高(Hanetal., 2013)。小麦TaNF-YB3;1的表达量在模拟干旱条件下显著上升,且ABA受体基因的转录水平在过表达TaNF-YB3;1的植物中上调,这表明TaNF-YB3;1很可能通过调节ABA信号而提高了植物的耐旱性(Yangetal., 2017)。本研究发现PwNF-YB8在青杄各组织中都有表达,且在针叶中表达量也较高。此外,qRT-PCR显示,PwNF-YB8对干旱及盐胁迫有明显响应,这暗示了PwNF-YB8可能参与植物应对非生物胁迫的过程。为了验证这一假说,本研究通过异源转化模式植物拟南芥,研究其在植物应对非生物胁迫过程中发挥的作用。实验室前期在ARBC网站上购买了atnfyb8突变体,但经鉴定发现atnfyb8突变体植株的AtNF-YB8基因表达量并未降低,无法进行后续的表型试验研究(鞠丹,2017),故利用CRISPR/Cas 9技术成功获得拟南芥突变体,进行表型分析。NF-YB亚基能够促进植物在干旱胁迫下的根系生长。在拟南芥中过表达AtHAP3b发现,与野生型植株相比过表达植株的初级根明显伸长,在根尖区域调控细胞分裂和伸长 (Ballifetal., 2011); 在大豆(Glycinemax)中过表达GmHAP3-17发现,在干旱胁迫下其根系生长显著优于野生型植株,植物抗旱性提高(王鼎慧等,2015)。更发达的根系有利于植物抵御干旱胁迫,在甘露醇处理下,异源转化植株的根长明显长于其他株系,显示出了一定耐受性,美洲黑杨PdNF-YB21与PdFUSCA3共同作用,增强了PdNCED3的表达,使ABA含量上升从而增强植物抗旱性(Zhouetal., 2020),PwNF-YB8也在ABA处理下明显响应,推测其可能在类似的ABA信号转导中发挥作用。在干旱胁迫下异源转化拟南芥植株和突变体的种子萌发率、子叶绿化率均低于对照植株,异源过表达PwNF-YB8株系在盐胁迫下萌发率与对照组差异不明显,而突变体植株显示出高敏感性。植物中NF-Y家族庞大,常存在功能冗余或分化现象,拟南芥nf-yc2突变体和过表达烟草NF-YC2的拟南芥植株对光氧化胁迫没有表现出表型差异,这可能与NF-YC亚基之间的冗余性有关,当一个NF-YC基因的表达被抑制时,该家族的另一成员可能弥补了这一缺陷(Hackenbergetal., 2012b)。盐芥(Eutremasalsugineum)中EsNAC1与拟南芥的RD26高度同源,但EsNAC1异源株系与拟南芥同源基因ANAC072的过表达株系显示出不同的表型,且异源株系非生物胁迫抗性的增强是通过调控不同靶基因的表达来实现的(Liuetal., 2018)。由此推测PwNF-YB8与AtNF-YB8在功能上可能存在差异,尤其是在应对干旱和盐胁迫时可能通过靶向不同基因来应对不良环境。
对于针叶树种青杄而言,建立自身体系较为困难,因此利用模式植物拟南芥进行转化、初步鉴定其基因功能。例如在拟南芥中过表达牛心朴子草(Cynanchumkomarovii)CkNF-YB1能够增强植株抗旱性,拟南芥nf-yb3突变体对干旱高敏感,叶片萎蔫程度高,而在突变体中过表达CkNF-YB1后其在干旱胁迫下与野生型一致,说明CkNF-YB1能够弥补AtNF-YB3的缺失,发挥功能(马晓闻,2016)。此外,在拟南芥CO突变体中异源过表达乌桕(Sapiumsebiferum)SsCO基因后开花时间与野生型一致,恢复了突变体晚开花的表型(Pengetal., 2018),在拟南芥attt2突变体中过表达茶树(Camelliasinensis)CsMYB5b能够恢复其种皮原花青素(proanthocyanidins, PAs)的生成使表型恢复(Wangetal., 2019a)。本研究未获得突变体的回补株系,后续可通过在突变体植株中分别过表达青杄NF-YB8和拟南芥NF-YB8,看其是否能够恢复表型,具体机制有待下一步研究。另外,在渗透胁迫条件下,拟南芥hap3b-1和hap3b-2突变体的开花时间明显晚于野生型植物(Chenetal., 2007); 过表达HAP3b的拟南芥对冷敏感而突变体耐寒性增强(梁明祥等,2010)。因此,PwNF-YB8是否参与花期调控或冷胁迫过程,有待于对成苗进行逆境胁迫处理后进一步验证分析。
4 结论
青杄PwNF-YB8基因开放阅读框为489 bp,编码162个氨基酸,其在细胞核、细胞质中均有定位,自身无转录激活活性。PwNF-YB8基因在青杄花粉、针叶中表达量较高,在盐胁迫、干旱胁迫处理下表达量变化显著。PwNF-YB8能够与NF-YC类亚基PwHAP5发生互作,参与青杄花粉萌发过程且受到钙离子、硼离子诱导。相较于野生型植株,过表达PwNF-YB8基因的拟南芥幼苗在干旱、盐胁迫下具有一定的根长生长优势。这些结果表明,PwNF-YB8与PwHAP5可能协同参与了花粉萌发和花粉管生长过程,其在逆境胁迫中发挥一定的作用,但具体抗逆途径有待进一步研究。

