多花黄精内生菌群落结构多样性及其与有效成分含量相关性研究
蔡 媛,刘 浩,孔文平,钟 灿,谢 景,王勇庆,黄建华,张水寒*
多花黄精内生菌群落结构多样性及其与有效成分含量相关性研究
蔡 媛1,刘 浩1,孔文平2,钟 灿1,谢 景1,王勇庆1,黄建华1,张水寒1*
1. 湖南省中医药研究院 中药研究所,湖南 长沙 410006 2. 中南大学湘雅国际转化医学联合研究院,湖南 长沙 410000
通过分析多花黄精内生菌菌群结构多样性及其与主要有效成分含量之间的相关性,探讨多花黄精内生菌对其药材品质的影响。收集不同产地多花黄精样品,采用高通量测序对内生菌群落结构进行分析,并测定多糖、总皂苷等有效成分含量,通过双因素关联分析探究菌群多样性及其与有效成分之间的关系。5个产地15组多花黄精样品共得到1 183 635条有效序列,划分为59 474个操作分类单元(operational taxonomic units,OTU),其中细菌分19门,47纲,120目,201科,419属;属水平上,泛菌属为优势菌群,最大占比达到61.1%。真菌分7门,27纲,70目,132科,187属;属水平上,子囊菌门一未鉴定属、赤壳属为优势菌群,其中赤壳属的最大占比达到10.7%。在丰度前10的内生真菌和细菌中,共有10个菌属与有效物质含量呈显著相关,其中真菌有2个菌属呈负相关,1个菌属呈正相关;细菌2个菌属呈负相关,5个菌属呈正相关。通过分析不同产地多花黄精内生菌群落结构及其多样性,掌握了多花黄精内生菌资源状况,分析发现内生菌与有效成分之间存在关联,这为深入探讨多花黄精内生菌与其品质的相关性,进而采用生物施肥策略提升品质等提供了科学依据。
多花黄精;内生菌;多样性;有效成分;高通量测序
多花黄精Hua.来源于百合科黄精属多年生草本植物,以根茎入药,具有补气养阴、健脾、润肺、益肾等功效[1],主要分布在湖南、贵州、湖北、江西、安徽等地。多花黄精富含多糖、皂苷、黄酮、生物碱和蒽醌类化合物。现代药理研究表明,多花黄精具有抗氧化、调节免疫、抗炎等作用。特别是黄精载入药食同源名录后,多花黄精可以作为临床配方、中成药生产、保健食品配伍、药膳原料使用,具有广阔的开发前景及应用价值[2-5]。
研究表明,药用植物内生菌菌群结构组成随物种及其基因型、生长环境的不同而不同[6-9]。内生菌以植物为宿主载体,二者相互作用形成微生态系统,影响药用植物植株生长、病害发生、逆境抗性等[10-14]。同时,内生菌通过物质循环、能量转换与宿主相互作用进而影响植物内环境氧化还原状态、酸碱度等特性,促进氨基酸、核酸、碳水化合物等养分的转换与储存,加快宿主植物对养分的吸收及代谢,从而提高药材的品质。目前红豆杉、人参、丹参、重楼、西洋参等多种植物已广泛开展内生菌相关研究[15-19]。然而,目前关于多花黄精内生菌结构多样性相关研究国内外鲜有报道,通过研究多花黄精内生菌的多样性,整体把握其内生菌资源状况,寻找可以提高其有效成分含量的内生菌资源,对提高多花黄精药材品质显得尤为必要。
相比于平板稀释涂布法、变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)等,高通量测序具有获得信息量大、样品间平行性好等优点,能更真实全面反映样品中微生物菌群结构,现已广泛应用于内生菌、根际微生物等研究中[20-21]。因此,本研究采用MiSeq测序平台,结合生物信息学分析对多花黄精内生菌菌群结构和多样性进行分析,以期初步探明多花黄精根茎内生菌群体的多样性特征及其潜在功能。同时测定各样地多花黄精样品中有效成分含量,采用双因素关联分析探讨有效成分含量与内生菌之间的关系,为多花黄精内生菌功能菌株的挖掘和采用生物施肥策略提升品质等提供科学依据。
1 材料与试剂
1.1 材料
依据多花黄精的主要分布区域及5点取样法原则,选取安徽芜湖、江西萍乡、湖北宜昌、贵州贵阳、湖南耒阳5个产地采集3年生(依据茎痕的数量进行判别)健康多花黄精样品(表1),每个地点采集15株样品。样品经湖南省中医药研究院生药室副主任刘浩鉴定为多花黄精Hua.。每个省份的样品随机分为3组,每组样品除去泥沙,分成2份,一份用于总DNA提取测序,一份烘干干燥用于多糖等有效物质含量的测定,含量测定和测序的样品一一对应。
1.2 仪器与试剂
UV 2500紫外-可见分光光度计(上海第三分析仪器厂);AUY220型分析天平(日本岛津公司)。-葡萄糖(批号110833-201205)、薯蓣皂苷元(批号111539-200001)、5-羟甲基糠醛(5-HMF)(批号111626-201509)、没食子酸(批号110831-201204)、芦丁(批号100080-201811)对照品均购自中国食品药品检定研究院,质量分数均大于98%。甲醇、无水乙醇、浓硫酸等其他化学试剂均为分析纯。Omega M5635-02 DNA提取试剂盒(美国Omega Bio-Tek公司)。
2 方法
2.1 总DNA提取
取多花黄精的样品表面除菌后切成2半,从中间掏取多花黄精块,然后切成小块并用PBS溶液反复冲洗,取冲洗液于8000 r/min 离心5 min,倒掉上清液,合并沉淀于液氮中冻存后取出立即研磨,参照DNA提取试剂盒说明书进行总DNA的提取。采用琼脂糖凝聚电泳检测所提取DNA的纯度和浓度。

表1 样品采集地的地理位置
2.2 目标片段PCR扩增及测序
以微生物核糖体RNA 16S及ITS等能够反映菌群组成和多样性的目标序列为靶点,根据序列中的保守区域设计相应引物,并添加样本特异性Barcode序列对rDNA基因可变区或特定基因片段进行PCR扩增。细菌PCR扩增所用的引物为V3-V4通用引物,338F引物:5’-ACTCCTACGGG- AGGCAGCA-3’;806R引物:5’-GGACTACHVG- GGTWTCTAAT-3’。真菌ITS扩增通用引物,ITS5F引物:5’-GGAAGTAAAAGTCGTAACA- AGG-3’;ITS1R引物:5’-GCTGCGTTCTTCATC- GATGC-3’。测序委托上海派森诺生物科技股份有限公司完成。
2.3 生物信息学数据分析
根据Barcode序列和PCR扩增引物序列从原始数据中拆分出各样品数据,截去Barcode和引物序列后使用FLASH对每个样品的Reads进行拼接、过滤、去除嵌合体序列,得到有效数据(effective tags)。通过QIIME软件调用UCLUST序列比对工具[22-23],对获得的序列按97%的序列相似度进行归并和操作分类单元(operational taxonomic units,OTU)划分,挑选相对丰度最高的OTU代表序列与基因数据库中的参考序列进行比对,使用RDF分类器对代表序列进行物种注释,并分别在各个分类水平门(phylum)、纲(class)、目(order)、科(family)、属(genus)统计样品每个OTU中的丰度信息,并基于OTU分析计算物种多样性指数,如菌群多样性的Shannon指数、菌群丰度指数Chao1指数及测序深度coverage。
2.4 有效物质含量测定
采用蒽醌-硫酸法测定多糖含量,具体参考《中国药典》2015年版[1]。采用紫外分光光度法测定总皂苷、总黄酮、总酚、5-HMF的含量。
2.5 数据分析
3 结果与分析
3.1 多花黄精内生菌测序序列深度验证
对多花黄精5个产地(15组)根茎样品进行高通量测序,质控后获得高质量序列共1 183 635条。其中细菌547 833条,平均长度分布在360~440 nt,与16 S rDNA V3-V4区序列长度吻合。获得真菌序列635 802条,平均长度分布在340~360 nt,与ITS rDNA序列长度吻合。按照97%相似性,聚类物种操作分类单元,统计各样本在不同OTU中的丰度信息(表2)。稀释曲线反映了样品的取样深度,可以用来评价测序量是否足以覆盖所有类群。各产地OTU稀释曲线如图1所示,曲线趋于平坦,各产地OTU覆盖率均达92.9%~99.9%(表2),说明测序数据量基本合理,真实环境中内生菌群落结构的置信度高,能够比较客观地反映不同产地多花黄精样本的内生菌群落。
3.2 内生菌群操作分类单元OUT及其多样性分析
Venn图直观展示样本中共有和独有OTU得数目,从而反映出样本间OTU组成相似度及共有情况。在OTU水平构建Venn图对样本物种组成进行分析。从图2可以看出,YC内生菌OTU数目最多,LY内生菌OTU数目最少。不同产地多花黄精共有OTU占比较低,内生细菌共有OTU占比为27.1%~48.4%,内生真菌为12.6%~24.8%,说明不同产地多花黄精内生菌群体组成差异明显。这可能是由于植株内环境受外界环境影响,微生物与植株通过长期协同选择进化形成的偏好性。
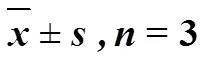
表2 测序数据统计及Alpha多样性指数()

AH、GZ、JX、YC、LY代号与表1相同,下同
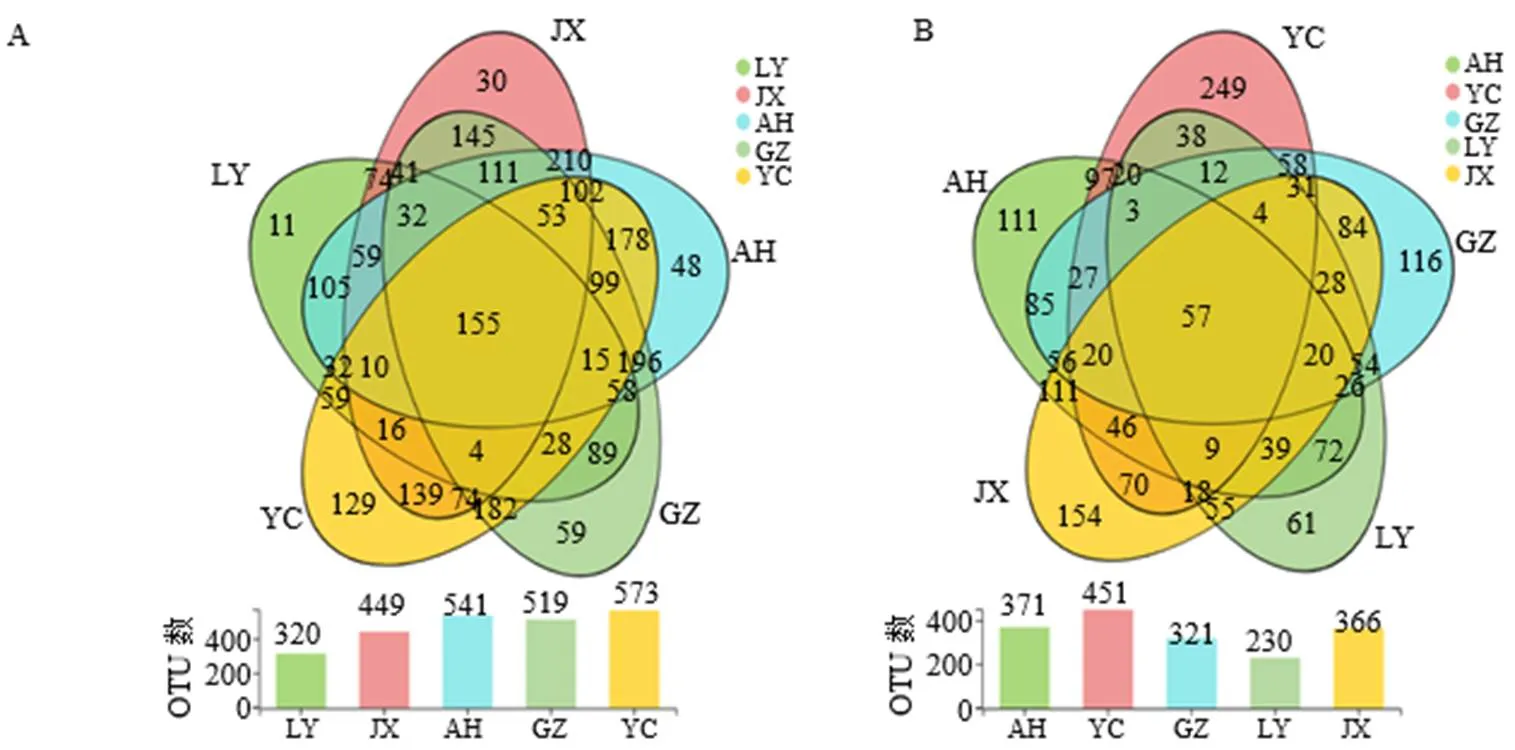
图2 多花黄精内生细菌(A)和真菌(B) 群体OTU分布韦恩图
3.3 多花黄精内生菌群落结构和属水平的优势种群分析
内生细菌从属水平来看,按照至少在1个产地中丰度≥10%,所有OTU总共归于泛菌属Gavini、假单胞菌属Migula、肠杆菌属Hormaeche & Edwards、节杆菌属Busse、嗜糖假单胞菌属Xie & Yokota、寡杆菌属Rapala、志贺氏菌属Castellani & Chalmers、布鲁氏菌属Meyer & Shaw、不动杆菌属Brisou & Prévot、贪铜菌属Makkar & Casida等23个优势菌属,具体如图3所示。其中泛菌属总丰度最高,且该属分布于所采集样品位于的5个省份,在LY样品中占比最大,为61.12%,YC样品中占比最小,为0.88%,如图4所示。还有很多OTU序列未能在属水平归类,说明不同产地多花黄精样品中还存在大量的未知属。内生真菌从属水平分析,按照至少在1个产地中丰度≥10%,所有OTU总共归于子囊菌门下一未知属unclassified-p-、赤壳属E. F. Sm、炭疽属Corda、间座壳属Nitschke、镰刀菌属Link等20个属。其中子囊菌门下一未知属占比最大,其次为赤壳属,且赤壳属在江西占比最为明显,达到了10.7%。从图4对比分析可以看出,多花黄精内生细菌比内生真菌在群落丰富度程度要高,从各样本中看,细菌优势菌群占比没有真菌占比大。

图3 不同产地多花黄精内生细菌(A) 和真菌(B) 优势属组成
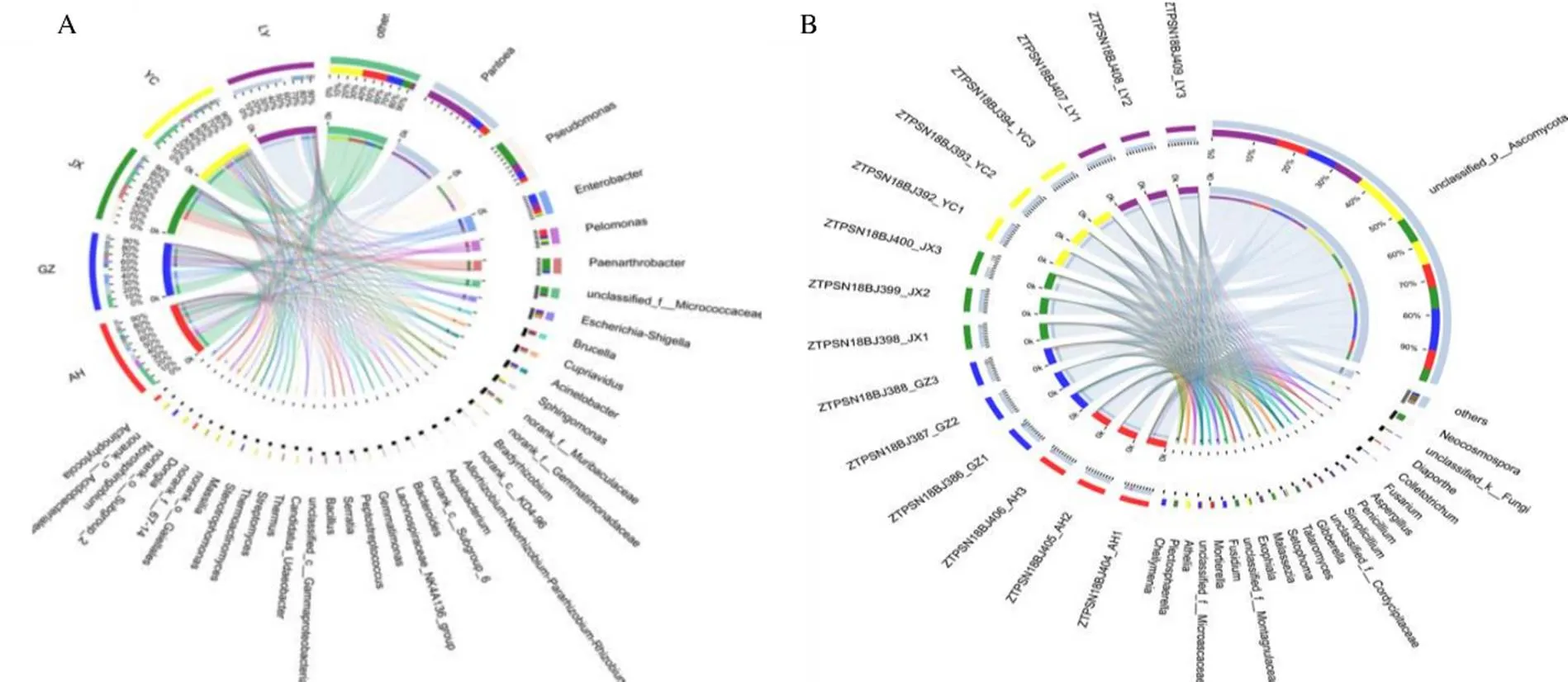
图4 不同产地多花黄精细菌 (A)和真菌(B)优势物种分布比例图
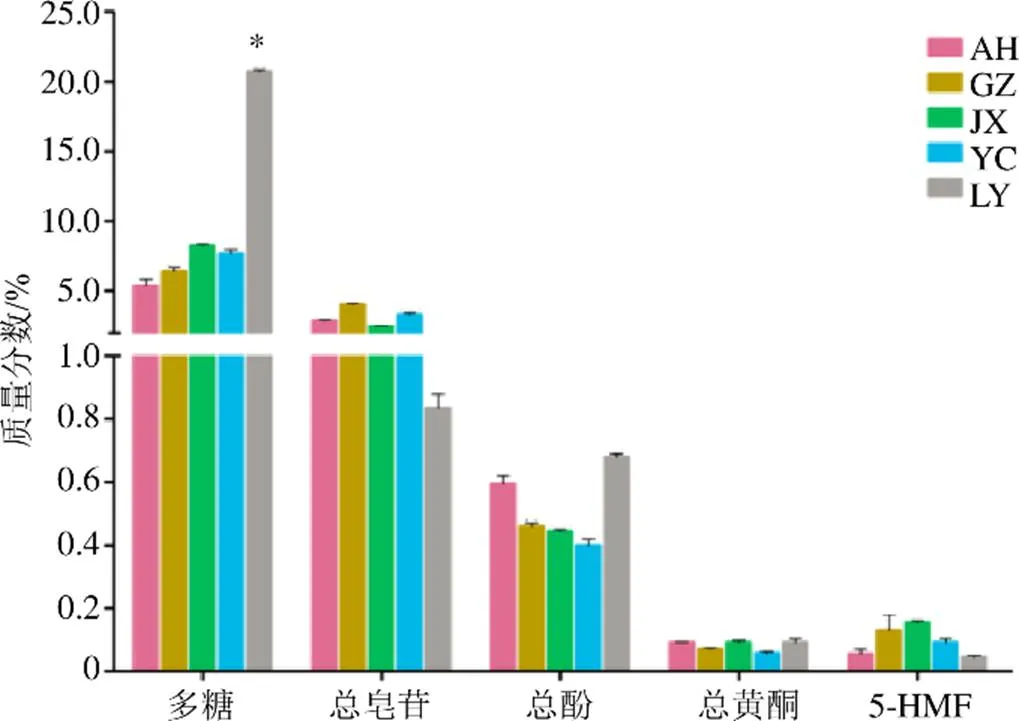
3.4 不同产地多花黄精有效成分含量测定
测定不同产地多花黄精中的多糖、总皂苷、总黄酮、总酚、5-HMF含量如图5所示。《中国药典》2015年版规定,多花黄精中多糖含量不得低于7%。就多糖含量而言,LY>JX>YC>GZ>AH,其中LY含量显著高于其他产地,平均含量达到了20.73%。总皂苷含量,GZ>YC>AH>JX>LY,LY含量最低,平均含量为0.84%。总多酚含量为LY>AH>GZ>JX>YC。总黄酮含量为LY>JX>AH>GZ>YC,各产地间无显著性差异。5-HMF含量为JX>GZ>YC>AH>LY,各产地间无显著性差异。
3.5 多花黄精内生菌菌群与有效成分含量相关性分析
分别选取相对丰度前10的内生细菌和真菌,用皮尔森相关性来研究有效成分含量与物种相对丰度之间的关系,得到二者之间的相关性和显著性值。由表3分析可知,内生真菌炭疽菌属与青霉菌属Link与多糖含量呈显著性负相关,一未知菌属与多酚含量呈显著性负相关,镰刀菌属与5-HMF呈极显著性正相关。内生细菌泛菌属、肠杆菌属Hormaeche & Edwards与多糖及总皂苷含量呈显著性正相关。其中泛菌属与多糖呈极显著性正相关,与总皂苷呈极显著性负相关。假单胞菌属与布鲁氏菌属与总黄酮含量呈极显著性正相关。嗜糖假单胞菌属、布鲁氏菌属、贪铜菌属与总黄酮含量呈显著性正相关。不动杆菌属与5-HMF呈极显著性正相关。相关性网格图见图6。
*P<0.05表示差异显著

表3 有效成分与微生物相对丰度Pearson相关性分析
*<0.05表示显著相关,**<0.01表示极显著相关
*significance at 0.05 level,**super significance at 0.01 level
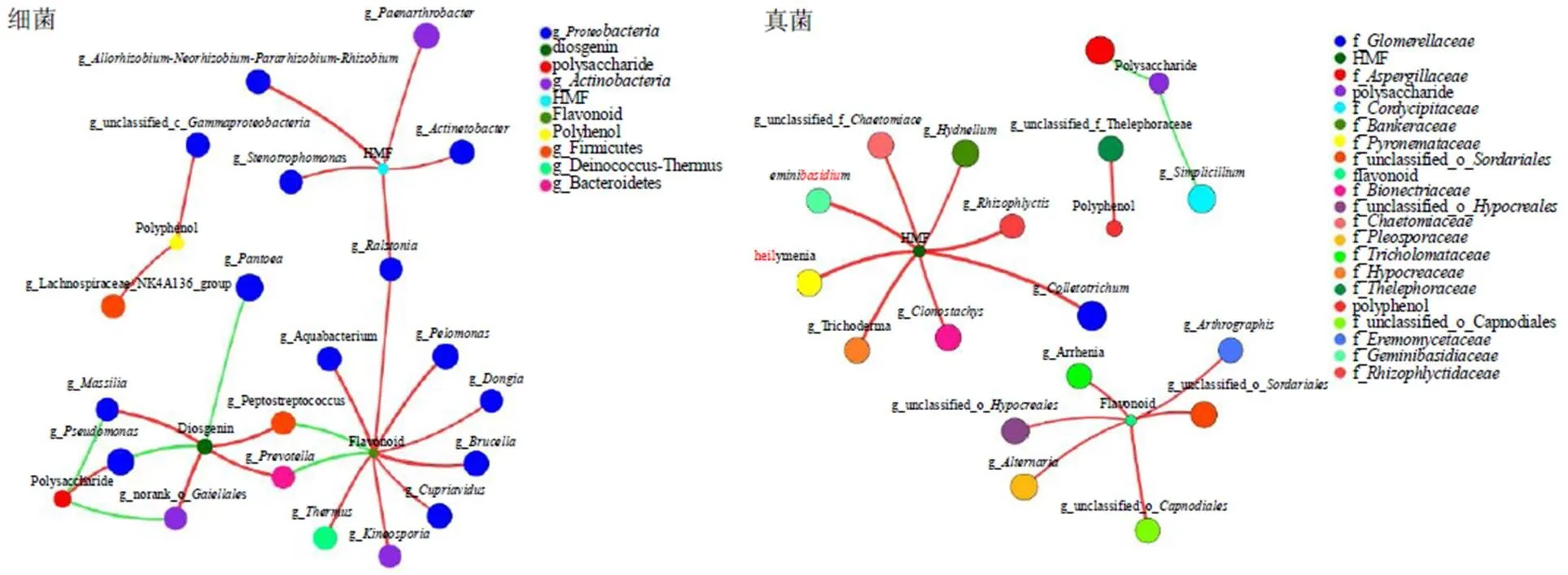
红色表示正相关,绿色表示负相关
4 讨论
药用植物在长期选择进化过程中,不同产地环境气候因子、内环境等因素赋予其不同品质,植物内生菌是植物内部环境的主力军,研究药用植物微生物群落结构组成及其多样性与有效成分之间的关系,对揭示有效成分含量变化、道地药材形成机制具有重要意义[24]。目前有关多花黄精内生菌群体的多样性与有效物质成分含量之间的相关性等研究尚未报道[25]。
本研究利用MiSeq高通量技术,对湖南、安徽、江西、湖北、贵州5个产地15组多花黄精样品进行细菌16S rDNA V3-V4区和ITS rDNA基因测序,将内生菌菌群相对丰度与绝对定量的微生物数量相结合,客观、真实、全面的反映了多花黄精内生菌菌群结构及其多样性。基于各产地OTU及其相对丰度计算Shannon指数和Chao1指数(表2),说明多花黄精根茎中定殖较为丰富的内生菌,这些内生菌不仅数量众多,而且种类也很丰富。某种程度上,内生菌在宿主植物机体内的生物量代表着其与宿主之间进行着频繁的信号和物质交流。在本研究15组样品中,内生细菌的优势菌属是泛菌属,占比最高达到了61.12%,最低0.88%。泛菌属在植物中广泛存在,具有作为生防菌、产生植物激素、溶解磷素、生物固氮等作用。研究者从水稻中分离的内生泛菌属菌株YS19可以分泌生长素、细胞脱落酸、细胞分裂素、赤霉素,对植物的生长发育具有直接促进作用[26]。其次,优势菌属为假单胞菌属,占比范围为0.5%~33.67%。假单胞菌是一类重要的内生菌微生物,能够产生活性物质或者改善矿质营养直接促进植物生长,或者其代谢产物或竞争作用抑制或阻碍其他病原微生物的发生发展,间接促进植物的生长[27]。本研究中相对丰度较高的内生细菌菌属还有肠杆菌属、节杆菌属Busse、鲍氏杆菌属r Rapala和大肠杆菌志贺菌属Castellani & Chalmers等。内生真菌的优势菌群为子囊菌门下一未知鉴定菌属,其次为赤壳属、炭疽属、间座壳属、镰刀菌属等。众所周知,在根和根茎类药材栽培种植过程中,易患根腐病,其具有易传染、致死率高、防治难度大等特点。致病菌是根腐病发生发展的关键所在。本研究测序发现多花黄精内生真菌群落中含有炭疽属、镰刀属等常见致病菌菌属,这为多花黄精栽培种植过程中农业防治方面提供了参考依据。
药用植物的有效成分含量直接对应中药材的品质及其在临床的疗效,是评价药材品质的主要标准。对药材而言,其产地生态环境因子、内环境因子等是中药有效成分生物合成的反应条件,与中药材质量及其道地性等紧密相关。内生菌作为其内环境主要影响因素,参与药材质量形成过程,且发挥着重大作用。Kumar等[28]研究者在姜黄根茎接种圆褐固氮菌能够显著提高姜黄根茎生物量及姜黄素的含量,其中姜黄素的含量提升达到了6%。Tiwari等[29]对长春花外植体接种其内生菌,显著增强了长春花碱、苦艾碱等有效成分的含量。本研究采用皮尔森相关分析方法,将多花黄精内生菌优势菌群与其有效成分多糖、总黄酮、总皂苷、总多酚、5-HMF含量进行相关性研究。采用Cytoscape软件绘制丰度排名前10的优势内生菌与有效成分双因素相关性网络图,更直观地反映出优势菌群与有效成分含量之间的相关性,从图6可以看出,菌群与有效成分含量之间关联错综复杂,同一菌群可与不同种类的有效物质关联。如菌与多糖含量之间存在正相关,却与总皂苷之间存在负相关,这可能是该优势菌群参与了成分的分解代谢,改变了碳代谢流的方向。不同菌群之间也存在相互影响进而共同影响有效成分的含量,其具体机制值得进一步研究。
本研究初步显示多花黄精根茎内定殖种类丰富的内生菌菌群,其与多花黄精有效成分含量关系密切,证明内生菌在多花黄精生长发育及其代谢过程中参与了多花黄精药材品质的变化,值得进一步研究。进一步的工作将重点从以下几个方面进行:(1)继续挖掘不同条件下多花黄精内生菌资源,完善其分离分类鉴定方法,建立健全的内生菌物种资源库。通过横向比较分析,探究其内生菌群地理分布规律,为深入探索药材道地性奠定基础。(2)分离多花黄精内生菌菌株,通过内生菌消除、回染实验等分析验证优势菌群对多糖、皂苷等有效成分含量的影响及其相关作用机制。(3)建立活性菌株、抗重金属等特性菌株筛选体系,分离内生菌菌株,评估其活性成分生产及抗重金属能力,筛选获得具有药用应用化生产潜力、减低重金属聚积等具有开发实用价值的菌株。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2015: 216.
[2] 陶爱恩, 张晓灿, 杜泽飞, 等. 黄精属植物中黄酮类化合物及其药理活性研究进展[J]. 中草药, 2018, 49(9): 2163-2171.
[3] 孔瑕, 刘娇娇, 李慧, 等. 黄精多糖对高脂血症小鼠脂代谢相关基因mRNA及蛋白表达的影响[J]. 中国中药杂志, 2018 , 43(18): 3740-3747.
[4] 赵文莉, 赵晔, Yiider T. 黄精药理作用研究进展[J]. 中草药, 2018, 49(18): 4439-4445.
[5] 秦臻, 韦正新, 宰青青, 等. 黄精降低活性氧水平促进衰老内皮祖细胞功能的研究 [J]. 中国药理学通报, 2019, 35(01): 123-127.
[6] Hassani M A, Durán P, Hacquard S. Microbial interactions within the plant holobiont [J]., 2018, 6(1): 58.
[7] Li O, Xiao R, Sun L H,. Bacterial and diazotrophic diversities of endophytes indetermined through barcoded pyrosequencing [J]., 2017, 12(9): e0184717.
[8] 沈湛云, 朱波, 张泉龙, 等. 不同产地玄参内生真菌种群结构的比较分析[J]. 中草药, 2019, 50(4): 957-962.
[9] Chowdhary K, Kaushik N. Fungal endophyte diversity and bioactivity in the Indian medicinal plantlinn [J]., 2015, 10(11): e0141444.
[10] 崔晋龙, 郭顺星, 肖培根. 内生菌与植物的互作关系及对药用植物的影响 [J]. 药学学报, 2017, 52(2): 214-221.
[11] 贾敏. 薏苡内生真菌多样性及其与薏苡药材品质相关性研究 [D]. 上海: 第二军医大学, 2014.
[12] 魏东. 东北地区刺五加()内生细菌/真菌微生物群落组成及分布研究[D]. 哈尔滨: 东北林业大学, 2017.
[13] Jia M, Chen L, Xin H L,. A friendly relationship between endophytic fungi and medicinal plants: A systematic review [J]., 2016, 7: 906.
[14] 李婷, 姜丹, 胡小松, 等. 基于高通量测序技术对市售柏子仁表面真菌多样性的研究 [J]. 药学学报, 2019, 54(11): 2100-2105.
[15] Stierle A, Strobel G, Stierle D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew [J]., 1993, 260(5105): 214-216.
[16] Dhayanithy G, Subban K, Chelliah J. Diversity and biological activities of endophytic fungi associated with[J]., 2019, 19(1): 22.
[17] 刘学周, 赵智灵, 李绍宾, 等. 西洋参内生菌群落结构与多样性 [J]. 微生物学报, 2015, 55(3): 330-340.
[18] 蒋靖怡, 王铁霖, 池秀莲, 等. 基于高通量测序的紫花丹参与白花丹参根际细菌群落结构研究 [J]. 中国中药杂志, 2019, 44(8): 1545-1551.
[19] 王艳, 常帆, 程虎印, 等. 重楼根际及药用部位内生真菌多样性与群落结构差异分析 [J]. 中草药, 2019, 50(5): 1232-1237.
[20] Lucas S, Omneya Ahmed O, Stefan B,. Microbial community composition and diversity via 16S rRNA gene amplicons: evaluating the illumina platform [J]., 2015, 10: 116955-116973.
[21] Wen C, Wu L, Qin Y,. Evaluation of the reproducibility of amplicon sequencing with Illumina MiSeq platform [J]., 2017, 12: 176716-176721.
[22] Magoč T, Salzberg S L: FLASH: fast length adjustment of short reads to improve genome assemblies [J]., 2011, 27: 2957-2963.
[23] Edgar RC: Search and clustering orders of magnitude faster than BLAST [J]., 2010, 26: 2460.
[24] 刘珍珍, 谷萌萌, 张臣.基于高通量测序的三七微生物群落结构特征分析[J]. 中草药, 2020, 51(1): 204-209.
[25] 汪滢, 王国平, 王丽薇, 等. 一株多花黄精内生真菌的鉴别及其抗菌代谢产物 [J]. 微生物学报, 2010, 50(8): 1036-1043.
[26] 沈德龙, 冯永君, 宋未. 成团肠杆菌的生物功能多样性及其分类最新进展 [J]. 微生物学杂志, 2002(1): 40-42.
[27] 陈晓斌, 张炳欣, 何勇强. 假单胞菌属生防菌株的遗传工程改良 [J]. 微生物学通报, 2000(4): 293-296.
[28] Kumar L, Ajay A, Ritu S,. Effect of Azotobacter chroococcum CL13 inoculation on growth and curcumin content of turmeric (L.) [J]., 2014, 3(9): 275-283.
[29] Tiwari R, Awasthi A, Mall M,. Bacterial endophyte mediated enhancement of in planta content of key terpenoid indole alkaloids and growth parameters of[J]., 2013, 43: 306-310.
Study on community and diversity of endophyte and its correlation with active ingredient content in
CAI Yuan1, LIU Hao1, KONG Wen-ping2, ZHONG Can1, XIE Jing1, WANG Yong-qing1, Huang Jian-hua1, ZHANG Shui-han1
1. Institute of Traditional Chinese Medicine, Hunan Academy of Chinese Medicine, Changsha 410006, China 2. Xiangya International Academy of Translational Medicine, Central South University, Changsha 410000, China
To explore the effect of endophyte on the quality ofby analyzing the correlation between community and diversity of endophyte and the content of active ingredient.from different locations were collected; High-throughput sequencing technology was used to analyze endophyte and the content of active ingredient were determined, including polysaccharides, total saponins and so on. The relationship between the diversity of endophyte and the active components was explored through two-factor correlation analysis.The results showed that 1 183 635 effective sequences were obtained from 15 samples ofin five different places, which were divided into 59 474 operational taxonomic units (OTUs). The endophytic bacteria were divided into 19 phyla, 47 classes, 120 orders, 201 families, and 419 genera among them. At the genus level, Pantoea was the dominant genus, which the largest proportion amounted to 61.1%. The endophytic fungi were divided into 7 phyla, 27 classes, 70 orders, 132 families, and 187 genera. At the genus level, an unidentified genus from Ascomycota and Neocosmospora were the dominant genus, the largest proportion of Neocosmospora reached 10.7%. Among the abundance ratio of the top 10 endophytic fungi and bacteria, a total of 10 genera were significantly correlated with the content of active ingredients, which were two negative correlation and one positive correlation in fungi genus. Two and five genera of bacteria were negatively and positively correlated, respectively.The results master the endophyte resources ofby analyzing the community and diversity of endophyte from different habitat samples. It is showed that there is an interaction between endophyte and active ingredient. The present analysis provides a scientific basis for in-depth discussion of the interaction mechanism between endophyte and character of, and the use of biological fertilization strategies to improve quality in the future.
Hua; endophyte; diversity; active ingredient; high-throughput sequencing
R282
A
0253 - 2670(2021)13 - 4023 - 08
10.7501/j.issn.0253-2670.2021.13.025
2020-11-06
国家自然科学青年基金项目(81503197);湖南省自然科学青年基金项目(2018JJ3310);湖南省中医药管理局项目(201810);湖南省中医药研究院自主项目(201705);湖南创新型省份建设科技扶贫政策性项目(2019NK3010-02)
蔡 媛,助理研究员,研究方向为中药学。E-mail: tcmyuanyuan@163.com
张水寒,研究员,研究方向为中药学。E-mail: zhangshuihan0220@126.com
[责任编辑 时圣明]