参芪地黄汤对糖尿病肾病模型大鼠肾组织中TGF-β1及VEGF表达的影响
瞿 飞 高金梅 赵 杰 廖加抱
(1.嘉兴市中医医院,浙江 嘉兴 314001;2.福建中医药大学附属人民医院,福建 福州 350004;3.云南中医医院,云南 昆明 650021)
糖尿病可引起肾功能衰退,最终发展为糖尿病肾病(DN)。据统计,糖尿病患者中约有25%~50%会出现DN,长期的DN会发展为肾衰竭,严重威胁患者生命[1]。近年来研究发现,转化生长因子β1(TGF-β1)及血管内皮生长因子(VEGF)的异常表达是糖尿病出现肾损伤的重要机制之一,通过调控TGF-β1与VEGF表达,可改善DN患者肾功能[2-3]。近年来,中药治疗DN取得了十分显著的疗效[4-5]。参芪地黄汤最早记载于《杂病源流犀烛》,临床可用于治疗脾肾亏虚、气阴不足型DN[6],但其缓解DN的作用机制尚不明确。本研究通过建立大鼠DN模型,灌胃不同剂量参芪地黄汤,观察参芪地黄汤对DN模型大鼠的治疗作用,同时检测大鼠肾组织VEGF及TGF-β1表达水平,探索参芪地黄汤缓解DN的作用机制,现报道如下。
1 实验材料
1.1 实验动物 雄性SD大鼠,体质量(200±20)g,购于北京华阜康生物科技有限公司。大鼠饲养于SPF级清洁环境中,自由进食,室温(22±2)℃。本研究经嘉兴市中医医院实验伦理委员会同意。
1.2 主要试剂及仪器 盐酸贝纳普利片(诺华制药有限公司);高糖高脂饲料(斯贝福生物科技有限公司);链脲霉素(STZ,Sigma);血糖试纸(罗氏公司);肌酐试剂盒、尿素氮试剂盒、尿蛋白试剂盒(南京建成生物科技有限公司);RNA提取、反转录、扩增试剂盒(天根生物科技有限公司);兔抗鼠VEGF(货号:ab1316)和 TGF-β1(货号:ab15715)一抗,羊抗兔免疫组化二抗(货号:ab6721,Abcam);多功能读板机(Thermo);光学显微镜(Nikon ECLIPSE TS100);荧光定量PCR仪(Bio-RADiQTM5)。
1.3 药物 参芪地黄汤药液制备:分别称取人参6 g、黄芪15 g、熟地黄15 g、山药15 g、茯苓9 g、牡丹皮9 g、山萸肉9 g、生姜3片、大枣10枚(中药均购置于嘉兴市中医医院中药房),加入8倍量水浸泡2 h,煎煮2次,每次煎煮30 min,过滤药渣,将得到的药液浓缩至6 g生药/mL,4 ℃冷藏备用。盐酸贝纳普利药液制备:盐酸贝纳普利用去离子水配制成1.5 mg/mL的混悬液。
2 实验方法
2.1 分组与造模、给药 将60只大鼠随机分为正常组、模型组、西药对照组和参芪地黄汤低、中、高剂量组,每组10只。除正常组外,其余各组建立DN模型。采用高脂高糖饲料(配料为:67%正常饲料,20%蔗糖,10%猪油,2.5%胆固醇,0.5%胆酸钠)喂养大鼠6周,诱导出现胰岛素抵抗,腹腔注射枸橼酸钠溶解的STZ(剂量为35 mg/kg),注射后继续高糖高脂饲料喂养,持续12周[7]。注射STZ后,西药对照组和参芪地黄汤低、中、高剂量组每日分别灌胃盐酸贝纳普利1 mg/kg和参芪地黄汤4.5、9、18 g生药/kg,正常组和模型组每日灌胃等量生理盐水,均每日1次,连续灌胃12周。各治疗组处方量均按照《中药药理研究方法学》中,人与实验动物体表面积折算等效剂量比换算而来,其中中剂量组为人等效剂量。
2.2 指标检测
2.2.1 血糖 注射STZ后,各组大鼠每2周1次断尾采血,检测血糖水平,共12周。
2.2.2 肾功能生化指标 干预12周后,每只大鼠分别置于代谢笼中24 h,留尿期间禁食,自由饮水,收集各组大鼠24 h尿液,计算24 h尿量。之后对大鼠进行麻醉,主动脉取血,收集血清,运用试剂盒检测各组大鼠血清中肌酐(Cr)、尿素氮(BUN)含量,记录24 h尿蛋白水平。
2.2.3 肾组织病理表现 取大鼠左侧肾脏,用福尔马林溶液固定,常规脱水、透明、包埋、切片,HE染色,光镜下观察肾组织病理学变化并拍照。
2.2.4 荧光定量PCR检测肾组织中VEGF、TGF-β1 mRNA表达 取大鼠右侧肾脏,用试剂盒提取肾组织中总RNA,使用UV法检测每个样品中的总RNA浓度。将纯度合格的样本进行反转录合成cDNA,采用SYBR Green Real Time RT-PCR试剂盒对cDNA模板进行扩增,qPCR仪检测各组大鼠肾组织中VEGF及TGF-β1 mRNA表达,采用β-actin为内参,具体引物序列见表1。

表1 引物序列
2.2.5 免疫组化法检测肾组织中VEGF、TGF-β1蛋白表达 一抗稀释倍数:VEGF(1∶1000),TGF-β1(1∶2000);二抗稀释倍数:1∶4000。光学显微镜下对肾组织免疫组化结果进行拍照,运用Image J软件对拍照后的图片中VEGF及TGF-β1阳性表达区域进行量化,计算出平均光密度[8]。
2.3 统计学方法 运用SPSS Statistics 17.0统计软件对各组大鼠检测指标进行统计分析。符合正态分布的计量资料以(±s)表示,正态分布判断:小样本采用Shapiro-Wilk(SW)检验(P>0.05为正态性),以及通过Q-Q图方法判断。计量资料符合正态分布且满足方差齐性检验,组间比较采用两独立样本t检验,两组以上采用单因素方差分析,若方差齐则采用LSD事后比较(两两比较),若方差不齐,则采用Dunnett T3进行两两比较。P<0.05判断为差异有统计学意义。
3 实验结果
3.1 各组大鼠血糖比较 造模开始后,与正常组比较,模型组和各给药组大鼠血糖均显著升高(P<0.05);药物干预12周时,各给药组大鼠血糖均明显低于模型组(P<0.05)。见图1。

图1 注射STZ后各组大鼠血糖变化(±s,n=10)
3.2 各组大鼠肾功能生化指标比较 干预12周时,造模大鼠血清Cr、BUN及24 h尿蛋白水平均显著高于正常组(P<0.05),各给药组上述指标明显低于模型组(P<0.05),各给药组上述指标水平组间比较差异无统计学意义(P>0.05),见表2。
表2 干预后各组大鼠肾功能相关生化指标水平比较(±s)
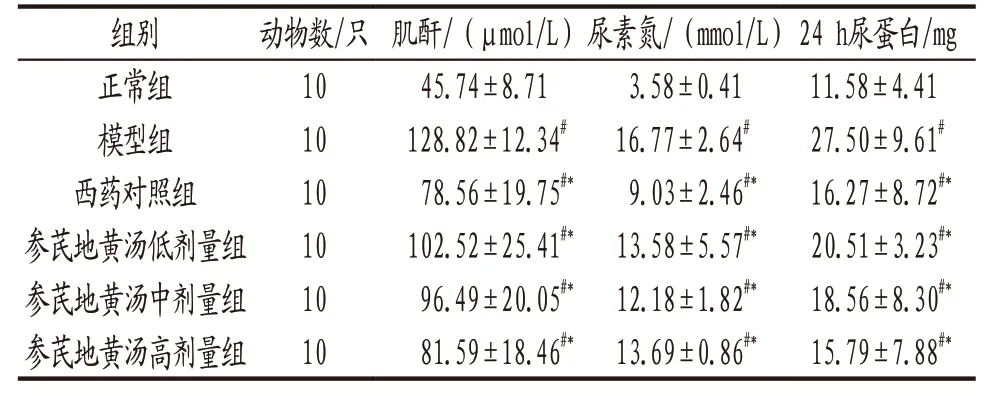
表2 干预后各组大鼠肾功能相关生化指标水平比较(±s)
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05。
组别 动物数/只 肌酐/(μmol/L)尿素氮/(mmol/L)24 h尿蛋白/mg正常组 10 45.74±8.71 3.58±0.41 11.58±4.41模型组 10 128.82±12.34# 16.77±2.64# 27.50±9.61#西药对照组 10 78.56±19.75#* 9.03±2.46#* 16.27±8.72#*参芪地黄汤低剂量组 10 102.52±25.41#*13.58±5.57#* 20.51±3.23#*参芪地黄汤中剂量组 10 96.49±20.05#*12.18±1.82#* 18.56±8.30#*参芪地黄汤高剂量组 10 81.59±18.46#*13.69±0.86#* 15.79±7.88#*
3.3 各组大鼠肾组织病理表现比较 模型组大鼠肾组织出现明显的炎细胞浸润及肾小球增生,肾小管明显扩张,肾小管上皮细胞空泡样变并伴部分肾小管上皮细胞坏死、脱落;西药对照组、参芪地黄汤中、高剂量组大鼠肾组织中炎细胞浸润、肾小球增生及肾小管上皮细胞坏死明显减轻,参芪地黄汤低剂量组大鼠肾组织中炎细胞浸润有所减轻,但仍伴有部分肾小管上皮细胞坏死、脱落。见图2。

图2 干预后各组大鼠肾组织病理表现(HE染色,×200)
3.4 各组大鼠肾组织VEGF及TGF-β1 mRNA表达比较 模型组大鼠肾组织中VEGF、TGF-β1 mRNA表达与正常组相比显著上调(P<0.05);与模型组比较,西药对照组和参芪地黄汤中、高剂量组大鼠肾组织中VEGF mRNA表达显著下调(P<0.05),各给药组大鼠肾组织中TGF-β1 mRNA表达显著下调(P<0.05);各给药组上述指标组间比较,差异均无统计学意义(P>0.05)。详见表3。
表3 干预后各组大鼠肾组织VEGF及TGF-β1 mRNA表达比较(±s)

表3 干预后各组大鼠肾组织VEGF及TGF-β1 mRNA表达比较(±s)
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05。
组别 动物数/只 VEGF TGF-β1正常组 10 0.57±0.09 0.35±0.19模型组 10 1.00±0.05# 1.00±0.02#西药对照组 10 0.66±0.07*0.80±0.06*参芪地黄汤低剂量组 10 1.12±0.27# 0.71±0.23*参芪地黄汤中剂量组 10 0.68±0.16*0.57±0.18*参芪地黄汤高剂量组 10 0.75±0.06*0.62±0.09*
3.5 各组大鼠肾组织VEGF及TGF-β1蛋白表达比较 免疫组化结果表明,VEGF阳性表达区域主要位于肾小球上皮细胞与肾小球基底膜,TGF-β1阳性表达区域主要位于肾小管及肾小球间质。与正常组比较,模型组大鼠肾组织中VEGF及TGF-β1阳性表达水平明显升高(P<0.05);与模型组比较,各给药组大鼠肾组织中VEGF阳性表达水平显著下降(P<0.05),西药对照组和参芪地黄汤中、高剂量组大鼠肾组织中TGF-β1阳性表达水平显著下降(P<0.05);各给药组上述指标组间比较,差异均无统计学意义(P>0.05)。见图3、表4。
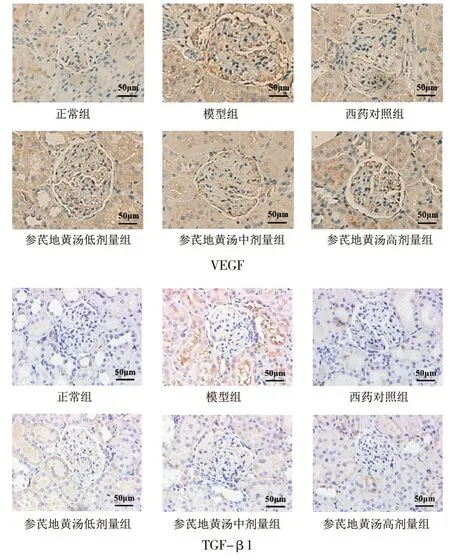
图3 干预后各组大鼠肾脏免疫组化染色(×200)
表4 干预后各组大鼠肾组织VEGF及TGF-β1免疫组化平均光密度值比较(±s)

表4 干预后各组大鼠肾组织VEGF及TGF-β1免疫组化平均光密度值比较(±s)
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05。
组别 动物数/只 VEGF TGF-β1正常组 10 0.37±0.05 0.19±0.08模型组 10 1.13±0.16# 0.57±0.17#西药对照组 10 0.63±0.14#* 0.33±0.02#*参芪地黄汤低剂量组 10 0.71±0.18#* 0.38±0.10#参芪地黄汤中剂量组 10 0.65±0.05#* 0.26±0.08*参芪地黄汤高剂量组 10 0.58±0.15#* 0.23±0.04*
4 讨论
本研究结果表明,模型组大鼠血糖明显升高,说明发生糖尿病,且血清肌酐、尿素氮及24 h尿蛋白水平均较正常组显著升高,提示肾功能出现损害,与DN患者临床血清生化检测结果相吻合;病理染色同样在模型组中观察到了明显的肾小球细胞增生、炎细胞浸润及部分肾小管上皮细胞坏死、脱落,这与DN的组织病理学变化相一致[1]。结合以上结果,提示DN模型建立成功。既往动物实验表明参芪地黄汤对DN大鼠具有一定的治疗作用[9]。此外,参芪地黄汤联合桃红四物汤可显著降低DN患者血糖,同时缓解DN患者肾功能生化指标[10]。我们研究同样表明给DN模型大鼠灌胃参芪地黄汤后,血糖降低,中剂量及高剂量可显著改善DN模型大鼠肾功能相关生化指标及肾组织形态,提示参芪地黄汤对DN具有明显的疗效。
肾脏中的VEGF和TGF-β1表达异常与DN密切相关,VEGF在肾小球足细胞、肾小管和集合管细胞中广泛表达,肾组织中的VEGF参与维持肾小球滤过功能,此外也有研究表明VEGF可调控足细胞活性。糖尿病患者长期的高血糖可损害肾小球及肾小管细胞内皮细胞,从而使肾组织中VEGF表达异常,过度表达的VEGF可促使上皮细胞形成血管环,损伤肾小球的滤过功能。此外,VEGF的过度表达也是导致DN蛋白尿的重要原因之一[2]。本研究观察到模型组大鼠肾组织有明显的肾小球增生,同时模型组大鼠24 h尿蛋白显著升高,提示肾小球滤过功能损伤。qPCR及免疫组化结果表明模型组大鼠肾组织中VEGF表达显著上调,表明肾组织中VEGF的上调是引起DN模型大鼠肾小球滤过功能损害及肾小球增生的机制之一。此外,高血糖可促使肾组织中TGF-β1表达升高,进而促使肾组织中细胞外基质的黏附与过度沉积,可引起肾小球增生硬化及肾小管纤维化,同时也可加剧肾组织中炎症反应[3]。下调肾组织中TGF-β1表达可缓解DN[3,11]。本研究观察到模型组大鼠肾组织出现明显炎细胞浸润,同时伴有TGF-β1表达的升高,提示TGF-β1表达的上调可能是引起DN大鼠肾组织炎症反应的机制之一。参芪地黄汤可显著降低DN模型大鼠肾组织中VEGF、TGF-β1基因及蛋白水平,表明参芪地黄汤可通过降低DN模型大鼠肾组织中VEGF和TGF-β1表达,改善肾小球滤过率及肾组织炎症反应,进而发挥治疗DN的作用。
综上,参芪地黄汤对DN模型具有明显的疗效,且能明显改善肾组织病理表现,推测其可能的作用机制与降低肾组织VEGF和TGF-β1表达有关。各给药组的作用效果比较未见统计学差异,考虑与样本量小或样本误差有关,并不能说明参芪地黄汤能替代盐酸贝纳普利,参芪地黄汤低剂量组对VEGF、TGF-β1基因及蛋白表达效果不一致亦可能为样本误差,均需进一步研究。

