鲟鱼肌肉脱脂工艺研究
赵文宇,徐璐,祁立波,姜鹏飞,秦磊,白帆,董秀萍*
(1.国家海洋食品工程技术研究中心,海洋食品精深加工关键技术省部共建协同创新中心,辽宁省海产品精深加工产业共性技术创新平台,大连工业大学食品学院,辽宁 大连 116034;2.衢州鲟龙水产食品科技开发有限公司,浙江 衢州 324000)
鲟鱼(Acipenser sinensis)是体形较大、寿命较长的一种淡水鱼[1]。 随市场需求增加,我国鲟鱼养殖业不断发展。 但目前鲟鱼精深加工技术相对滞后,产品形式较为单一,主要为鱼籽酱等。 鱼籽酱生产过程存在大量加工副产物,鱼肉占比大。 鲟鱼肉厚、无肌间刺、味道鲜美、营养价值高[2],亟需开发利用。 与其它养殖鱼类相比,鲟鱼鱼肉脂肪含量较高,易发生氧化酸败、产生不良气味, 影响加工过程并缩短相关产品的货架期,增加运输和贮藏的难度。 因此在加工鲟鱼时,应考虑对其进行适度的脱脂处理。
脂肪对水产品原料加工适应性及品质有较大的影响[3],脱脂技术在水产品加工中应用广泛。 漂洗法、压榨法、有机溶剂萃取法、碱皂化法和酶法是目前常用的水产品脱脂方法。 对比其它方法,酶法脱脂作用条件温和,能专一水解甘油三酯的酯键[4],减少对其它成分的破坏且安全性高, 已成为重要的脱脂方式之一。 目前,相关研究主要以脱脂率为指标对脱脂工艺进行优化。 另有欧阳杰等[5]以脱脂前后鱼糜弹性和白度衡量脱脂效果;王旋等[6]测定脱脂鱼片干制过程的氧化酸败程度以体现脱脂效果。 但目前对脱脂后样品的脂肪酸组成、组织形态、挥发性组分的研究比较有限。
本研究以人工养殖的俄罗斯鲟鱼为代表,探究适宜的酶法脱脂条件,旨在为鲟鱼产品的精深加工提供依据。
1 材料与方法
1.1 材料与试剂
冷冻俄罗斯鲟鱼:体长600 mm~750 mm,质量约4 kg/条~5 kg/条,衢州鲟龙水产食品科技开发有限公司。 俄罗斯鲟鱼捕获后,宰杀、去头、去尾、去内脏后置于-40 ℃冷冻待用,使用时4 ℃解冻6 h,取背部鱼肉。
碱性脂肪酶(酶活35 000 U/g):深圳市绿维康生物有限公司;氢氧化钠、浓硫酸(分析纯):西格玛奥德里奇(上海)贸易有限公司;甘氨酸、五水硫酸铜(分析纯):天津市大茂化学试剂公司;正己烷(色谱纯):德国Meker 公司;甲醇(色谱纯):Sigma-Aldrich 公司;改良油红O 染色液: 北京雷根生物技术有限公司; 烷烃(C8~C20)标准品(色谱纯):瑞士Fluka Buchs 公司。
1.2 仪器与设备
UDK129 全自动凯氏定氮仪:意大利VELP 公司;CM1950 冷冻切片机:德国Leica 公司;BX51 型倒置显微镜:日本Olympus 公司;气相色谱-质谱联用仪:美国Agilent 公司。
1.3 试验方法
1.3.1 原料预处理
将鲟鱼鱼肉置于4 ℃解冻6 h 后,取背部肌肉,切成长、宽、厚为5 cm×3 cm×0.5 cm 的肉片待用。
1.3.2 鲟鱼肌肉酶法脱脂工艺的优化
将碱性脂肪酶溶解在甘氨酸(C2H5NO2)-氢氧化钠(NaOH)缓冲溶液中即为脱脂液,采用鱼肉浸泡于脱脂液的方式,在温度30 ℃、料液比1∶3(g/mL)的条件下进行酶法脱脂单因素试验,因素基本条件设置为:pH9.0、脱脂时间50 min。 各因素梯度设置为:酶浓度10、20、30、40、50 U/mL;浸泡时间30、40、50、60、70 min;pH 值7.0、8.0、9.0、10.0、11.0。 每次改变一个因素,以鲟鱼肌肉的脱脂率和蛋白质损失率为指标。 试验重复3 次,结果取平均值。
1.3.2.1 脱脂率测定
参照国标GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》中的索氏抽提法对脱脂前后肌肉脂肪含量进行测定,并计算脱脂率。每一指标重复测定3次,结果取平均值。 参照应巧玲等[7]的方法按下式计算脱脂率。
脱脂率/%=(A0-A)/A0×100
式中:A0为脱脂前鲟鱼肌肉脂肪含量,g;A 为脱脂后鲟鱼肌肉脂肪含量,g。
1.3.2.2 蛋白质损失率测定
参照国标GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》中的凯氏定氮法对脱脂前后肌肉粗蛋白含量进行测定,并计算蛋白质损失率。 每一指标重复测定3 次,结果取平均值。 参照Cansu 等[8]的方法,按下式计算蛋白质损失率。
蛋白质损失率/%=(F0-F)/F0×100
式中:F0为脱脂前鲟鱼肌肉蛋白质含量,g;F 为脱脂后鲟鱼肌肉蛋白质含量,g。
1.3.3 脂肪酸含量测定
参考Yin 等[9]的方法,采用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)法测定脱脂前后鱼肉的脂肪酸组成,采用内标法进行定量。
1.3.4 冷冻组织切片
参照杨宏旭等[10]的方法制作鱼肉的冷冻组织切片。参照王肖燕等[11]的方法,采用改良油性O 染色法对冷冻组织切片进行染色,观察脂肪分布。
1.3.5 挥发性物质测定
参考Huang 等[12]的方法采用顶空固相微萃取结合气相色谱-质谱联用(solid-phase micro-extraction and gas chromatography-mass spectrometry,SPME-GC-MS)技术对脱脂前后的鱼肉进行挥发性风味物质的测定。
1.3.6 数据处理及统计分析
所得试验数据使用Excel 2016 进行处理; 使用SPSS 19.0 分析数据,显著性水平设定为p<0.05;采用Origin 2018 进行作图。
2 结果与分析
2.1 单因素试验结果
2.1.1 酶浓度对脱脂率和蛋白质损失率的影响
酶浓度对鲟鱼肌肉脱脂率和蛋白质损失率的影响见图1。

图1 酶浓度对鲟鱼肌肉脱脂率和蛋白质损失率的影响Fig.1 Effects of lipase concentration on degreasing rate and protein loss rate of sturgeon muscle
从图1 可以明显观察到脱脂率随酶浓度的提高先增大后减小,于20 U/mL 时达到最大值29.85%,之后脱脂率逐渐降低,这一变化可能是由于脱脂过程酶催化油脂水解反应是可逆反应[13],随着酶浓度持续提高,水解反应向右进行,生成的甘油和脂肪酸堆积,反应便又逆向进行,发生酯化反应生成更多甘油酯,从而脱脂速率减缓。 在酶浓度提高的同时蛋白质损失率也随之提高, 这是因为脱脂过程部分水溶性蛋白溶出,且在碱溶液中蛋白质易发生水解反应[14],造成蛋白质损失。 综上,20 U/mL 为较适酶浓度,此时脱脂率达到最大值,蛋白质损失率相对较小。
2.1.2 浸泡时间对脱脂率和蛋白质损失率的影响
浸泡时间对鲟鱼肌肉脱脂率和蛋白质损失率的影响见图2。
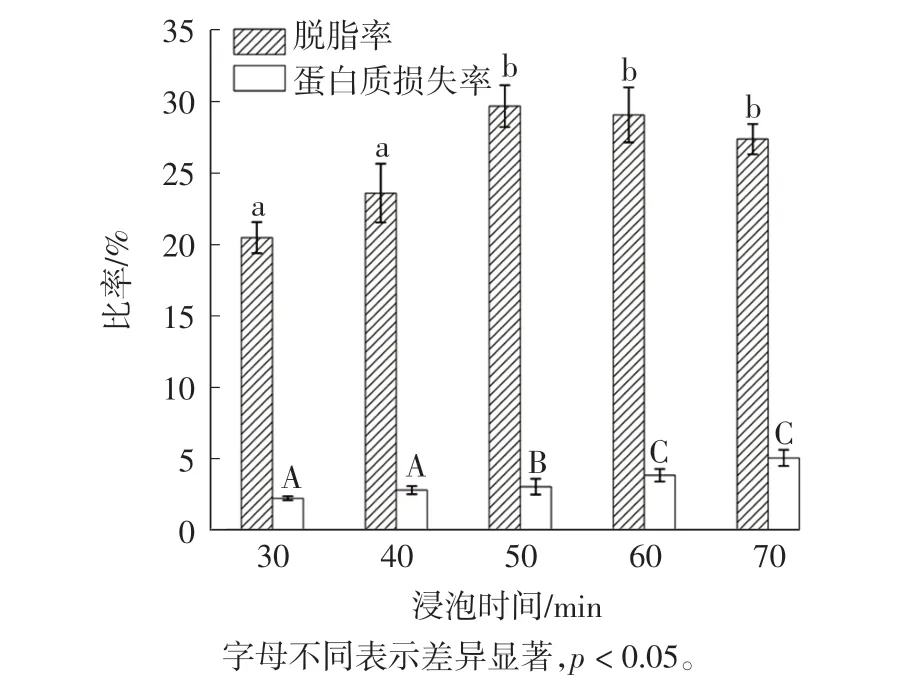
图2 浸泡时间对鲟鱼肌肉脱脂率和蛋白质损失率的影响Fig.2 Effects of soaking time on degreasing rate and protein loss rate of sturgeon muscle
通过图2 可知,随着浸泡时间的延长,脱脂率有所提高,当浸泡时间超过50 min 后脱脂率反而有一定下降,可能原因是随着酶促反应进行,底物处于限速浓度,酶促反应速率降低,这与徐海菊等[15]对大黄鱼脱脂的研究结果一致。 随着脱脂时间的延长,蛋白质不断损失,造成鱼肉肌肉组织结构松散,对后续加工不利,因此当浸泡时间为50 min 时能达到最大脱脂率,同时蛋白质损失率相对较小。
2.1.3 pH 值对脱脂率和蛋白质损失率的影响
pH 值对鲟鱼肌肉脱脂率和蛋白质损失率的影响见图3。

图3 pH 值对鲟鱼肌肉脱脂率和蛋白质损失率的影响Fig.3 Effects of pH value on degreasing rate and protein loss rate of sturgeon muscle
pH 值影响酶分子的带电性,从而影响酶活性[16]。通过图3 可知,脱脂率起初随着pH 值提高而增加,这是因为适宜的碱性条件有利于脂肪酸水解,生成的脂肪酸钠盐是一种良好的乳化剂, 有助于脱脂率的提高。当酶反应环境pH 值>9 时脱脂率下降, 原因可能是酶在碱性过强的脱脂液环境下失活。 蛋白质损失率随着pH 值的增加逐渐升高, 尤其当pH 值从10 增加到11时,蛋白质损失率迅速增高,这可能与肌肉中可溶性蛋白的损失有关。综上,当脱脂液pH 9 时,能实现最好的脱脂效果。
2.2 酶法脱脂对鲟鱼肌肉脂肪酸组成的影响
脱脂前后鲟鱼肌肉脂肪酸组成见表1。

表1 脱脂前后鲟鱼肌肉脂肪酸组成Table 1 Fatty acid composition of sturgeon muscle before and after degreasing

续表1 脱脂前后鲟鱼肌肉脂肪酸组成Continue table 1 Fatty acid composition of sturgeon muscle before and after degreasing
脂肪酸的种类和比例是决定鱼肉品质的重要因素之一[17]。 脂肪酸中不饱和脂肪酸等成分提升了鱼肉本身的营养价值[18],也构成了鱼肉特有的风味[19]。 脱脂后鲟鱼肌肉脂肪酸种类由24 种减少至22 种, 这是由于脱脂过程脂肪最终被水解为脂肪酸盐。 脱脂前肌肉不饱和脂肪酸(unsaturated fatty acid,UFA)、饱和脂肪酸(saturated fatty acid,SFA) 的相对含量分别为71.05%、27.53%; 酶法处理后, 二者相对含量分别为75.68%、31.28%。 脱脂前后鲟鱼肌肉脂肪酸组成变化较小,不饱和脂肪酸实现了较好的保留,与王旋等[20]的研究结果一致。 鲟鱼肌肉多不饱和脂肪酸中二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosahexaenoic acid,DHA)含量相对较高为2.32%、5.35%。脱脂后二者变化不大为2.10%、4.78%。综上,采用酶法脱脂有效保留的不饱和脂肪酸能赋予鱼肉适当的风味,更好地保留鱼肉的营养成分。
2.3 酶法脱脂对鲟鱼肌肉组织形态的影响
鲟鱼肌肉脱脂前后的肌肉组织结构图如图4 所示。
肌原纤维是肌肉的主要成分,温度、pH 值、高压、超声等外源条件均会使肌原纤维结构发生变化,如膨胀、收缩、破裂[21]。 从图4 可以观察到脱脂后鲟鱼肌肉纤维破裂现象增多,肌肉组织更加松散。 这是由于脂肪酶水解过程会导致部分肌原纤维蛋白变性,肌原纤维束收缩,最终引起肌肉组织破裂,这也可以用来解释脱脂过程蛋白质损失的现象。

图4 鲟鱼肌肉脱脂前后的肌肉组织结构图(20×)Fig.4 Photos(20×)of sturgeon muscle tissue before and after degreasing
2.4 酶法脱脂对鲟鱼肌肉脂肪分布的影响
鲟鱼肌肉组织脱脂前后的脂肪分布变化见图5。

图5 鲟鱼肌肉组织脱脂前后的脂肪分布变化Fig.5 Sturgeon muscle tissue in fat distribution before and after degreasing
采用改良油性O 染色方法对组织切片进行染色,可使脂肪染成深红色。 从图5 可以明显观察到脱脂前后鲟鱼肌肉组织中深红色区域显著减少,说明大量脂肪被脂肪酶水解,脂肪含量降低。 鲟鱼肌肉组织在酶法脱脂处理后更为松散, 结果与图4 肌肉组织形态切片结果一致。
2.5 酶法脱脂对鲟鱼肌肉腥味物质的影响
鲟鱼肌肉脱脂前后挥发性风味成分的GC-MS 结果见表2。

表2 鲟鱼肌肉脱脂前后挥发性风味成分的GC-MS 结果Table 2 Results for GC-MS identification of sturgeon muscle volatile flavor compounds before and after degreasing
水产品腥味形成的重要原因是风味前体物质氧化产生大量的挥发性化合物。鲟鱼脱脂前共鉴定出13种挥发性风味物质,酶法脱脂后主要检测到11 种风味物质且峰面积显著减小,说明脱脂后鲟鱼肉的挥发性风味物质相对含量明显降低。 醛类对鱼肉风味有很大影响,含量较高时往往会产生令人不愉快的气味。表2中可见己醛在鲟鱼样品中含量很高,而鱼体中鱼腥味化合物的主要成分包括己醛。 张红燕等[22]发现了金枪鱼油中的腥味物质包括1-辛烯-3-醇和4-壬醇等,脱脂前后鲟鱼肉中均存在以上物质且含量较多。 酮类物质中2,3-辛二酮含量明显减少。 酮类具有脂肪味,对腥味有增强作用。 总的来说,酶法脱脂处理的鲟鱼肌肉可在一定程度上将醛类、酮类等对腥味影响较大的化合物除去,脱脂的同时达到一定去腥的效果。
3 结论
经筛选确定鲟鱼肌肉酶法脱脂工艺条件为:酶浓度20 U/mL、pH 9、浸泡时间50 min,此时可控制得到适宜蛋白质损失率并实现较好的脱脂效果。 酶法脱脂后的鱼肉在脂肪酸组成、组织形态、脂肪分布、腥味物质可达到较好效果。

