荧光染料对短须裂腹鱼早期鱼苗的浸泡标记研究
李茂华,李天才,曾如奎,赵宇航,宋昭彬,杨 坤
(1.四川大学生命科学学院,生物资源与生态环境教育部重点实验室,成都 610065; 2.雅砻江流域水电开发有限公司,成都 610051; 3.西华师范大学生态研究院,西南野生动植物资源保护教育部重点实验室,四川南充 637002)
鱼类人工增殖放流是保护或恢复天然渔业资源的重要措施之一。国际上对鱼类增殖放流多持谨慎态度,提出了“负责任的增殖放流”概念,提倡先进行实验性放流,持续监测放流群体,避免发生无意义甚至有害的增殖放流[1-3]。我国鱼类资源非常丰富,特有种类多,但受过度捕捞、水体污染和水利水电工程修建等影响,渔业资源严重衰退,鱼类濒危物种数逐年升高[4-5]。为依法保护和合理利用水生生物资源,实施可持续发展战略,我国已将人工增殖放流作为一项长期的基本政策,每年放流苗种数百亿尾(粒)。不过,我国大部分增殖放流活动没有对放流鱼类进行标记,也缺少对鱼类放流后的长期跟踪监测[6-7]。
耳石荧光标记是一类在鱼类增殖放流中已经大量应用的批量标记方法,适用于鱼类仔、稚、幼鱼等早期生长阶段或小型鱼类[8]。通常,将一些易与钙离子结合的荧光物质,通过溶液浸泡或加入饵料投喂的方式进入鱼体,沉积在耳石上形成荧光标记。常用的荧光物质有四环素类(tetracycline)、茜素络合物(alizarin complexone,AC)、茜素红(alizarin Red S,ARS)和钙黄绿素(calcein,CAL)等,其中AC和ARS的标记效果较好[8]。但耳石荧光标记也存着一些缺点,如安全浓度不高(通常为50~200 mg/L)、容易对鱼体造成损伤,因而需在实施前开展大量实验弄清合适条件[9-11]。此外,该方法提供标记信息的模式很少,通常只能重复标记,而重复次数是极其有限的[10]。如果能寻找到更多荧光物质标记并组合使用,则可在一定程度上增加标记信息。
短须裂腹鱼(Schizothoraxwangchiachii)为鲤科(Cyprinidae)裂腹鱼亚科(Schizothoracinae)裂腹鱼属的鱼类,主要分布于金沙江及其支流雅砻江、乌江等水系[12]。过去的二十年间,由于受水利水电工程修建、过度捕捞等影响,短须裂腹鱼野外资源量衰退明显[13-15]。为弥补人类活动造成的不利影响,近年来金沙江、雅砻江流域修建了许多鱼类增殖放流站,采用当年人工繁殖当年放流的方式,陆续开展了大规模的鱼类人工增殖放流[15-17]。短须裂腹鱼放流苗种一般为全长4~12 cm的幼鱼,规格较小。目前,迫切需要使用合适的方法标记短须裂腹鱼放流群体,进行“标记-重捕”研究,科学评估增殖放流效果,以及时调整、优化放流策略,使人工增殖放流达到资源增殖和物种保护的目的。鉴于此,本研究使用盐酸四环素(tetracycline hydrochloride,TC)、AC、ARS和CAL浸泡标记短须裂腹鱼早期鱼苗(仔、稚鱼),并探讨与茜素络合物同属蒽醌类化合物的酸性茜素蓝B(acid alizarin blue B,AAB)、茜素黄GG(alizarin yellow GG,AYG)浸泡标记短须裂腹鱼的可行性,以期为短须裂腹鱼大规模标记和放流效果评估提供参考。
1 材料与方法
1.1 鱼苗来源与管理
研究所用短须裂腹鱼早期鱼苗均由雅砻江锦屏·官地水电站鱼类增殖放流站人工繁殖和培育。用于繁殖的亲鱼为2011-2012年捕捞自雅砻江大河湾江段的野生个体。实验所需鱼苗根据标记方案从该站随机选取,但确保同一次实验的鱼苗日龄、规格基本一致。实验过程中,鱼苗饲养在21.5 cm(长)×13.5 cm(宽)×6.5 cm(高)的白色塑料水槽中,贮洁净的养殖水1 L。每天8:00、12:00、16:00、20:00分别饱食投喂浮性颗粒饲料(凤凰牌);每天吸取污物一次并换水1/3,每两天彻底换水一次并清洗水槽;每天8:00、14:00、20:00测量水温并记录。每次浸泡标记开始前,饥饿24 h。浸泡标记结束后彻底清洗水槽并换上洁净的养殖水,然后根据实验方案继续饲养。
1.2 试剂与配制
本研究所用的荧光物质为AC、ARS、AAB、AYG、TC和CAL,均为分析纯的粉剂(合肥博美生物科技有限责任公司)。用洁净的养殖水,根据实验方案配制成不同浓度的溶液,每个空白对照组及实验组溶液均为1 L。鱼苗取样或测量时使用MS-222溶液(约100 mg/L)麻醉处理。
1.3 标记方案
1.3.1 AC标记
随机选取8日龄短须裂腹鱼570尾,全长(15.23±0.88)mm(n=20),平均分成19组,每组30尾。其中一组作为空白对照,其余18组使用AC溶液浸泡标记,每组实验条件由浸泡浓度50、100、150、200、250、300 mg/L和浸泡时间6、12、24 h两两组合,水温为(14.7±0.9)℃。20、55日龄短须裂腹鱼浸泡标记实验与此相同,鱼苗全长分别为(16.51±0.71)、(25.58±1.43)mm,水温分别为(15.3±1.5)、(15.2±0.8)℃。不过,55日龄鱼苗规格较大,仅使用190尾,每组10尾。为评估AC标记对鱼体生长的影响,在20日龄短须裂腹鱼浸泡标记结束16 d之后,使用游标卡尺测量各组鱼体全长(精确至0.01 mm),然后将鱼体保存在99.7%的酒精中。8日龄和55日龄实验组则在浸泡结束10 d后,直接将鱼体全部保存在99.7%的酒精中,以待摘取耳石。
1.3.2 AC或ARS重复标记
随机选取50日龄短须裂腹鱼稚鱼340尾,全长(25.58 ± 1.24) mm(n=20),均分为17组,每组20尾,其中1组作空白对照组, 8组作AC重复标记实验组,剩余8组作ARS重复标记实验组。(1)AC重复标记实验:按照表1的方案,使用100、200、300、400 mg/L的AC溶液浸泡标记其中8组,每个浓度按浸泡时间分2组,水温(14.7±1.0)℃,第一次浸泡结束后继续饲养至83日龄,全长(35.02 ± 1.62) mm(n=10),使用同样的条件重复标记各组尚存活的鱼体一次,水温(16.0 ± 0.8)℃,但将原浸泡时间为12 h的组延长至48 h。(2)ARS重复标记实验:使用ARS溶液浸泡标记其余8组,标记过程与AC重复标记相同,方案见表1。第二次浸泡标记结束10 d后,将鱼体全部保存在99.7%的酒精中,以待摘取耳石。
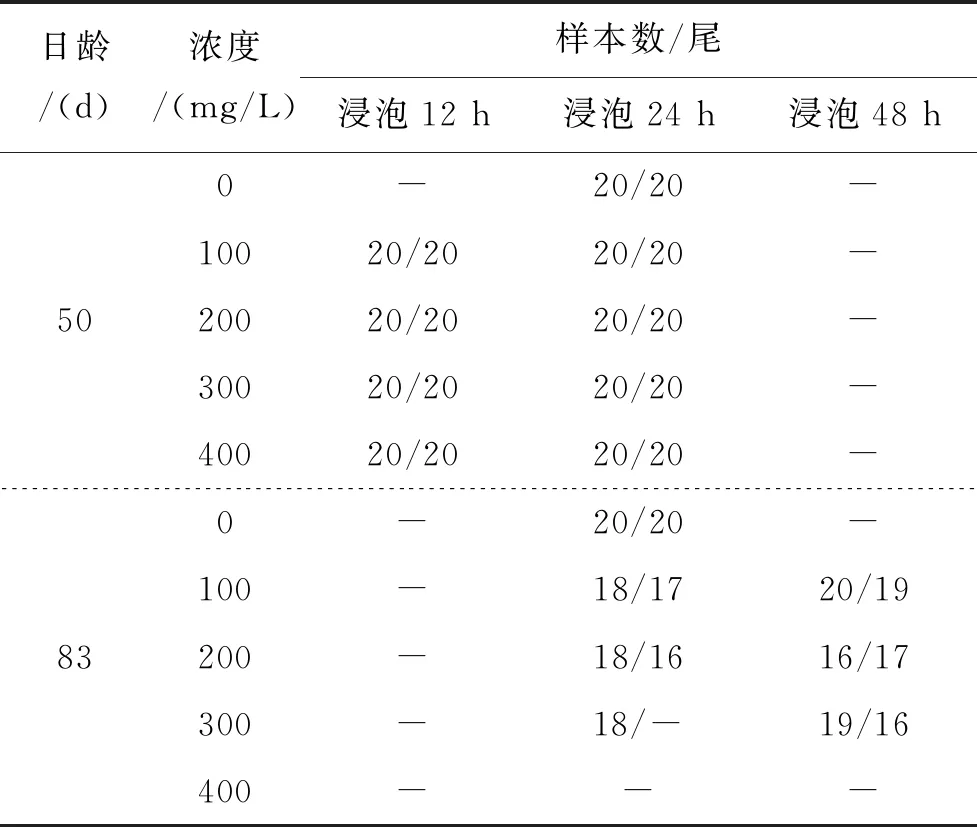
表1 使用AC或ARS重复标记短须裂腹鱼实验方案
1.3.3 TC标记
随机选取8日龄短须裂腹鱼仔鱼210尾,全长(15.23±0.88)mm(n=20),平均分成7组,每组30尾。然后分别使用0(空白对照组)、50、100、150、200、250、300 mg/L的TC溶液浸泡24 h,水温(14.7±0.9)℃。浸泡结束30 d后,将鱼体全部保存在99.7%的酒精中。
1.3.4 其他荧光染料的标记
随机选取22日龄短须裂腹鱼仔鱼390尾,全长(16.27±0.34)mm(n=20),平均分成13组,每组30尾,其中一组作为空白对照组。荧光物质CAL溶液浓度依次为100、200、400、800 mg/L,AYG及AAB溶液浓度依次为50、100、150、200 mg/L,分别使用相应浓度的染料浸泡鱼体24 h,水温(16.3±0.3)℃。浸泡结束40 d后,将鱼体全部保存在99.7%的酒精中。
1.4 耳石摘取与标记检测
在解剖镜下,用解剖针剖开短须裂腹鱼头骨,取出3对耳石(微耳石、矢耳石和星耳石), 依次用清水、99.7%酒精清洗、晾干,再用中性树胶封固于载玻片上,最后贴上标签,放置在无尘干燥处晾干。在Olympus BX40荧光显微镜下,使用10×物镜,分别在普通白光、绿光(滤光片WG,主波长546 nm)、蓝光(滤光片WB,主波长495 nm)、紫外光(滤光片WU,主波长365 nm)四种光下观察荧光标记的耳石。根据初步观察结果,选择其中一种荧光效果最好的激发光,用于评价耳石荧光标记质量。为量化分析,依据Yang等[10]的方法,将标记质量分为六个等级。当标记质量 ≥ 3时定为优质标记。检测分两次独立进行,当两次结果出现不一致时,再进行第三次检测,以确定一个唯一的检测结果。使用显微镜连接的Q-Imaging MicroPublisher 5.0 RTV CCD为耳石拍照。
1.5 数据分析
实验数据使用Excel 2013初步整理后,使用SPSS 19.0对AC标记的死亡率、标记质量进行方差分析和线性回归分析,20日龄AC标记实验的短须裂腹鱼全长比较也采用方差分析。以P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 荧光标记的检测光
在四种光下的观察结果显示:AC、ARS标记的短须裂腹鱼耳石在普通白光下可观察到深浅不一的紫红色,在其他三种光源下则均可观察到明显的橘红色标记环,绿光下最明显,蓝光次之,紫外光最弱;TC、AYG、AAB和CAL标记的耳石没有观察到标记;所有空白对照组的耳石也没有观察到标记(图1)。因而,选用绿光检测AC和ARS的标记质量。
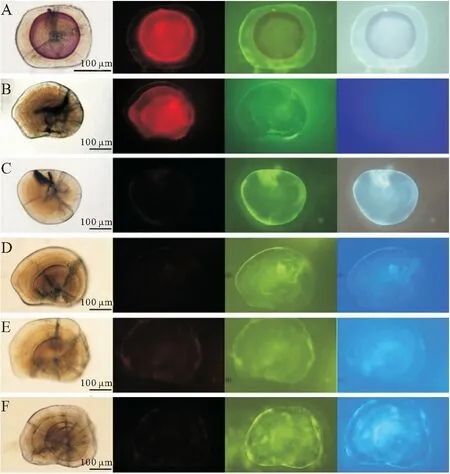
图1 不同激发光下荧光标记的短须裂腹鱼微耳石
2.2 AC标记
AC标记的耳石在绿光下均能够观察到橘红色标记,标记率100%;标记条件不同,标记质量存在差异(图2)。因8日龄时短须裂腹鱼仔鱼仅有部分个体的星耳石原基形成,故这里没有对星耳石分析。方差分析(Four-way-ANOVA:只考虑主效应,事后检验Turkey HSD)结果表明:标记质量受鱼体全长、AC溶液浓度和浸泡时间的显著影响;微耳石和矢耳石之间的标记质量无明显差异(表2)。线性回归分析的结果显示:Q=-0.605x+0.013y+0.053z+10.872(R2=0.667,Q为标记质量,x为全长,y为溶液浓度,z为浸泡时间)。表明标记质量随着AC溶液浓度和浸泡时间的升高而提高,随着鱼体全长的增加而降低。
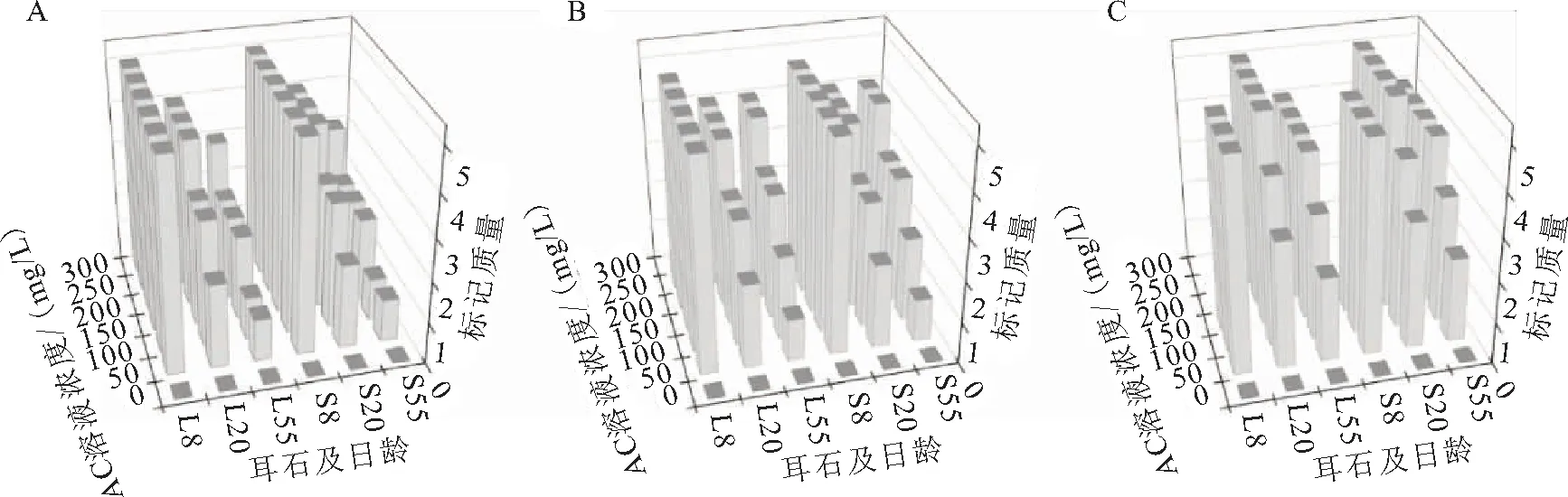
图2 AC标记短须裂腹鱼的标记质量
不同实验条件下短须裂腹鱼死亡率存在差异(表2)。方差分析(Three-way-ANOVA:只考虑主效应,事后检验Turkey HSD)结果表明:死亡率受到鱼体全长和AC溶液浓度显著影响,受浸泡时间的影响不显著(表3)。线性回归分析的结果显示:M=-0.088x+0.001y+0.007z+1.304(R2=0.434,M为死亡率,x为全长,y为溶液浓度,z为浸泡时间)。表明死亡率随着AC溶液浓度和浸泡时间的增加而升高,随着全长的增长而降低。
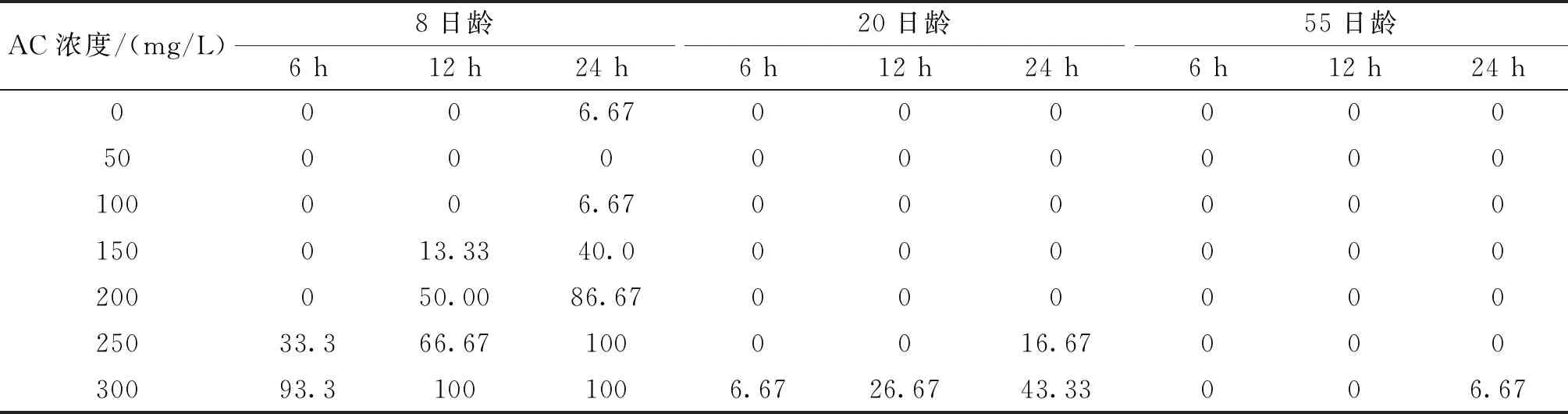
表2 AC标记短须裂腹鱼的死亡率
20日龄短须裂腹鱼AC浸泡标记结束16 d后,与空白对照组相比(One-Way-ANOVA:事后检验Dunnett),除AC溶液浓度300 mg/L、浸泡时间24 h的这组鱼体全长显著较低外(P<0.05),其他各组鱼体全长没有显著差异(P>0.05,表3)。

表3 AC标记短须裂腹鱼的标记质量和死亡率方差分析结果
2.3 AC重复标记
AC重复标记的耳石在绿光下均能观察到两个区分明显的橘红色标记环(图3,A),标记率100%。相同的标记条件,微耳石标记质量最高,矢耳石次之,星耳石最低(图4);首次标记和再次标记的标记质量差异很小。浸泡时间12 h的组,100~300 mg/L的AC溶液首次标记没有造成50日龄鱼体死亡;83日龄重复标记时将浸泡时间延长至48 h,100 mg/L组仍没发生死亡,但200、300 mg/L组的死亡率均为100%(表4)。浸泡时间24 h的组,100~300 mg/L的AC溶液在首次标记时除300 mg/L组和空白对照组各死亡1尾外,其他组均没有出现鱼体死亡;在83日龄重复标记时,100 mg/L组仍没有死亡,但200、300 mg/L组死亡率均为100%(表4)。400 mg/L的AC溶液造成的死亡率极高,第一次标记时已接近100%。
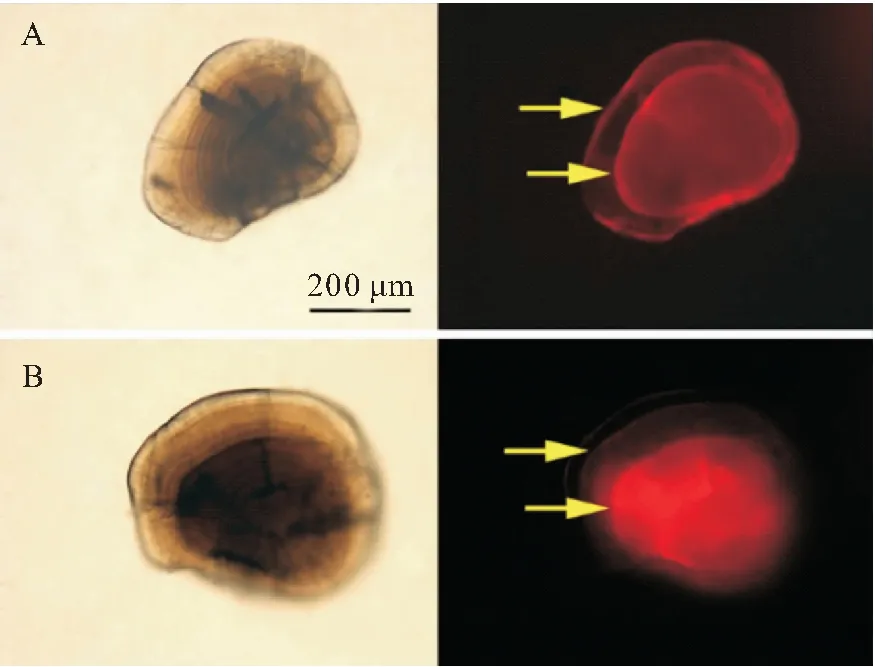
图3 AC和ARS重复标记的短须裂腹鱼微耳石
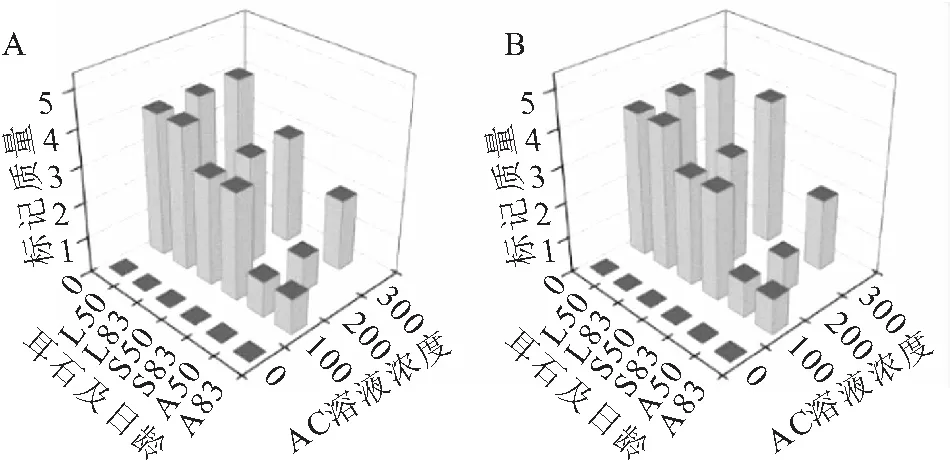
图4 AC重复标记短须裂腹鱼的标记质量
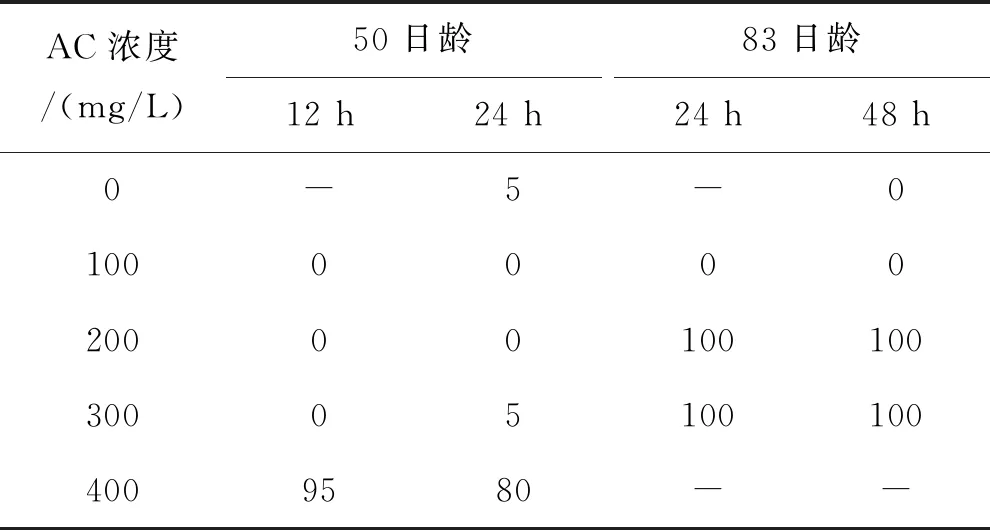
表4 AC重复标记短须裂腹鱼稚鱼的死亡率
2.4 ARS重复标记
ARS重复标记的耳石在绿光下均能观察到两个橘红色标记环(图3,B),标记率100%;同样的标记条件,微耳石和星耳石的标记质量较高,矢耳石次之(图5);首次标记和再次标记的标记质量差异很小。浸泡时间12 h的组,100~300 mg/L的ARS溶液造成的死亡率与空白对照组相同(均为1尾),400 mg/L 的ARS造成的死亡率则为100%;83日龄重复标记时将浸泡时间延长为48 h,100 mg/L组死亡率仅为5.88%(死亡1尾),但200、300 mg/L组的死亡率明显升高,分别为41.18%、100%。浸泡时间24 h的组,100和200 mg/L的ARS溶液在首次标记和重复标记均没有造成鱼体死亡,300、400 mg/L组则在首次标记时就表出现极高死亡率(表5)。
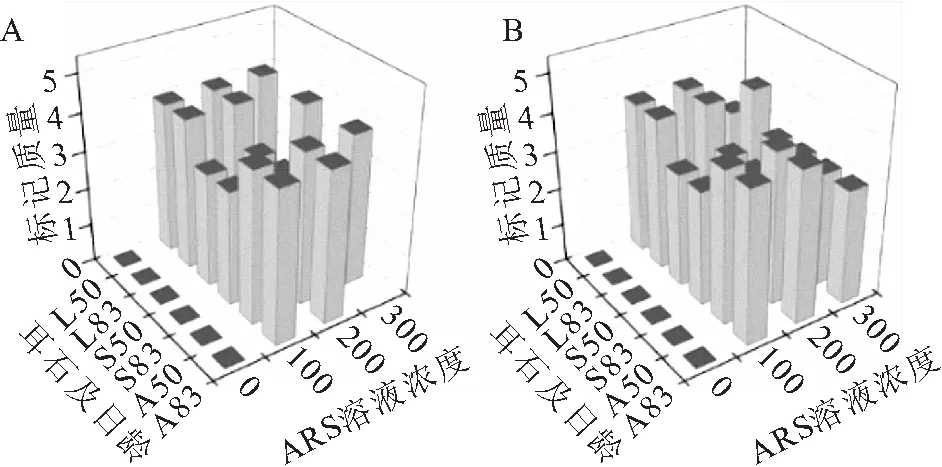
图5 ARS重复标记短须裂腹鱼的标记质量

表5 ARS重复标记短须裂腹鱼稚鱼的死亡率
2.5 TC、CAL、AYG和AAB标记
使用TC、CAL、AYG和AAB浸泡的短须裂腹鱼均没有在耳石观察到荧光标记(图1)。50~300 mg/L的TC溶液浸泡标记8日龄短须裂腹鱼仔鱼造成的死亡率极低,仅300 mg/L这组为3.33%(1尾),低于空白对照组的6.67%(2尾)(表6)。CAL造成的死亡率较低,直至800 mg/L才造成死亡率激增。相比之下,AYG、AAB则分别在50、100 mg/L时即已出现较高死亡率(表6)。

表6 其他荧光染料浸泡标记短须裂腹鱼的死亡率
3 讨论
3.1 6种荧光染料标记效果分析
本研究结果表明,使用TC、CAL、AYG和AAB溶液浸泡短须裂腹鱼,均未在其耳石上形成有效的荧光标记,仅AC和ARS形成了非常明显的荧光标记。四环素及其多种盐类实际上是一类抗生素,能与碱土金属离子形成有荧光的配合物,在医学检验中常被用作荧光标记物,也是水产养殖常见用药,其中较早应用于鱼类荧光标记放流研究的是土霉素(oxytetracycline,OTC)、TC[18]。通过浸泡或者投喂的方式,OTC、TC被鱼体吸收代谢后沉积在鳍条、脊椎骨、耳石等部位,在紫外光下可观察到黄色荧光[19-20]。但一些研究发现四环素类的荧光标记容易受组织自体荧光的影响,会造成标记识别率降低[19,21-22]。为了获得优质标记,有时溶液浓度需要很高(500~600 mg/L以上),而高浓度又会造成高死亡率[19-21]。TC标记胭脂鱼(Myxocyprinusasiaticus)[23]的效果很差、标记率很低,标记重口裂腹鱼(Schizothoraxdavidi)[24]时则和本研究结果类似,检测不到标记。出现这种情况,可能是由于四环素类标记易受水中钙、镁等离子螯合和酸碱度的影响,以及所用四环素种类和物种差异。对比已发表的研究结果发现,与AC、ARS的橘红色荧光相比,四环素类的黄色荧光不明显,在识别时容易造成误判,再加之人们对于抗生素的担忧,OTC、TC很难在鱼类标记放流中大规模应用。
在使用CAL浸泡标记孔雀鱼(Poeciliareticulata)[25]、许氏平鲉(Sebastesschlegelii)[26]等鱼类的研究中,标记部位在蓝光下发出绿色荧光。本研究却没有在耳石上观察到标记,分析可能有两种原因:一是用于标记和养殖的水槽透光性较好,阳光照射使CAL降解“褪色”;二是实验结束后鱼体保存在酒精中较长时间才摘取耳石检测,而CAL溶于酒精,详细原因有待更多实验分析确证。不过,一些研究表明,CAL标记不是很稳定,易衰减,而且与TC标记有着类似缺点,即荧光较弱且易受背景荧光影响,读取较为困难,因而在一定程度上限制了它的应用[25,27]。
AYG、AAB是茜素的衍生物,常被用作生化分析中的染色剂[28-29]。这两种染料不仅没有形成有效的荧光标记,而且对短须裂腹鱼表现出很大的毒性。在本研究中,使用100mg/L的AAB浸泡短须裂腹鱼在最初的几个小时内就全部死亡。推测可能是因为AAB、AYG溶液呈酸性,导致鱼体应激反应过于强烈造成死亡。
ARS、AC主要通过与钙离子形成络合物经鱼体代谢吸收沉积在骨骼、鳍条等组织上,标记部位在绿光下(波长)呈鲜艳的橘红色,与背景荧光区分非常明显[8]。ARS、AC沉积在骨性材料中后较为稳定,再加上耳石受头骨保护和不被重吸收的特性[30],因而ARS、AC耳石标记可以保持很长时间(通常可达数年),或可伴随鱼类终生[9,31-33]。使用较低浓度的AC或ARS就可以获得优质标记,甚至在可见光下也能观察到标记。不过,在同样的条件下,ARS不仅比AC标记质量更高,而且其价格仅为AC的十分之一左右,因此更适宜推广使用。
3.2 AC和ARS对短须裂腹鱼早期鱼苗存活、生长的影响及适宜标记条件
AC和ARS已经在布氏棘鲷(Acanthopagrusbutcheri)[9]、欧洲鳗鲡(Anguillaanguilla)[34]等鱼类的大规模标记放流中应用。但这两种荧光物质均对鱼体有一定毒性,浸泡过程中鱼体可能会因荧光物质的胁迫作用而产生氧化应激反应,造成机体损伤,甚至出现死亡[11,35]。许多研究表明,荧光物质的种类、溶液浓度、浸泡时间、鱼类种类和鱼体规格等多种因素,均不同程度地影响着死亡率及标记质量[9-10,19,35-38]。一般情况下,对于同种荧光物质,标记造成的死亡率和标记质量与溶液浓度、浸泡时间成正相关,与鱼体规格大小成负相关[10,36,38-39]。王臣等[40]曾对ARS标记大麻哈鱼胚胎的数据进行曲线拟合,并结合安全评估,得出适宜的标记条件是浓度25.9~40 mg/L、浸泡时间15.6~24 h。AC或ARS溶液浓度和浸泡时间合适,不会对鱼类生存、生长造成明显负面影响[26,34,39]。在本研究中,使用50~300 mg/L的AC标记20日龄短须裂腹鱼16 d后,除300 mg/L、24 h组的全长明显低于空白对照组外,其他各组与空白对照组均无显著差异,但200 mg/L及以下的浓度更不易造成鱼苗死亡。
AC和ARS化学性质相近,但本研究结果表明ARS浸泡标记造成的鱼体死亡率略高于AC,在Beckman等[41]、Yang等[10]研究中也有类似发现。50日龄短须裂腹鱼在首次标记时,AC组在400 mg/L才出现大量死亡,ARS则是在300 mg/L。这可能是由于AC溶于水对pH影响较小,ARS溶液却呈弱酸性,再加之鱼苗弱小,容易出现急性应激性死亡[9,11]。然而,一个月后(83日龄)以同样的条件再次标记时,浓度200 mg/L、浸泡24h的AC组鱼苗全部死亡,而ARS组却没有出现死亡。霍来江[11]用100~400mg/L的ARS标记中华倒刺鲃幼鱼时发现,ARS造成的组织损伤10 d后基本恢复,500 mg/L时造成的损伤则很难恢复。由此可以推测,浓度200 mg/L时,AC造成短须裂腹鱼早期鱼苗出现急性应激性死亡的可能性低于ARS,但对鱼苗机体损伤程度可能略高于ARS,需要较长时间恢复。
鱼类在早期生长阶段代谢快,规格小,便于集中,是实施标记的理想时期,但此时鱼体抵抗力也很弱。尤其是大规模应用时,鱼苗生长水平和健康水平不可能完全一致,选择标记条件需要格外谨慎。综合本研究和其他研究的结果,本研究推荐的浸泡标记短须裂腹鱼早期鱼苗(仔鱼、稚鱼及规格较小的幼鱼)的安全的条件为AC或ARS溶液50~100 mg/L,浸泡12~24 h。并且,在鱼苗规格较小、体质较弱时尽量采用该条件的低限,在鱼苗规格较大、抵抗力较强时可采用高限。为进一步确认条件是否合适,在大规模应用之前,还必须随机抽样对待标记群体进行预试验。按照这种方式,Yang等[42]曾在2014年使用ARS浓度70 mg/L、浸泡24 h的条件标记了7 000尾短须裂腹鱼(全长23.52 mm±1.50 mm),2015年使用ARS浓度30~50 mg/L、浸泡24 h的条件标记60万尾(全长20.85 mm±1.41 mm),标记质量均在3以上,鱼苗死亡率低且没有明显升高,也没有对其后续生长造成明显负面影响。
4 结论
本研究表明ARS和AC是目前标记短须裂腹鱼耳石效果很好的荧光物质,标记早期鱼苗的合适条件为50~100 mg/L浓度浸泡12~24 h,不会对鱼体存活、生长造成明显影响。而TC、CAL、AYG、AAB等荧光物质则没有在耳石上产生有效的荧光标记,不适于标记短须裂腹鱼。

