过客淋巴细胞综合征的发病机制和研究进展
康中玉,李代红(天津市第一中心医院输血科,天津 300192)
过客淋巴细胞综合征(passenger lymphocyte syndrome ,PLS)是指供者器官内残留的B 淋巴细胞进入受者体内,针对受者的红细胞抗原产生免疫性抗体从而引起的以溶血性贫血为主要表现的临床症状。由于ABO 抗原在所有血型系统中抗原性最强,因此PLS 引起的溶血常见于ABO 血型次要不合的实体器官移植或骨髓移植术后,多以血管外溶血为主[1]。PLS 通常是由ABO 和Rh 血型系统的抗体引起的,少数情况下,PLS 也可由其他红细胞血型系统抗体引起,如Kidd、Duffy 等[2]。1981 年,Stevens 等[3]发现供者来源的淋巴细胞会产生针对受者红细胞的抗体,因此提出了过客淋巴细胞这个概念。PLS 是移植物抗宿主病(graft-vs-host disease,GVHD)的特殊类型,肝脏、小肠、心脏、肺、胰腺和肾脏移植后均可发生,在肾移植、肝移植、心脏移植中的发生率依次为9% ~ 17%、29% ~ 40%、70%[4]。此外,由于小肠组织中含有大量的淋巴组织,因此小肠移植后PLS 的发生率较高[5]。PLS 的发生率可能与移植物中淋巴细胞含量有关,淋巴细胞含量越高,发生率就越大,溶血症状持续时间越长[2]。移植后受者抗体效价迅速升高也是影响溶血严重程度的因素[6]。
1 过客淋巴细胞综合征的发生机制
PLS 的发生机制是由于在移植过程中,供者器官内残留的具有免疫功能的B 淋巴细胞进入受者体内,接触到受者红细胞抗原,活化、增殖、分化,产生针对受者红细胞抗原的抗体,主要为IgG 抗体,抗体结合到红细胞膜上,发生抗原抗体反应,在补体介导下导致红细胞裂解发生溶血,少量抗体不会对患者产生明显危害,但当抗体量多、效价高时,则会导致血管外溶血,红细胞破坏速度超过骨髓代偿能力时,出现贫血、黄疸等症状[7]。PLS 是移植术后发生的类似于溶血性贫血的疾病,临床表现为溶血、贫血、黄疸,严重时可出现急性肾功能衰竭甚至危及生命[8]。ABO 血型和或Rh 血型不合器官移植和骨髓移植术后的患者,血红蛋白进行性下降,血清胆红素升高,乳酸脱氢酶( lactic dehydrogenase,LDH)升高,直接抗球蛋白试验(direct antiglobulin testing,DAT)试验阳性,检测出针对自身红细胞抗原的抗体时可以诊断为PLS[9]。由于肝脏中淋巴细胞表面表达淋巴细胞相关抗原-1(lymphocyte function-associate antigen-1,LFA-1),与细胞间黏附因子-1(interellular adhesion molecule-1,ICAM-1 )结合可增加LFA-1 分子的表达,因此,供肝组织中的淋巴细胞不会因灌洗而减少,最终处理后供肝中残留的淋巴细胞总数约为(5.3±2.9)×109,几乎达到外周血中淋巴细胞总数的一半[10]。
PLS 常发生于移植术后1 ~ 3 周,是自限性的疾病,移植物中的淋巴细胞在受者体内不能增殖,随着供者淋巴细胞的逐渐凋亡,抗体的产生也会逐渐减少直至停止,一般持续3 个月左右,有个别超过170 d,极个别溶血持续182 d[11]。由于ABO 血型抗原在所有血型系统中的抗原性最强,因此PLS 主要发生于ABO 不相合实体器官移植或骨髓移植术后[12],尤以供者为O 型,受者为A 型显著,可能与A 型红细胞表达更多抗原有关[13-14]。
2 PLS 的诊断
PLS 的诊断关键是在移植受者体内检测出供者来源的抗受者红细胞抗体。PLS 主要是由ABO 血型系统抗体引起的,其次为Rh 血型系统抗体引起,此外,还包括抗K、Jka、M、N 等抗体。过客淋巴细胞综合征引起的溶血通常发生在移植术后3 ~ 15 d,对接受ABO 血型不合移植的受者进行常规红细胞抗体监测。ABO 不相合移植,应常规检测受者抗体变化情况,包括DAT、间接抗球蛋白试验(indirect antiglobulin testing,IAT)、抗体筛选、抗体鉴定、抗体效价鉴定及放散试验等。利用流式细胞术分析细胞亚群的百分比及计数,检测或分选 B 细胞、T 细胞、抗体及嵌合体。PLS 患者的临床症状主要包括黄疸、脸色苍白、心动过速、呼吸急促和低血压等溶血症状[9]。实验室检查包括血红蛋白的下降、网织红细胞计数的增加(除外活动性内出血)、未结合胆红素水平的增加、尿胆原升高、LDH 增加以及结合珠蛋白水平的降低。PLS 的诊断应该包括ABO 和或Rh 血型系统不合的情况、免疫相关溶血性贫血、实验室检查,如胆红素升高、网织红细胞增加及DAT 阳性,患者体内出现抗自身红细胞抗体[9]。
3 产生过客淋巴细胞综合征的相关移植类型
3.1 肝移植术后PLS 的发生:笔者总结了2002 —2020 年共15 篇研究报道了肝移植术后PLS 的发生,合计41 例患者,见表1。肝移植术后PLS 的发生率约为30% ~ 40%,大多数病例继发于ABO 抗体(75%),其次是抗D 抗体(19%),此外还包括抗C、E、K、Lea、Kpb 和JKa。 除Brunetta 等[15]报道的1 例病例外,其余患者均有明显的临床溶血表现。肝移植术后PLS 的发生率主要与淋巴细胞的数量、ABO 血型非相合移植、以及治疗过程中的大量输血相关[8]。大量输血可能会进一步刺激过客淋巴细胞,使B 细胞活化产生抗体,导致溶血。此外,肝移植术后潜在的肝脏病理变化,如晚期肝硬化、门脉高压,贫血和肝病导致的凝血障碍,会掩盖因PLS 导致溶血的发现。Romero 等[9]于2015 年的研究表明,1 217 例肝移植术后患者中共有12 例发生PLS,发病率约为1%,56 例ABO 次要不相合的移植中10 例患者(17.9%)发生了PLS,而147 例Rh 不相合移植中2 例患者(1.4%)发生了PLS,所有患者均发生溶血反应。儿童肝移植术后PLS 的发病率约为14%[16]。供者为O 型RhD 阳性,受者为A 型RhD 阳性,是肝移植术后PLS 发生的主要危险因素,这些病例均有溶血表现,需要加大的免疫抑制剂的剂量和输注红细胞治疗[9]。此外,有研究表明,30.3%的肝移植患者DAT 结果阳性,12.5%的患者抗体筛查阳性[15]。肝移植术后PLS 的发生率从2.8%到40%不等[1,15]。

表1 肝移植术后PLS 发生情况
3.2 肾移植术后PLS 的发生:笔者总结了2003 —2020 年合计11 项研究对肾移植术后PLS 的发生进行了报道,包括21 例(20 例肾移植和1 例胰肾移植)(表2)。约76%的PLS 病例是由ABO 抗体引起的,24%的PLS 病例继发于抗D 抗体,其中1 例同时含有抗E 抗体。所有病例均有明显的临床贫血表现。肾移植术后PLS 的发生率约为20%[17]。Achkar 等[18]对217 例肾移植患者移植前后数据进行前瞻性分析发现,肾移植术后30 d 内出现DAT 阳性的概率约为15.7%,而所有移植患者术后10 d 内出现DAT 阳性的概率约为9.7%。此外,ABO 血型不相合肾移植术后DAT 阳性患者中约13.5%是由PLS 引起,可能会影响患者的预后。
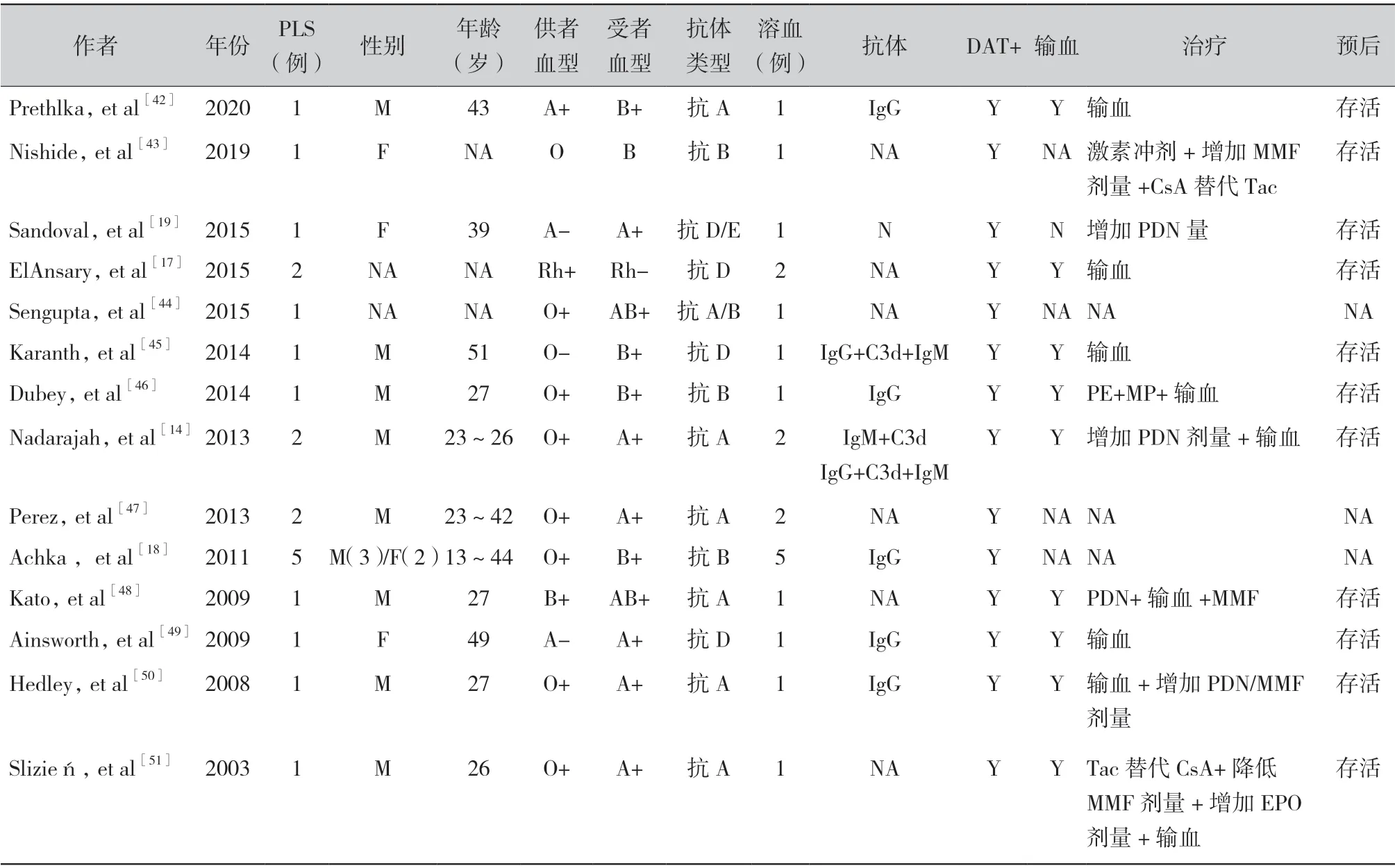
表2 肾移植术后PLS 的发生情况
Hurtarte-Sandoval 等[19]报道了1 例接受肾胰联合移植术的患者,移植术后4 周出现溶血,DAT 弱阳性,抗体筛查发现抗-D 和抗-E 抗体,增加泼尼松用量后,逐渐恢复正常。据报道,实体器官移植术后患者DAT 阳性率约为17% ~ 70%不等[8]。
3.3 肺移植术后PLS 的发生:通过对2002 — 2020 年肺移植术后PLS 发生的相关文献进行汇总,发现共有4 项相关研究,包括12 例患者(表3)。其中,约75%的患者出现抗ABO 抗体,25%的患者出现抗D 抗体,有1 例患者出现抗A 抗体同时伴抗K 抗体。Rh D 抗体引起的肺移植术后PLS 的发生率约为3%。除2 例患者无明显溶血性贫血症状外,其余患者均出现不同程度的溶血症状。Cserti-Gazdewich等[20]发现单肺移植后发生溶血的严重程度高于双肺移植,因此,淋巴细胞的含量并不是预测PLS 严重程度的唯一因素。

表3 肺移植术后PLS 发生情况
3.4 干细胞移植术后PLS 的发生:笔者总结了2000 — 2014年共有8项相关研究报道了干细胞移植术后PLS 发生,包括12 例患者(表4)。其中,约66.6%的患者出现抗ABO 抗体,16.7%的患者出现抗D 抗体,还有16.7%的患者出现抗Jka 抗体。Squires 等[21]的研究报道了1 例Rh D 阳性患者接受了Rh D 阴性供者的干细胞,虽然经过预防治疗,但患者在移植术后8 d 出现抗体筛查阳性、直接抗球蛋白试验阳性和显著溶血,经鉴定抗体为抗D 抗体。ABO 血型或RhD 血型不相合骨髓移植受者中,有10% ~ 15%发生了明显的溶血[22]。干细胞移植后PLS 是否引起溶血以及溶血的严重程度,与移植淋巴细胞的数量,移植前抗体水平,移植后受者抗体效价的迅速上升以及植活的时间等因素有关[11,23]。Zaimoku 等[24]对18 例因血液系统恶性肿瘤接受异基因造血干细胞移植(hematopoietic stem cell transplantation ,HSCT)的患者进行回顾性分析,有5 例(28%)患者在造血干细胞移植后约19 d 出现了PLS,均有溶血症状,其中3 例患者在移植后1 年内死亡,移植术后PLS组1 年总生存率小于无PLS 组,因此,造血干细胞移植术后监测红细胞IgM 和IgG 的抗体是非常重要的[24]。
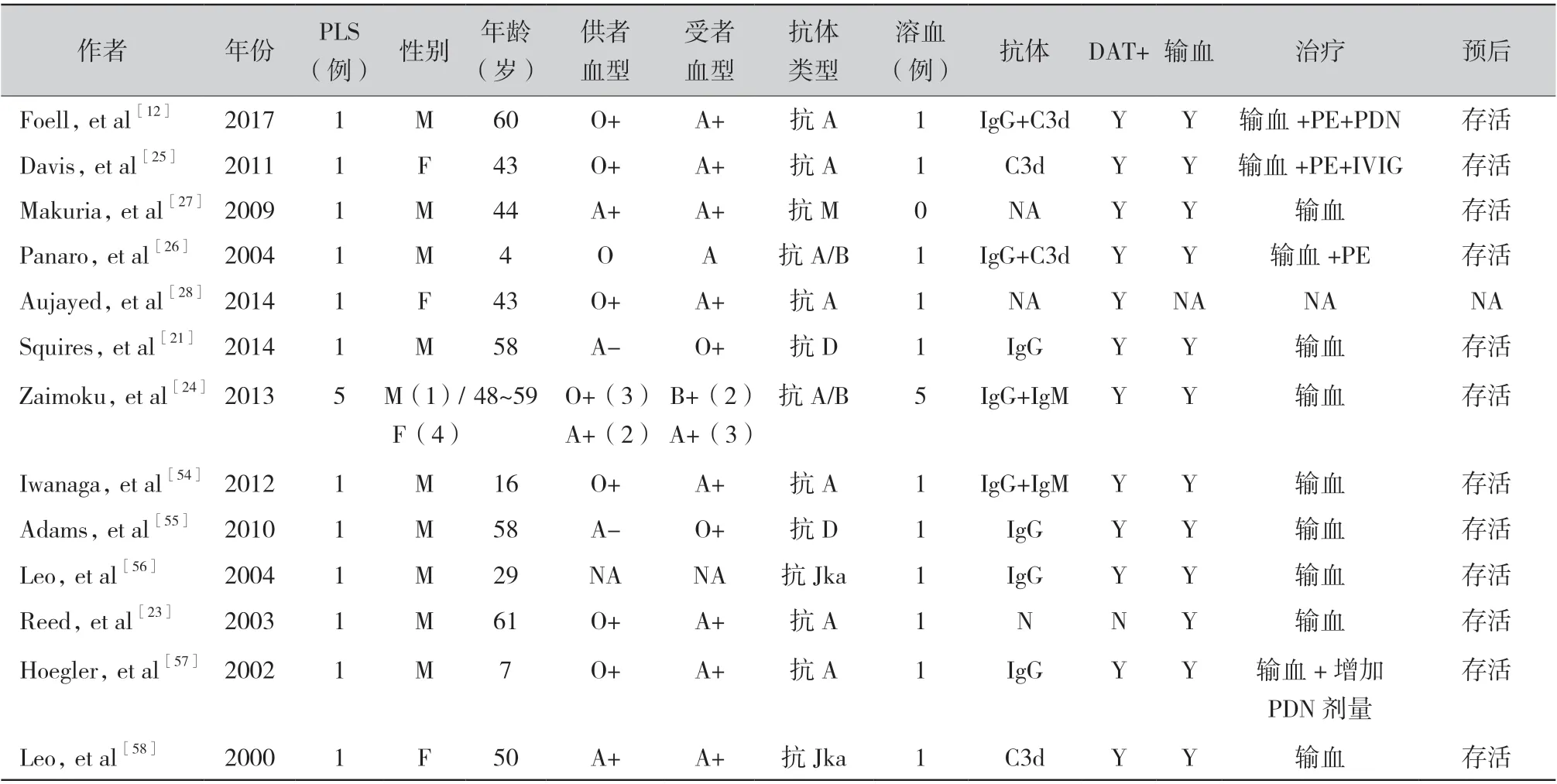
表4 肠移植、心脏移植、干细胞移植术后PLS 发生情况
3.5 其他实体器官移植术后PLS 的发生:笔者统计2004 ~ 2017 年合计4 篇研究报道了胃肠移植术后PLS 的发生,均为病例报道(表4),包括2 例小肠移植,1 例胃、小肠和胰腺联合移植,以及1 例胃、小肠、大肠、胰腺和肝联合移植[12,25-27]。其中3 例有溶血表现的PLS 均为抗ABO 抗体引起,另1 例抗M 抗体引起的病例,无明显溶血发生。作为肠道相关淋巴组织以及整个胃肠道(包括胃)的黏膜相关淋巴组织一部分,同种异体移植物中含有大量供体淋巴细胞,移植后淋巴组织内的B 细胞产生针对受者的血型抗体,从而导致PLS 的发生。然而,由于小肠移植较少,移植术后PLS 的病例也较少。
仅有1 篇病历报道了心脏移植术后PLS 的发生,为A 型RhD 阳性的受者接受了O 型RhD 阳性供者的心脏,移植后第18 天检测到抗A 抗体但该患者在移植后立即出现脓胸并感染了腺病毒,导致急性呼吸衰竭,最终死于大咯血和呼吸衰竭[28]。相关的病例报告很少,仍需要进一步研究。
4 PLS 的治疗与预防
目前公认的治疗原则包括纠正贫血、去除抗体、减少B 细胞增殖和营养支持。大多数病例是轻度和自限性的,有些患者需要增加皮质类固醇治疗和输血治疗。PLS 是一种较温和的自限性疾病,移植术后发生PLS 的患者输注不与供体来源抗体发生反应的相合红细胞时,大部分患者症状可缓解。当溶血较严重时,可输注洗涤红细胞及新鲜冰冻血浆,可对洗涤红细胞进行辐照减少GVHD 的发生,新鲜冰冻血浆进行病毒灭活,尽可能提供输血保护,降低移植后不良反应,提高移植的成功率[29]。造血干细胞移植术后,红细胞置换术可用于治疗溶血,比实体器官移植术后应用的更多。免疫抑制剂如使用利妥昔单抗控制B 细胞的增殖和激活,阿伦珠单抗及巴利昔单抗也是治疗的推荐方案[29-30]。对于溶血症状异常严重的患者,还可以考虑静脉注射免疫球蛋白、血浆置换、全血置换、脾切除等治疗[31]。此外,补体抑制也是有效的治疗方案[32]。在某些动物实验方面的文献中,去除移植物中的过客淋巴细胞在减少器官移植中的排斥反应、降低 PLS 发生中发挥重要作用,但临床上寻找有效实用的去除过客淋巴细胞仍是重要研究方向。
PLS 是自限性疾病,产生的溶血性贫血一般较轻且是一过性的,随着体内的B 淋巴细胞逐渐代谢、凋亡,移植淋巴组织耐受受者抗原,体内的抗体也会逐渐下降并消失,引起的溶血症状就会停止。症状较轻者可给予支持治疗、输血治疗;症状较重时需要增加免疫抑制剂用量、血浆置换等治疗方法。因此,监测受者体内抗体及其效价,早期发现及诊断PLS,尽早干预,提高患者的预后。

