广西南流江流域土壤-水稻系统Cd生物有效性及影响因素
邵玉祥,杨忠芳,王 磊,卓小雄,张起钻
(1. 中国地质大学(北京) 地球科学与资源学院,北京 100083;2.中国地质调查局 应用地质研究中心,四川 成都 610036;3. 广西壮族自治区地质矿产勘查开发局,广西 南宁 530023)
0 引 言
镉(Cd)是一种生物非必需元素,因其在生态环境中具有很强的迁移性和生态毒理性,被世界卫生组织(WHO)列为优先关注污染物之一[1-2]。2005年至2013年,原国家环保部和原国土资源部首次开展的全国土壤污染调查结果显示,我国耕地土壤重金属超标样品占全部样品的19.4%,其中土壤Cd污染最为严重[3]。土壤Cd超标不仅抑制粮食作物生长[4],还能通过食物链在人体累积,会导致肾脏、肝脏、骨骼等系列疾病[5]。20世纪初,日本神通川流域的“痛痛病”,便是流域居民长期食用了Cd超标大米造成的结果[5]。研究发现,土壤Cd含量较低地区的居民,其食物Cd暴露水平也可能较高[6-7]。目前,稻米中的镉依然是人体摄入镉的主要来源[8],环境共害病依然是人们和政府深切关注的问题,因此,了解土壤-水稻系统中Cd的生物有效性及影响因素,对于水稻Cd污染和防治至关重要。
土壤-水稻系统Cd的迁移规律不仅与土壤Cd总量有关,更大程度受控于土壤Cd存在形态。而土壤中Cd存在形态又受土壤pH、有机质、阳离子交换量、质地、土壤化学成分和土壤矿物组成等众多因素影响,其中,土壤pH的影响最为显著[9-10]。研究表明,酸化土壤的各指标会发生明显变化,Cd活性也大幅提升,最终导致种植的农作物Cd累积量增高[11]。据调查,我国典型耕地区,由于流域土壤酸化导致的土壤重金属活化和粮食污染现象显著[3, 12]。
南流江位于广西壮族自治区东南部,是广西独流入海的第一大河。丰富的水资源和平坦的流域盆地及冲积平原为区域工农业发展提供了便利基础。然而,随着自然演变和经济发展,南流江流域部分区域出现了重金属污染的迹象[13-14]。据报道,2007年至2015年期间,南流江河岸带土壤Cd、Pb等重金属含量增加了数倍至数十倍[14]。一些报道指出,南流江偏酸性的地下水和灌溉水对土壤Cd等重金属活化有促进作用[15]。目前,关于该流域土壤重金属形态特征及其在土壤-水稻系统转移特点的研究很少。本文通过采集该流域不同成土母质土壤及水稻籽实样品,以Cd元素为研究对象,探讨南流江流域水稻根系土Cd的富集特征和潜在风险,分析土壤-水稻系统中Cd生物有效性及影响因素,以期为该流域农田土壤Cd污染防治及提高农产品质量提供科学依据。
1 研究区概况
南流江起源于广西北流市大容山南麓,因自北向南流得名,流经广西玉林市、钦州市东南部、北海市东部,于合浦县注入北部湾,全长287 km,流域面积8 635 km2[16]。流域全境位于北回归线以南,属典型亚热带季风气候和热带海洋性气候,平均气温在21.5 ~ 22.4 ℃,无霜期长达320 d以上,流域多年平均降雨量为1 400 ~ 1 760 mm,略高于广西多年平均降水量(1 533 mm)[16-17]。流域内广泛发育山地、丘陵、河流侵蚀盆地等地貌,水稻种植区主要位于沿江发育的玉林侵蚀盆地、博白侵蚀盆地及合浦冲积平原。
流域内岩石地层岀露丰富,其中,除沿水系发育的第四系之外,二叠系、三叠系花岗岩也广泛出露,约占区域总面积的1/3,主要分布于流域西侧六万大山一带。其次,新近系、白垩系及志留系碎屑岩分布于低山丘陵区,主要位于玉林市东侧至中游沙河镇再到下游乌家镇一带,分布面积较广。碳酸盐岩出露面积很小,主要位于上游兴业县西北地区和北流市南侧,这些区域明显可见较难风化的碳酸盐岩石山。许多研究表明,成土母质不同会导致土壤的理化性质及重金属的活性明显差异[18],因此,本文通过成土母质和流域区段进行分区,选取流域碎屑岩区、碳酸盐岩区、水系上游、中游和下游第四系区5个区域,共采集水稻及根系土壤样品234件(图1)。
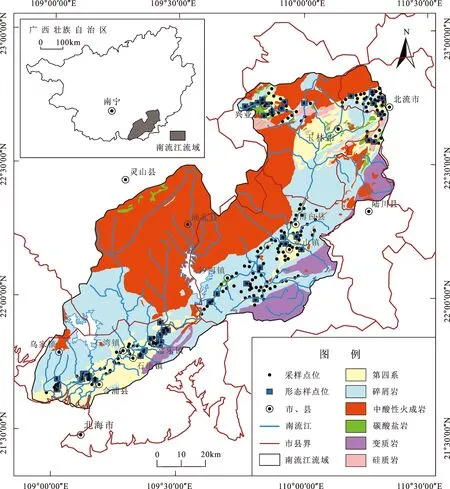
图1 南流江流域水稻及根系土采样点位图Fig.1 Map of the sampling sites in Nanliujiang Catchment
2 样品采集与测试方法
2.1 采样方法
各类样品采集严格执行《土地质量地球化学评价规范(DZ/T 0295—2016)》[19]。采集水稻根系土样品时,选取水稻植株有代表性且面积合适的田块,采用对角线法,用GPS记录点位和航迹,在距离田埂1 m以上的位置,采集3 ~ 4个子样点进行等量混合,同时采集对应子样点的水稻籽实。土壤样装入写有编号的干净布样袋中,并套上专用聚乙烯塑料袋,以免样品间相互污染。
采集样品之后,选择阴凉干燥的空地,自然阴干样品。水稻籽实用木棍脱粒后混匀送测。土壤样品用橡皮锤敲碎、碾压,并挑出石子、动植物残体等,全部压碎、磨细,并过孔径为2 mm的尼龙筛,确保无污染后装自封袋以备送测。
2.2 样品测试
土壤样品各元素和指标及水稻籽实Cd的分析方法及检出限如表1所示。土壤粉末样品用HCl-HNO3-HClO4-HF四联酸消解,水稻籽实样品用微波消解仪消解,分别定容后,用等离子质谱法(ICP-MS)分析测试样品中的Cd,用等离子光谱法(ICP-AES)测定土壤中的K2O、CaO、MgO、Mn。土壤P、S元素使用压片法和X射线荧光光谱法(XRF)测试。土壤pH值的测定需先用水浸取土壤样,而后用pH计直接测试。总有机碳(Corg)先用硫酸分解土壤样,而后用重铬酸钾氧化,采用氧化还原容量法(VOL)进行分析测试。土壤N先采用硫酸分解-加浓碱蒸馏处理,然后用酸碱滴定容量法(VOL)进行分析测定。

表1 土壤元素和指标分析方法及检出限
根系土Cd元素形态分析采用七步顺序提取法。土壤样品在充分烘干后,用玛瑙球磨机研磨至100目,取其中2.5 g土壤样品,而后使用25 mL的蒸馏水溶解获得水溶态Cd,25 mL氧化镁溶液提取离子交换态,25 mL醋酸钠溶液提取土壤碳酸盐结合态,50 mL焦磷酸钠溶液提取腐殖酸结合态,25 mL盐酸羟胺溶液提取铁锰氧化态,6 mL H2O2-HNO3溶液提取强有机结合态,最后用HNO3-HClO4溶液获取残渣态。提取后的溶液采用全谱直读电感耦合等离子发射光谱法(ICP-OES) 进行测定,不同形态Cd含量检出限见表1。
2.3 质量控制
2.3.1 土壤各元素指标及水稻籽实Cd


表2 土壤各元素和指标的准确度和精密度质量监控
2.3.2 Cd元素形态

2.4 数据处理
风险评估指数(RAC)是在顺序提取法的基础上来评估重金属的环境生态风险[20],其重点是关注样品中重金属易活动的部分。在本文中计算方法为:
RAC=C水溶态+C离子交换态+C碳酸盐结合态
式中:C水溶态、C离子交换态、C碳酸盐结合态分别代表土壤重金属各形态占该元素土壤总含量的质量分数,%;RAC为风险评估指数,%。根据RAC的大小,将其风险程度分为5种风险等级:RAC<1%,无风险;1%≤RAC<10%,低风险;10%≤RAC<30%,中等风险;30%≤RAC<50%,高风险;RAC≥50%,极高风险。
数据统计与计算、相关性分析、采样点投图等主要使用了Microsoft Office 2010、IBM SPSS Statistics 23.0、MapGIS 6.7和ArcGIS 10.1。
3 结果与分析
3.1 根系土-农作物元素含量特征
水稻根系土各元素指标统计结果见表3。长期耕作和时令性淹水特点导致了水稻土中的腐殖质等养分非常丰富[21]。研究区水稻根系土中N、P、S养分元素及土壤有机碳(Corg)等平均含量均高于全国表层土和长江流域表层土背景值[22],分别为1 388 mg/kg、772 mg/kg、305 mg/kg、1.40%。相比而言,研究区土壤K2O、CaO、MgO平均含量较低,分别为1.31%、0.21%、0.35%,表明该区域土壤受淋滤作用强烈。土壤pH变化范围为4.77~8.14,中位值为5.52,整体偏酸性。不同成土母质土壤对比显示,碳酸盐岩区发育的土壤pH相对较高,中位值为6.02,南流江流域上游、中游、下游第四系冲洪积区及碎屑岩分布区的土壤pH较低,中位值分别为5.97、5.58、5.40、5.40。碳酸盐区土壤CaO和有机碳(Corg)平均含量相对较高,分别为0.32%、1.61%。碳酸盐岩区的耕地主要分布于长期风化剥蚀形成的汇水洼地,温暖湿润的气候条件下,碳酸盐岩中的酸不溶物和含碳酸钙溶液不断汇入土壤,形成了微碱性、富钙和有机碳的土壤特征[23-25]。

表3 水稻根系土元素含量及水稻籽实Cd含量统计
研究区水稻根系土中Cd元素平均含量为0.17 mg/kg,相对高于全国土壤Cd元素背景值,低于长江流域表层土的Cd元素背景值[22]。不同分区根系土的Cd含量平均值由大到小依次为碳酸岩盐区(0.39 mg/kg)>水系上游第四系区 (0.22 mg/kg)>水系下游第四系区(0.14 mg/kg) >水系中游第四系区(0.13 mg/kg) > 碎屑岩区(0.12 mg/kg)。参照农用地土壤污染风险筛选值(GB15618—2018)[26],仅有2.99%的土壤Cd超出土壤风险筛选值且未超出管制值,分别位于碳酸盐岩区和水系第四系上游、下游,超标样品个数分别为4个、2个和1个。表层土中Cd元素次生富集受较多因素控制,从相关性(表4)来看,土壤Cd总量与土壤大部分元素显示较好的正相关关系。

表4 根系土各元素与Cd形态相关性统计(n=50)
水稻籽实Cd含量统计结果(表3)显示,不同分区水稻籽实Cd含量平均值大小分别为:水系下游第四系区(0.27 mg/kg)>水系中游第四系区 (0.17 mg/kg)>碳酸盐岩区(0.15 mg/kg)>水系上游第四系区(0.14 mg/kg)>碎屑岩区(0.12 mg/kg)。从图2中可以看出,不同分区根系土Cd总含量与水稻籽实Cd含量分布特征大致相反。同时,33.76%的水稻籽实Cd含量超过了《食品安全国家标准(GB2762—2017)》[27]中谷物类Cd的限量(0.2 mg/kg),表示水稻籽实中Cd对人体可能具有一定风险。

图2 不同成土母质区水稻籽实与对应根系土Cd含量对比箱状图 Fig.2 Cd contents in the root soils and seeds of differentparent soils
3.2 根系土Cd形态特征
南流江流域根系土Cd元素各形态占比统计结果(表5)表明,水稻根系土Cd离子交换态、残渣态平均占比相对较高,分别为27.16%、20.21%;其次为腐殖酸态,占比为15.85%;碳酸盐结合态、铁锰氧化态、强有机态占比相似,分别为12.89%、11.48%、10.33%;水溶态Cd占比最低,为2.09%。离子交换态Cd是通过络合与扩散作用吸附在土壤中细颗粒矿物上的Cd2+,是土壤中较为活跃的形态[20]。研究表明,经常耕作的土壤受到化肥、灌溉水、作物根系分泌物等因素的干扰,土壤中Cd等重金属元素会出现不同程度的活化,这是导致耕地土壤Cd离子交换态含量较高的主要因素[10, 18, 20]。运用重金属风险评估指数(RAC)对土壤Cd进行风险评估(表5),结果显示,研究区整体土壤Cd风险指数平均值为42.14%,属于高生态风险。不同分区土壤Cd风险指数平均大小顺序依次为:碳酸盐岩区(47.68%)>水系上游第四系区 (43.65%)>水系中游第四系区(42.37%)>水系下游第四系区 (39.96%)>碎屑岩区(37.64%)。

表5 南流江流域根系土Cd形态含量比例统计表(%)
对比发现,不同成土母质土壤Cd风险评估结果与对应区水稻籽实Cd含量有一定差异,即水稻籽实Cd含量相对较低的碳酸盐岩及水系上游第四系区土壤Cd风险指数均相对较高。这一现象可能的原因是,碳酸盐岩淋溶后酸不溶物风化形成的土壤,土壤pH和Ca含量均相对偏高,土壤固相能提供更多负电荷吸附位,可使Cd2+被固定在土壤固相中,这样虽然Cd的生物有效性降低,但可被弱酸提取出来的Cd比例非常高;相反,第四系发育形成的土壤经受了冲洪积过程,土壤较活泼形态的Cd在水的作用下淋失,因此这些土壤Cd的弱酸提取态的比例是相对低于定积母质形成的土壤。从图3中可以看出,随着河流流程增加,即从上游至中游到下游,第四系区土壤Cd的弱酸性提取态比例有明显下降的趋势,但活性最强的水溶态Cd比例却不断增高,这可能是第四系土壤Cd生态风险较高的关键因素。

图3 南流江不同成土母质土壤Cd各形态占总量比值Fig.3 The percentages of Cd fractions of different parent soils in Nanliujiang Catchment
3.3 影响土壤Cd生物有效性的主要因素
土壤Cd生物有效性是指生物体相对土壤Cd总量的富集特征,或土壤中能够被生物吸收利用的Cd形态特征[28],了解该区域土壤Cd总量和形态分布及其与水稻籽实之间的联系,对于认识土壤Cd生物有效性至关重要。为了探究土壤Cd各形态与籽实Cd之间的关系,计算了数据间的皮尔逊相关性系数(表6),结果显示,水稻籽实Cd含量与水溶态呈弱的正相关 (r=0.332,p<0.05),与土壤Cd总量和其他形态无相关性特征。这一现象较为契合一些研究观点,即土壤溶液中Cd2+及有机小分子结合的Cd为水稻根系能够直接吸收的形态[28]。研究还指出,在一定的根际Cd2+浓度下,水稻植株Cd的累积速率和累积量与根际Cd2+浓度具有正相关性[35]。由此可知,土壤中水溶态Cd是水稻可直接吸收的形态,其含量能够很好代表土壤中水稻可吸收的生物有效性含量。研究表明,土壤水溶态Cd含量主要受土壤Cd总量、土壤pH、黏粒比例、有机质、铁锰氧化物、土壤钙质、阳离子交换量等因素的影响[36-37]。本文通过Cd元素形态占比与土壤各指标之间的相关性(表4),结合Cd元素地球化学性质,选取土壤Cd总量、土壤pH、CaO、Mn、Corg 5个因素,依据区域不同成土母质土壤特点,分析这些指标对土壤水溶态Cd含量占比的影响。

表6 水稻籽实Cd与根系土Cd形态的相关系数(n=50)
3.3.1 土壤Cd总量
表7统计了土壤Cd总量与7种形态Cd之间的相关性。结果显示,除水溶态与全量之间无明显相关性外,其他形态的Cd与全量之间都显示强正相关关系(r=0.732~0.939,p<0.01)。造成这种情况可能的原因是土壤中水溶态Cd含量占比较少,且不同类型土壤的理化性质对土壤溶液Cd2+的吸附解吸反应影响较大[36-38]。

表7 水稻土总Cd与各形态相关性统计(n=50)
从根系土Cd总量与水溶态Cd含量散点图(图4)看,各分区均显示了一定的正相关关系。相比其他分区,水系下游第四系区土壤中水溶态Cd含量随着Cd总量的增加,增幅更为明显。这说明不同土壤类型是导致土壤Cd生物有效性差异的原因之一,也显示出水系下游第四系土壤Cd低总量,但高生物有效性的特点。

图4 土壤水溶态Cd与总量的相关关系图Fig.4 Relationship between water soluble Cd and total contents of Cd in the soil
3.3.2 土壤pH
土壤pH是控制土壤Cd活化的主要因素之一[18, 36, 39]。不同分区土壤pH与水溶态Cd相关关系见图5,可见随着不同分区土壤pH的增高,土壤水溶态Cd所占比例减少。研究指出,在土壤溶液中,pH的升高会促进Cd2+形成CdOH+,后者在土壤吸附点位上具有更强的吸附亲和力;同时,土壤pH的升高也会使土壤溶液中H+、Fe2+、Al3+浓度减小,导致Cd2+竞争吸附离子减少,有利于土壤中Cd元素的吸附[36]。另一方面,土壤固相中存在较多的氧化物、有机质和黏土矿物,在水解电离过程中,这些物质表面会产生较多的负电荷,形成较多的吸附点位,能有效地吸附Cd等重金属元素,而土壤pH的升高会增加这些物质表面的吸附点位,从而吸附更多的Cd2+[40-42]。一些实验通过添加土壤pH改良剂提升土壤的pH值,有效地减少了污染土壤中有效态Cd及种植的农作物Cd含量,降低了Cd的生物有效性[40-42]。南流江水系下游第四系区土壤偏酸性的特征尤为突出,这导致了较多土壤固相中的Cd被解吸附至土壤溶液中,从而增加Cd的生物有效性。因此,采取有效措施防止土壤酸化,保持土壤在弱酸性至弱碱性范围,可以降低土壤Cd活化产生的危害。

图5 土壤中水溶态Cd比例与土壤pH相关关系图(点代表平均值,横线区间代表了95%置信区间)Fig.5 Relationship between percentages of water soluble Cd and pH in the soil
3.3.3 土壤CaO
如图6所示,研究区土壤CaO含量与水溶态Cd含量占比呈显著负相关(r= 0.39)。近年来,施用生石灰或钙质肥料来修复Cd污染土壤的方法已经被广泛应用和研究[40-42],其主要原理体现在两个方面。首先,施用石灰会导致土壤pH升高,从而有效地将土壤离子交换态Cd转化为碳酸盐结合态、铁锰氧化态等稳定形态;其次土壤溶液中Ca2+浓度提升可以降低Cd2+溶解度,从而降低Cd的生物有效性[45-47]。不仅如此,由于Ca2+和Cd2+离子半径最为相似,两者在表生矿物中易发生类质同象,因此土壤钙含量或含钙矿物较多的土壤,能够为Cd2+提供的结合的矿物点位就越多,被吸附固定的Cd也就相对较多。

图6 土壤水溶态Cd比例与土壤CaO含量相关关系图Fig.6 Relationship between percentages of water soluble Cd and CaO contents in the soil
一些研究指出,土壤溶液中的Ca2+不仅会影响Cd2+的溶解度,同时也能与Cd2+产生竞争吸附,当土壤溶液中Ca2+浓度较高时,能导致土壤中非专性吸附的Cd释放到土壤溶液中[47]。所以,针对不同土壤特征,需要合理使用钙质肥料,从而在升高土壤pH的同时,持续有效发挥土壤钙质对Cd2+吸附的效果[48-50]。相对于长江流域及全国表层土壤CaO背景值(表3),南流江土壤CaO含量并不丰富,因此提高区域土壤钙质含量,对于降低土壤Cd生物有效性有积极作用。
3.3.4 土壤Mn
如图7所示,土壤Cd水溶态占比与土壤Mn含量呈显著负相关(r=0.45)。锰是地壳中含量较为丰富的元素,其化合物尤其是氧化物具有高反应活性及吸附能力,因此锰元素对土壤、沉积物及水体的吸附性质影响很大。土壤中的锰元素主要是以不同价态的氧化物形式存在,这些氧化物可通过选择性吸附和专性吸附的方式固定土壤中的Cd[51]。一方面,锰氧化物表面富含羟基,能与土壤溶液中的Cd2+及其发生水解反应形成CdOH+产生静电吸附或发生络合反应[52-53]。其次,锰氧化物在水解过程中会释放Mn2+和H+,Cd2+或CdOH+可与这些锰氧化物产生的负电荷点位结合,生成性质稳定的内圈配合物,进而形成专性吸附[54-55]。经实验验证,锰的氧化物或含锰化合物如锰钾矿、软锰矿等对于土壤、水中Cd2+的吸附极具功效[51]。邓子峰等进行锰钾矿去除污水中Cd2+的实验研究时,发现常温条件下,锰钾矿便能吸附酸性(pH>3.5)水溶液中约80%的Cd2+[54]。曾祥峰等指出,锰氧化物对土壤Cd2+有较强的吸附特质,但也受土壤pH、锰氧化物类型以及吸附温度、时间等因素的影响[55]。综合来看,土壤Mn含量增加能够促进土壤溶液中的Cd2+吸附,从而减小土壤Cd的生物有效性。

图7 土壤水溶态Cd比例与土壤Mn含量相关关系图Fig.7 Relationship between percentages of water soluble Cd and Mn contents in the soil
3.3.5 土壤有机碳
土壤有机质是指土壤中腐殖质、动植物残体和微生物体的合称,其中碳元素含量即为土壤有机碳[56]。研究表明,土壤有机质中存在大量可电离的羧基、羟基、羰基和氨基等,能有效地吸附Cd等重金属离子;同时有机质中C、N、P、S等给出电子后也能与Cd等重金属离子相连,形成稳定性较强的有机化合物[56-58]。研究区根系土有机碳总量(Corg)与离子态Cd占比相关关系见图8。整体结果显示,土壤有机碳总量与水溶态Cd占比仅有一定的负相关趋势(r=0.14),表明研究区土壤有机碳对Cd2+吸附作用不明显。一些实验研究发现,土壤中有机质成分差异对土壤重金属活性会产生不同的影响结果,即土壤中溶解性有机质(DOM),如可溶性糖类、氨基酸、烃类、脂肪酸、腐殖质等在吸附重金属后能够增加土壤重金属的迁移性和活动性,从而提升重金属污染风险[57]。综合看,土壤有机碳对Cd生物有效性的影响,不仅取决于土壤有机碳总量,可能更取决于有机碳类型和对Cd的吸附特征。

图8 土壤水溶态Cd比例与土壤有机碳(Corg)相关关系图Fig.8 Relationship between percentages of water soluble Cd and organic carbon contents in the soil
3.3.6 土壤类型
研究发现,不同类型土壤Cd的吸附解析能力有一定差异,如岩溶地区发育的石灰土具有较高的土壤pH、CaO含量,对Cd2+有较高的吸附能力[37]。从表3和图3中可以看出,虽然碳酸盐岩区土壤Cd总量最高,但土壤水溶态Cd占比、水稻籽实Cd含量最低。
红壤或砖红壤发育的水稻土具有较低的pH,对Cd2+的吸附相对较弱,这类土壤对Cd2+的吸附主要依靠土壤中铁锰氧化物、有机质等土壤成分[61]。研究区碎屑岩区处于南流江流域低山丘陵地带,土壤类型主要为砖红壤,从表3中可以看出,碎屑岩区土壤pH较低,却有相对丰富的N元素和有机碳含量,不同分区土壤Cd形态数据(图3)也可以看出,该区域腐殖酸态Cd比例最大。碎屑岩区土壤有机碳可能是导致该区域水溶态Cd含量及水稻籽实Cd含量较低的因素之一。
冲洪积物形成的水稻土中砂质含量较高,土壤孔隙度较大,大量的养分及可迁移元素在水动力作用下流失贫化,因此冲洪积土中SiO2含量一般较高,K、Ca、Na、Mg、Mn等含量相对较低[19, 25, 64]。在研究区不同区段的冲洪积区中,水系下游第四系土壤pH值最低,土壤的盐基离子流失最为严重。土壤氧化物和有机质等组分的减少,导致了土壤对Cd2+、H+的吸附能力减弱,加剧土壤酸化的同时也加剧了土壤Cd的解吸附反应[62],这就造成了该分区土壤Cd总量低,同时水溶态Cd含量和水稻籽实Cd含量较高的现象。综上来看,不同土壤类型及其导致的土壤理化性质差异,对Cd形态含量和生物有效性有较大的影响。
4 结 论
(1) 南流江流域水稻根系土Cd平均含量为0.17 mg/kg,低于长江流域土壤Cd的背景值,97.01%的样品低于GB15618—2018农用地土壤污染风险筛选值。根系土形态数据中,Cd的离子交换态、碳酸盐结合态等易迁移形态占比高,显示区域水稻根系土Cd有明显活化现象。各分区根系土Cd潜在风险评估指数(RAC)均大于35%,为高生态风险,整体显示出南流江流域土壤Cd总量相对较低,但潜在生态风险较高的特征。
(2) 参照《食品安全国家标准(GB2762—2017)》,研究区33.76%的水稻籽实样品超出了规定的限值。水稻籽实Cd元素含量与根系土Cd总量无明显的相关性特征(r=0.030,p=0.84),同时,水稻籽实Cd仅与土壤Cd形态数据中的水溶态显示正相关关系(r=0.332,p<0.05),表明研究区土壤水溶态Cd能够指示土壤-水稻系统中Cd生物有效性特征。
(3) 不同分区水溶态Cd与土壤Cd总量之间有正相关性,但水系下游第四系土壤中的增幅最为明显,显示了该分区土壤Cd生物有效性较高的特征。研究区土壤中水溶态Cd比例与土壤pH、CaO、Mn、有机碳呈不同程度负相关关系(r=0.12~0.45),进一步说明了水系下游冲洪积形成的第四系土壤中较低的pH、CaO和Mn,是导致该区土壤-水稻系统Cd生物效性较高的主要原因;而碳酸盐岩等分区土壤中pH、CaO、Mn、有机碳等较高的特点,有利于土壤总Cd富集的同时,也减少了该区域土壤水溶态Cd占比,从而降低了这些区域Cd的生物有效性。

