KPNA2在三阴性乳腺癌中的表达特点及其与患者远期预后的关系
彭星华,王芳,史帅,秦晓辉,霍艳兵
(河北省邯郸市第一医院 1.普外一科 2.麻醉科,河北 邯郸 056000)
三阴性乳腺癌(triple-negativebreast cancer,TNBC)占乳腺癌的 15%~20%,是指雌激素受体、孕激素受体和人表皮生长因子受体2均为阴性的乳腺癌[1]。研究[2-3]表明,TNBC较其他类型乳腺癌更易发生在年轻绝经前女性中,其5年生存率明显低于非三阴性乳腺癌患者且具有更早出现耐药、侵袭转移率高、复发率高及预后差的特点。
核转运蛋白karyopherin α2(nuclear transporter karyophenin 2,KPNA2)属于核运输信号超家族,是协助转录因子、mRNA、DNA和RNA聚合酶等进出细胞核的重要运载工具,因而在细胞的分化、增殖、凋亡、发育、迁移及DNA应答和损伤修复过程可发挥重要作用,但关于三阴乳腺癌的相关研究资料较少[4-5]。本研究探讨KPNA2在三阴性乳腺癌患者中的表达特点及与患者远期预后的关系,旨在为临床三阴乳腺癌的治疗靶点和预后提供数据参考。
1 资料与方法
1.1 一般资料
选取2017年1月—2020年2月我院保存的三阴性乳腺癌标本60 例以及非三阴性乳腺癌标本59例,同时选取正常乳腺组织50例作为对照(距离肿瘤边缘≥5 cm),纳入标准:⑴均经病理学确诊;⑵研究前未行放化疗等治疗;⑶女性患者;⑷临床病理资料完整。排除标准:⑴合并有其他系统恶性肿瘤;⑵合并有内分泌疾病等其他严重疾病。各组织患者一般资料比较见表1。本次研究获得医院伦理委员会批准,患者知情同意。
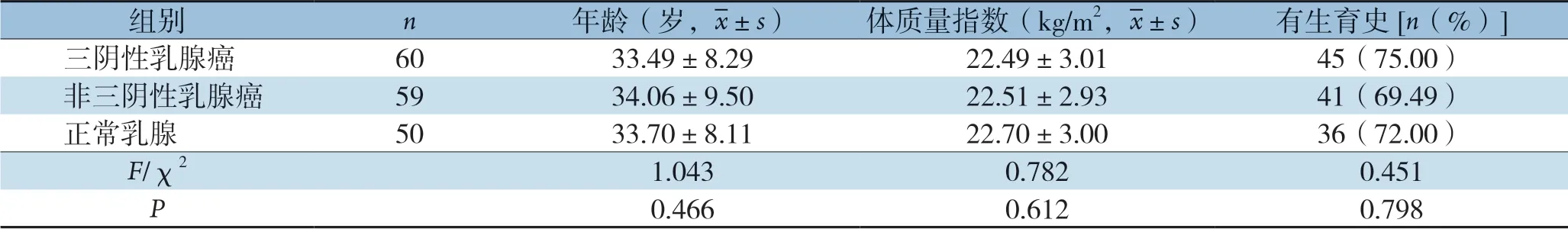
表1 各组一般资料比较
1.2 实验方法
采用免疫组化染色法检测KPNA2表达:取适量乳腺组织,将中性福尔马林固定脱水后的石蜡包埋组织连续切取厚度为3~4 μm的病理切片,晾干后置于75°C烤台,烘烤20 min,依次经二甲苯脱蜡20 min、无水乙醇X2、95%乙醇X2、85%乙醇X2处理,去离子水清洗后利用柠檬酸高压修复抗原过氧化氢(3%)阻断内源化过氧化物酶活性,KPNA2蛋白一抗加入后反应过夜(4℃),二抗30 min孵育(37℃),DAB显色,苏木精复染,PBS代替一抗为阴性对照并设立阳性对照。采用双盲法由2名经验丰富的临床病理专家分别进行单独判断,KP-NA2指标每张切片共观察5个视野,每个视野计数200个肿瘤细胞,共计数1000个细胞。计算阳性细胞的占比情况,阳性细胞数≤5%为0分,5%~25%为1分,26%~50%为2分,>50%为3分;>20%为阳性[6](图1)。
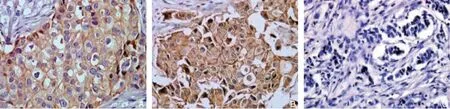
图1 免疫组化染色图(×400) A:三阴性乳腺癌组织KPNA2 阳性表达;B:非三阴性乳腺癌组织KPNA2 阳性表达;C:正常乳腺组织KPNA2 阴性表达
1.3 随访方式
所有三阴性乳腺癌患者采用电话随访和门诊复诊的方式进行随访,随访时间为3~59个月。
1.4 统计学处理
采用SPSS22.0 软件,年龄、体质量指数等数据采用均数±标准差的形式表达,KPNA2阳性表达率等数据采用频数(百分比)形式表达,t检验、F检验或χ2检验分析组间差异;预后曲线采用Kaplan-Meier法描绘,采用Log-rand比较差异;预后多因素分析采用Cox比例风险回归分析。α=0.05。
2 结果
2.1 各组织KPNA2 表达比较
三阴性乳腺癌组织KPNA阳性表达率明显高于正常乳腺组织(χ2=23.489,P=0.000<0.05);与非三阴性乳腺癌组织比较,差异无统计学意义(χ2=0.416,P=0.519>0.05)(表2)。

表2 各组织KPNA2 表达比较[n(%)]
2.2 KPNA2 表达与三阴性乳腺癌临床病理特征关系
在三阴性乳腺癌组织中,中低分化、有淋巴结转移组织KPNA2阳性表达率明显高于高分化、无淋巴结转移组织(P<0.05)(表3)。
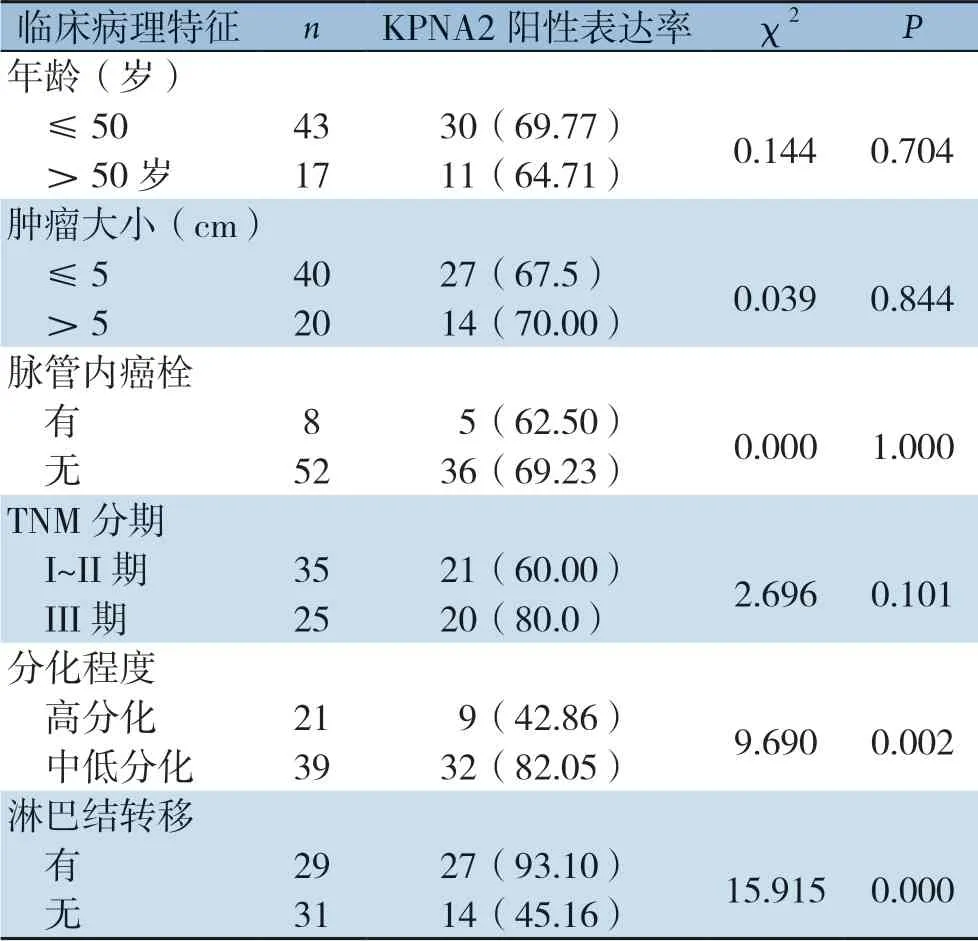
表3 KPNA2表达与三阴性乳腺癌临床病理特征关系[n(%)]
2.3 KPNA2 表达与非三阴性乳腺癌临床病理特征关系
不同非三阴性乳腺癌组织中KPNA2阳性表达率比较差异无统计学意义(P>0.05)(表4)。
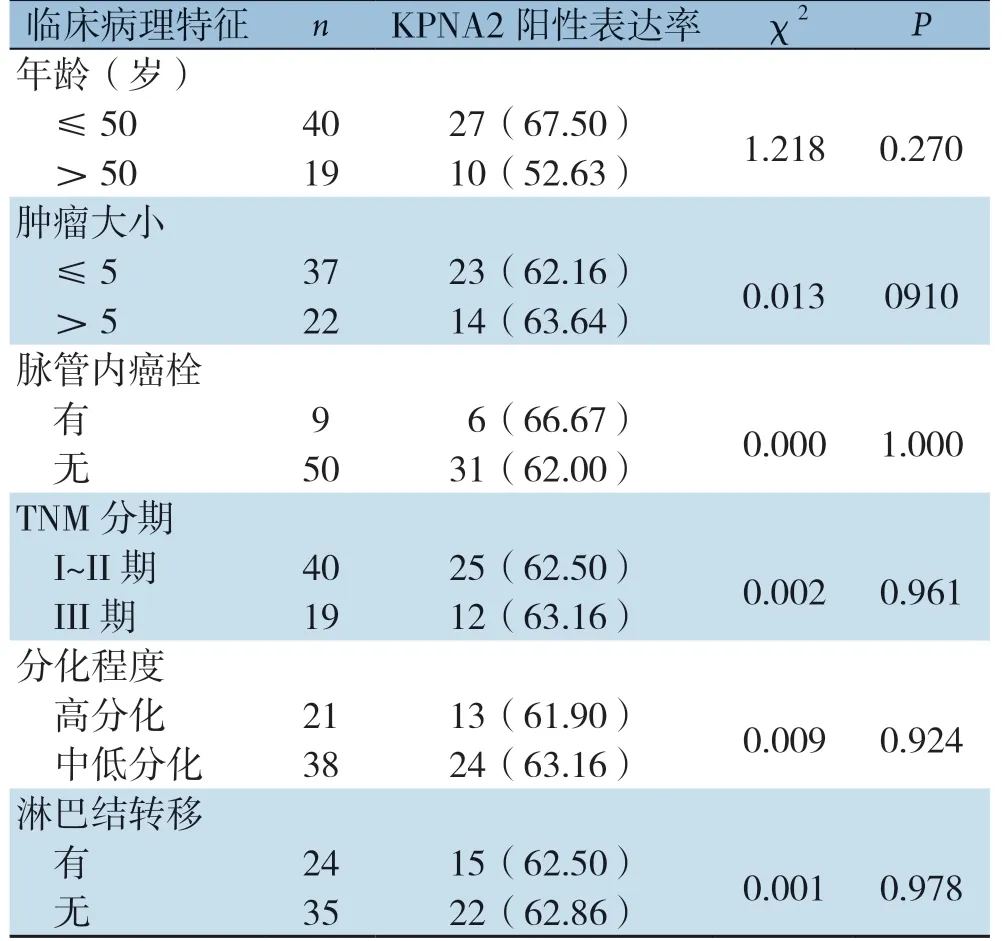
表4 KPNA2表达与非三阴性乳腺癌临床病理特征关系[n(%)]
2.4 KPNA2 表达与三阴性乳腺癌患者CA125、CEA 关系
KPNA2阳性和阴性表达的三阴性乳腺癌患者血清CA125、CEA比较,差异无统计学意义(P>0.05)(表5)。
表5 KPNA2 表达与三阴性乳腺癌患者CA125、CEA 关系(±s)
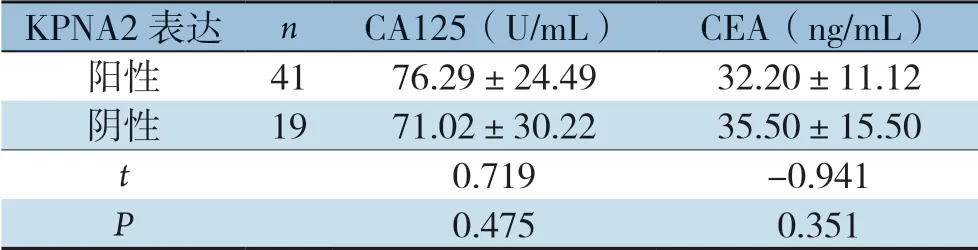
表5 KPNA2 表达与三阴性乳腺癌患者CA125、CEA 关系(±s)
KPNA2 表达nCA125(U/mL)CEA(ng/mL)阳性4176.29±24.4932.20±11.12阴性1971.02±30.2235.50±15.50 t 0.719 -0.941 P 0.4750.351
2.5 三阴性乳腺癌组织KPNA2 表达与预后的关系
在三阴性乳腺癌患者中,KPNA2阳性表达患者中位生存总时间为23 个月(95%CI:29.29~32.71),明显短于KPNA2阴性表达患者31.00个月(95%CI:29.29~32.71),差异有统计学意义(χ2=5.386,P=0.020<0.05)(图1)。
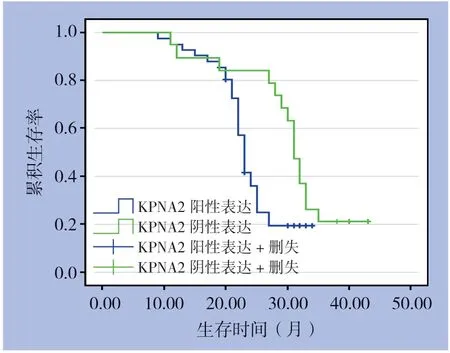
图1 KPNA2 阳性及阴性表达者生存曲线图
2.6 三阴性乳腺癌预后多因素分析
将患者年龄、肿瘤大小、脉管内癌栓、TNM分期、分化程度、淋巴结转移及KPNA2作为自变量进行Cox比例风险回归分析显示:TNM分期、分化程度、淋巴结转移及KPNA2表达是预后的影响因素(RR=1.863、1.650、1.706和1.508,P<0.05)(表6)。
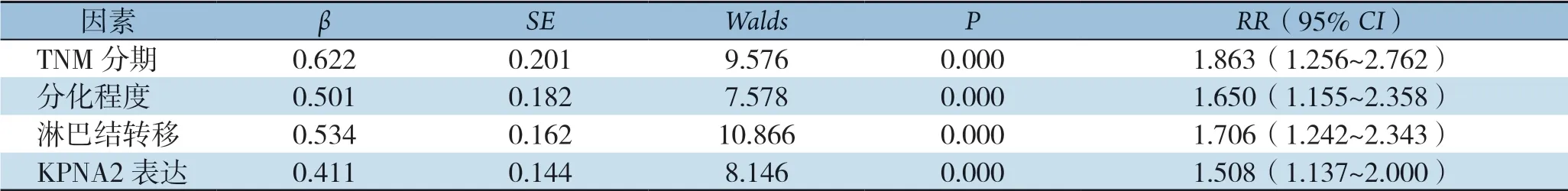
表6 三阴性乳腺癌预后多因素分析
3 讨论
临床上将HER-2、ER及PR均表达阴性的乳腺癌归为三阴乳腺癌,与常规的乳腺癌相比,其具有侵袭能力器及预后较差等特点,患者治疗后极易出现远处转移和肿瘤复发,以肝转移和肺转移较为多见,而脑转移是属于三阴乳腺癌的特征性转移部位[7-9]。现阶段临床对三阴乳腺癌患者采取的常规乳腺癌的蒽环类化疗方法疗效不佳,且靶向治疗和生物内分泌治疗也基本无效,这也是导致三阴乳腺癌的临床预后较差的主要原因[10-12]。
KPNA2一种参与细胞增殖凋亡、分化、免疫反应、转录调节及病毒感染等多种生命活动的核内运输蛋白[13-14]。多项研究已经证实KPNA2能够通过调节肿瘤相关蛋白核转位参与肿瘤的发生、发展过程[15-16]。本研究发现三阴性乳腺癌组织KPNA阳性表达率明显高于正常乳腺组织。上述结果提示三阴性乳腺癌患者存在KPNA2的异常表达。为保证细胞能够准确开展各项功能工作,决定细胞命运和功能的转录因子和mRNA等大分子物质空间定位均需要得到精细调控。而KPNA2作为重要的和运输蛋白能够通过识别大分子的核定位信号,参与乳腺癌细胞的增殖和分化过程[17]。
结果显示,在三阴性乳腺癌组织中,中低分化、有淋巴结转移组织KPNA2阳性表达率明显高于高分化、无淋巴结转移组织。该结果说明KPNA2参与了三阴乳腺癌的转移过程。相关研究[18]提示KPNA2可参与c-myc、E2F1等多种肿瘤相关因子的核转运进程而促进肿瘤细胞的侵袭和恶性增殖;另外,KPNA2还可能通过定位和运输p53的胞浆促进细胞增殖基因表达,进而促进乳腺癌的恶性增殖和侵袭。
大量研究[19-20]提示胃癌、结肠癌、肝细胞癌等多种恶性肿瘤均发现KPNA2的过度表达,并证实过度表达的KPNA2可能与肿瘤的不良预后存在相关性,可以作为一种患者预后的预测指标,指导治疗方案得到选择。有研究[21]发现,乳腺癌基因高表达可能与高Ki-67指数、肿瘤分期、淋巴结转化等有关。进一步预后分析结果显示三阴性乳腺癌患者中KPNA2阳性表达患者中位生存总时间较KPNA2阴性表达患者明显缩短。导致上述结果的可能因为KPNA2具有介导RAC-1等多种转录因子核转位过程的能力,而RAC-1可参与细胞黏附、细胞周期及迁移功能进而肿瘤的发展过程并影响患者预后。
多因素分析结果显示TNM分期、分化程度、淋巴结转移及KPNA2表达是三阴性乳腺癌患者预后的影响因素。故而,三阴乳腺癌患者需要特别注意分期、淋巴转移及KPNA2表达,改善患者的预后。文献[22]提示人乳腺癌病灶组织较癌旁正常组织KPNA2表达上调30%作用且KPNA2表达水平与肿瘤分期、转移浸润正相关,与患者生存率负相关;也有国外研究[18]提示良性乳腺细胞株过表达KPNA2能够可诱导多种恶性细胞增殖分化,但siRNA沉默KPNA2可显著抑制乳腺癌细胞增殖。
本研究的创新在于较系统地对三阴性乳腺癌患者KPNA2表达进行了分析,并证实了其与分化程度、淋巴结转移有一定关系,且与患者预后有关,可以为临床三阴乳腺癌的治疗和预后提供数据参考。

