胸腹主动脉瘤外科治疗现状及进展
耿印帅,李观强,张喜成,3
(1.扬州大学临床医学院 普通外科,江苏 扬州 225001;2.大连医科大学 血管外科,辽宁 大连 116044;3.苏州大学附属独墅湖医院 血管外科,江苏 苏州 215000)
胸腹主动脉瘤(thoracoabdominal aortic aneurysm,TAAA)是指同时累及主动脉胸腔段和腹腔段的动脉瘤,约占所有主动脉瘤的10%[1],该疾病自然病死率高。据统计,当TAAA瘤体直径达到7 cm时,如未经治疗有40%以上的可能性会破裂,2年病死率为76%,5年病死率超过95%[1-2]。目前TAAA采用公认的Crawford分型[3]:I型动脉瘤从左锁骨下动脉起点延伸至腹主动脉近端;II型累及范围最广,从锁骨下动脉到主髂动脉分叉处;III型累及远端胸主动脉并延伸至主髂动脉分叉处;IV型仅限于膈下主动脉;V型从胸主动脉远端向下延伸,终止于肾动脉上方(图1)。TAAA的外科治疗难点在于涉及内脏动脉的重建,因此对任一外科医生都极具挑战。
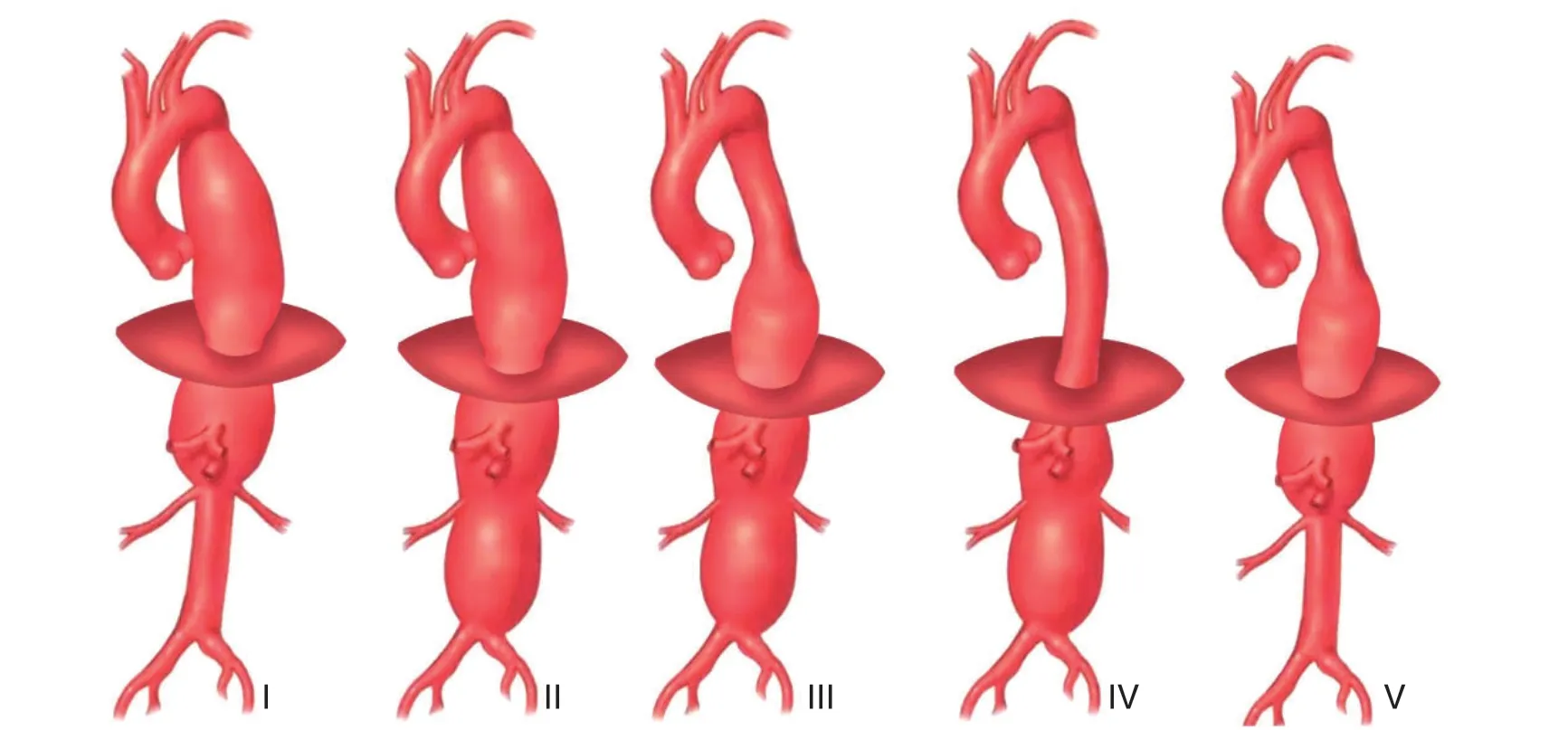
图1 TAAA 分型Figure 1 Classification of TAAA
1 TAAA 的常见病因
目前对于TAAA的发病原因尚未明确,与AAA相似,吸烟、高血压、COPD和外周血管疾病等是此病的危险因素[4]。TAAA也可能继于主动脉夹层,其后期的自然进化或腔内治疗后仍有假腔扩张导致的夹层动脉瘤。但大多数TAAA是退行性的,可能与动脉粥样硬化有关[5]。另外,感染性疾病如梅毒和真菌等,自身免疫性疾病Takayasu动脉炎和巨细胞动脉炎等也会导致此病发生[6-7]。
部分已知先天性遗传性疾病,如结缔组织病Marfan综合征、Ehler-Danlos综合征和Loeys-Dietz综合征,常因先天性的动脉中层结缔组织发育缺陷、胶原纤维薄弱致血管脆弱,容易发生TAAA。截至目前,已有29个已鉴定的基因被证明与TAAA的发生相关,如ACTA2,BGN,COL1A2,EFFEMP2、FBN1及ELN等[8]。这些基因通常编码细胞外基质成分(ECM),即转化生长因子途径(TGF-β),或参与平滑肌细胞(SMC)的功能[9-10]。
2 治疗
TAAA病变累及范围广,自然预后差,尤其涉及到多支内脏动脉,给治疗带来极大难度。目前对于TAAA尚无有效的治疗药物,保守治疗的目的在于控制血压,缓解疼痛等对症治疗[11]。其手术治疗方式主要有3种:传统开放手术、腔内修复术和杂交手术治疗。
TAAA手术治疗的适应证仍然存在一些争议,特别是对于无症状的动脉瘤。根据Laplace定律,破裂的风险与动脉瘤的直径直接相关,超过5 cm的TAAA每增长1 cm每年破裂的风险就会翻倍[12]。鉴于其不良的自然预后,虽手术治疗有很高的风险,但大多学者仍支持对TAAA进行外科治疗。目前一般对以下情况建议外科干预:⑴破裂或有破裂前兆的TAAA;⑵出现急性夹层并有灌注不良或其他并发症;⑶有症状的TAAA;⑷每年瘤体直径增长>1 cm;(5)虽直径<6.0 cm,但合并有结缔组织疾病者[13]。
2.1 开放手术修复
1955年,Etheredge等[14]在美国首次进行了TAAA开放手术,随后DeBakey等[15]采用主动脉置换技术证实外科方法治疗TAAA,后续并对该术式进行改良并证实治疗TAAA的可行性。因当时相关辅助技术及器械、材料的限制,采用近远端分流方式,采用人工血管行降主动脉与腹主动脉或髂动脉的吻合,切除瘤体并重建腹腔动脉、肾动脉等重要分支,未对肋间动脉和腰动脉进行重建,不过,该手术时间长,出血多,术后病死率较高,截瘫风险大[16-17]。
随着对TAAA认识增加及器械材料的进展,1978年Crawford等[18]报导采用改良手术治疗82例TAAA,首次通过主动脉内吻合完成近端重建,并采用脑脊液引流、体外循环、深低温停循环等现代技术,依次完成主动脉和分支血管片的吻合。该术式不切除瘤体,重建或保留了肋间动脉和腰动脉,降低了病死率6%,截瘫率6%,是现代胸腹主动脉外科手术方式的基石。国内Wang等[19]对Crawford术式进行改良,降低了手术创伤,提高了手术安全性。
Coselli等[16]报导近30年共3346例通过传统开放手术治疗胸腹主动脉瘤的数据资料,<50岁组的手术病死率和并发症发生率较低。Kahlberg等[17]报导TAAA采用开放手术治疗患者382例,住院期间病死率和截瘫率分别为7.6%和8.1%,5年随访内脏动脉均保持很高的通畅率(腹腔干98%、肠系膜上动脉100%、右肾动脉96%,左肾动脉82%),显示TAAA的开放手术具有理想的中远期疗效。
TAAA经典开放手术对医生的技术要求较高,同时Crawford分型也与术后并发症相关,II型和III型术后不良事件最高,达20%,其中III型有高达7.6%的永久性截瘫发生率[20]。随着外科技术和术后监护技术的发展,手术病死率和后期并发症发生率已经降到了最低点,预后一般良好。在技术成熟的医生和中心手中,可接受的手术病死率应低于5%,截瘫发生率低于5%。对于较为年轻的TAAA患者推荐开放手术治疗[21],这些患者能良好耐受手术创伤术后并发症相对较低,远期效果好,但仍建议这类患者集中在手术量较大的中心进行治疗。
2.2 腔内修复术
近50年血管腔内技术发展迅速,TAAA的腔内治疗已成为重要治疗手段,随着技术进步及器具改进,TAAA的全腔内治疗取得越来越好的效果[22-24]。腔内修复与开放手术相比有两个优势[25]:第一,避免创伤很大的胸腹大切口,对心肺影响小;第二,无需阻断主动脉,避免重建过程中的内脏缺血等情况。不过,采用全腔内治疗也有其不足,如无法对大的肋间动脉进行血运重建,长段肋间动脉的覆盖意味着TAAA全腔内修复可能有更高的脊髓缺血率[26]。另外,全腔内治疗的远期疗效尚有待更多数据证实。
目前,TAAA的腔内治疗主要包括开窗、分支支架及平行支架技术[27]。开窗支架有商品化订制和医生台上自制,商品化订制开窗支架对主动脉解剖也有较高要求,解剖不良的TAAA订制开窗支架置入时同样也会遇到诸多问题。且订制支架价格高昂,时限一般也需要4~6周。另外,许多医生会在手术台上根据血管状况现场制作开窗支架,国内刘昭等[28-31]采用3D打印技术引导支架开窗位置,提高了手术安全性及疗效,但对于明显主动脉扭曲病变,在分支动脉的精准对位上仍存在挑战。一旦支架置入定位的不够精准,不仅导致内脏动脉缺血或脏器丢失,或远期分支支架闭塞,也可能因内漏导致封堵失败。
与开窗支架相同,分支支架也需要在术前进行定制或台上自制。一般来说分支支架比开窗支架具有更低的内漏发生率,它可以根据瘤体管腔大小、分支动脉位置调整分支长度和路径,也可以设计为内嵌式分支支架,以更好适应解剖形态,减少内漏发生。但同样要求分支支架对位精准,对主动脉及分支动脉的解剖形态也有一定要求[32]。
鉴于商品化的开窗或分支支架存在的时效问题,以及台上自制支架存在破坏产品构造、潜在伦理因素、无统一标准等不足,而平行支架技术则利用现有支架,通过八爪鱼、烟囱、潜望镜等技术,为腔内治疗TAAA提供了另外一种选择[33-35],相对而言,平行支架更为简便易施,但采用平行支架技术治疗TAAA,存在的缝隙造成的Ia型内漏是其天生之不足,“八爪鱼”技术因桥接的分支支架较多,暴露在瘤腔内多段支架在血流冲击下的摆动,可能导致后期的III型内漏发生率增加,甚至桥接支架脱落。王文闻等[36]回顾开窗分支支架技术治疗共16例,结果显示:临床技术成功率100%,1例患者术后发生近端I型内漏,二期腔内处理后内漏消失。Gallitto等[37]报道了腔内治疗的33例TAAA,I型、II型、III型和IV型的比例分别为4%、21%、57%和18%。分别采用开窗或分支支架技术,无术中死亡,术后30 d病死率为6.6%,内脏动脉通畅率为97%,术后6、12个月和24个月生存率分别为90%、85%和68%,内脏动脉在术后3、6个月和24个月的通畅率分别为95%、90%和90%,术后没有出现内漏,无TAAA相关死亡。Spanos等[29]报道42例分支支架治疗先兆破裂或破裂TAAA,内脏动脉分支支架成功重建率为97%。术后脊髓缺血的发生率为21%,术后肾功能不全发生率为23%,其中包括2例需要永久性透析;30 d病死率为14%,没有发生术中死亡;术后1个月,I型、II型内漏发生率分别为0和43%;分支支架通畅率为99%。该报道提示全腔内治疗TAAA同样有不低的并发症和病死率,应值得重视。
完全性的腔内治疗还存在不足,如可能需要较多的对比剂用量,患者和术者可能接受较长时间的辐射暴露[38],其远期治疗效果仍需验证,可能存在更高的再次干预几率[39-41]。另外,目前还缺乏腔内治疗与开放治疗两者疗效的对照研究,且该技术多集中于高度专业的大中心实施,以及高昂的耗材价格,限制了该技术的广泛应用。总的来说,腔内治疗应选择外科手术的高危患者,以及解剖形态适合行腔内治疗的患者,对于脊髓缺血的高危患者,围术期选择性做好预防性脑脊液引流、维持良好的脊髓灌注压等措施,以尽可能减少脊髓缺血的发生。另外,推荐TAAA的腔内治疗技术,在拥有足够病例的大中心实施,无疑对减少并发症、提高疗效是大有裨益的。
2.3 杂交手术修复
通过杂交手术治疗TAAA由Quiñones-Baldrich在1999年首次报道等[42]。杂交技术结合腔内修复术及开放手术,其通过开放手术重建内脏分支动脉,介入技术完成主动脉支架植入。为开放手术的高危患者提供了更多的治疗机会和选择。杂交手术避免了开胸带来的巨大创伤、以及主动脉阻断带来的缺血损害。而且,对于需要大范围覆盖节段动脉的TAAA,手术可以分期完成,有利于降低脊髓损伤风险[2,43]。
TAAA杂交治疗的早期结果令人鼓舞,在单中心报告中,手术病死率为8.6%~13.5%,5年生存率为62%,截瘫和肾衰竭率接近或优于开放手术组[44-45]。但也有部分作者认为,TAAA的杂交手术与开放手术相比,并未体现出明显的优势[46],杂交技术同样有较大的创伤、不低的并发症。患者选择杂交手术而未选择开放手术,常因合并症或其他开放手术的高危患者,或是TAAA破裂与灌注不良的需要紧急手术的病例,目前还缺乏随机或对比研究来证实杂交技术相对于开放手术的优势。因此目前杂交手术尚不能作为TAAA治疗的标准方式,仍需要技术和器材的进步,以及长期的随访结果评价。
3 总 结
TAAA的自然预后差,累及范围广泛,涉及重要的内脏动脉,外科开放手术仍是标准治疗方式,手术相关风险较高,但具有可靠的持久性疗效。杂交手术和全腔内介入手术可以减少开放手术带来的损伤,并显示出其良好的近期效果,是有效的治疗选择。随着技术提高及器具的改进,全腔内技术显示出良好的发展前景。针对TAAA的治疗选择,应根据患者的个体化原则,选择最佳的治疗方案。但目前国内各专业之间的协作机制尚不完善有效,对不同术式的选择,大多并非基于患者整体状况或病变解剖的评估,更多是基于各自专科技术的限制。因此,完善的多科协作机制,对提高TAAA的手术安全性和持久疗效,是至关重要的。

