风湿性二尖瓣置换术后左心室假性室壁瘤形成15例文献复习
徐学萍 汪汉 黄刚 张扬春 罗勇 熊峰 陈杰 蔡琳
(1.西南交通大学附属医院 成都市第三人民医院心内科,四川 成都 610031; 2.西南交通大学附属医院 成都市第三人民医院心脏大血管外科,四川 成都 610031; 3.西南交通大学医学院,四川 成都 610031)
二尖瓣置换术(mitral valve replacement,MVR)是风湿性二尖瓣重度病变的重要治疗手段,其术后晚期可能导致左心室假性室壁瘤(left ventricular pseudo-aneurysm,LVPA)形成。LVPA即左心室室壁晚期破裂,是部分心脏破裂后,血液进入由粘连的心包或瘢痕组织所包含的囊,形成与左心室连通的假性动脉瘤,是一种罕见但致命的并发症。据Kasahara等统计,在1990—2006年接受MVR的10 978例患者中左心室破裂的发生率为0.56%,死亡率为57.4%[1]。而中国医学科学院阜外医院[2]5 449例MVR手术中,有13例术后左心室破裂,发生率为0.24%,84.6%(11/13)患者有风湿热病史。目前关于风湿性二尖瓣置换术(rheumatic mitral valve replacement,RMVR)术后LVPA形成的临床表现、诊断时间、瘤特征、治疗和预后的资料极有限,手术修复的风险也鲜为人知。本文回顾并总结了在PubMed、万方、CNKI报道的15例RMVR术后LVPA形成病例,旨在分析RMVR术后LVPA的临床特征、影像资料、治疗与转归,以评估手术风险并提出治疗建议。
1 资料与方法
1.1 资料来源和筛选
1.1.1 资料来源
本文采用“pseudoaneurysm”“false aneurysm”“left ventricular sub valvular aneurysm”“false ventricular aneurysm”“left ventricular rupture”和“mitral valve replacement”“mitral valve annulus repair”“mitral valve repair”“mitral valve annuloplasties”“mitral annuloplasty”及非“aortic root replacement”“mitral-aortic intervalvular fibrosa pseudoaneurysm”“aortic pseudoaneurysm”“left ventricular outflow tract”“postinfarction”“infarct”“endocarditis”等不同形式的词检索PubMed数据库1980年1月—2020年10月发表的文献311篇(表1),同时使用“假性室壁动脉瘤”“假性室壁瘤”“左心室破裂”“二尖瓣置换术”和“风湿性心脏病”等词检索万方、CNKI等中国数据库近40年发表的相关文献。

表1 PubMed的检索策略
1.1.2 结局指标定义及纳入和排除标准
1.1.2.1 LVPA的定义:左心室室壁破裂是MVR后一种罕见而严重的并发症。临床上,根据破裂发生的时间分为三种类型:早期、延迟和晚期。早期破裂是体外循环终止后手术室随时发生的事件;延迟破裂是指转移到重症监护病房数小时至数天后发生的情况;晚期破裂是MVR后数天至数年内出现的事件[3]。LVPA即左心室室壁晚期破裂,定义为RMVR后数天(≥7 d)至数年内出现的事件。
1.1.2.2 纳入及排除标准:纳入标准:(1)左心室破裂;(2)LVPA;(3)MVR后。排除标准:(1)左心室早期或延迟破裂;(2)合并其他可引起LVPA的病因(如心肌梗死、外伤和感染性心内膜炎等);(3)合并左心室真性室壁瘤。根据纳入和排除标准,有21例患者的信息从18篇文献[4-21]中得到,其中5例患者因信息缺失[14,20]和1例重复病例被排除[21],共有15例病例被纳入研究。
1.2 资料收集
收集患者的临床信息,包括性别、年龄、症状、体征和影像学资料。记录RMVR术前二尖瓣瓣膜病变类型(包括关闭不全、狭窄和混合病变,其中合并瓣膜和环钙化、腱索缩短、瓣膜小叶增厚/钙化/粘连定义为混合病变)、二尖瓣瓣膜置换类型(包括机械瓣/生物瓣及瓣膜型号)、RMVR术后并发症、是否行二次RMVR、发现LVPA距离RMVR的时间(以RMVR术后/二次RMVR术后为时间起点)、瘤和瘤颈位置、瘤颈直径和与之平行的瘤腔横径最大值(用多种方法测量者采用准确性最高的数值,比如同时使用心脏超声和CT报道瘤大小者,采用CT所报道的值)。记录诊断LVPA后的治疗方案、随访情况和预后。
2 结果
本次研究纳入15例RMVR术后LVPA形成的患者,其中8例来自亚洲(中国、日本、印度和土耳其),5例来自美洲(美国和加拿大),2例来自欧洲(意大利和法国)。14例病例用英文发表,1例病例用中文发表。
2.1 临床特点
86.7%的LVPA患者(13/15)为女性,中位年龄为62岁(33~75岁)。在RMVR术前二尖瓣病变中,以二尖瓣狭窄占比最高(46.7%,7/15),其次是关闭不全(40.0%,6/15)。73.3%(11/15)的患者有二次RMVR史。73.3%的患者(11/15)在RMVR术中安置机械瓣,植入瓣膜直径为27 mm(25~35 mm)。RMVR术后并发纵膈出血和心包积液分别有2例,详见表2。
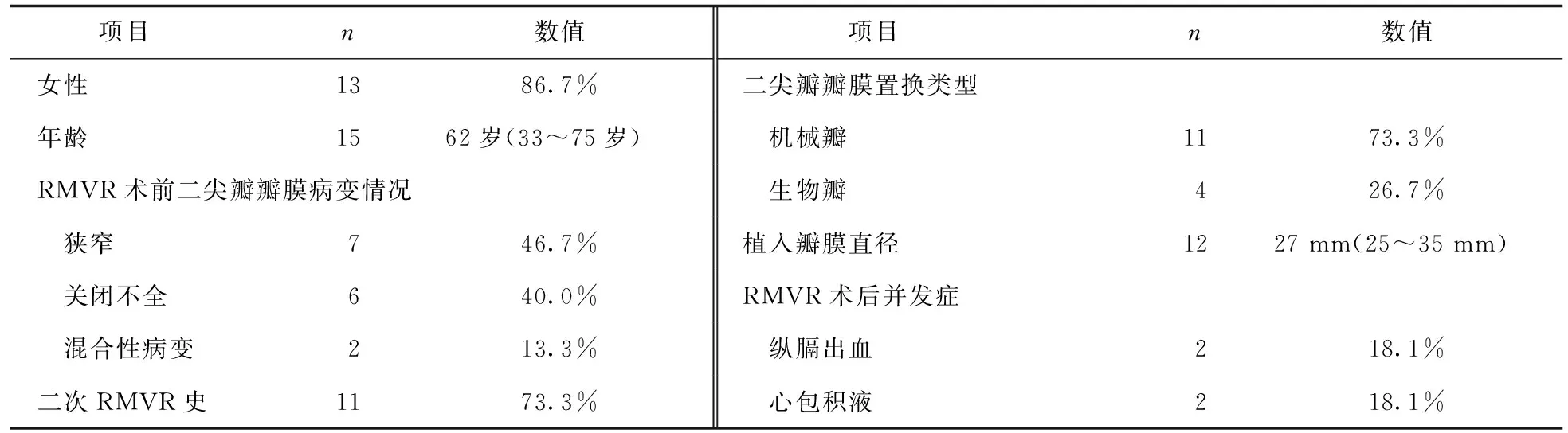
表2 LVPA患者行RMVR术前和术后的基本情况(n=15)
2.2 LVPA的临床特征、影像学检查和瘤体的基本特征
在LVPA患者中,5例患者出现急性症状(突发严重胸痛伴呼吸困难、突发上腹部疼痛或心室颤动),5例患者在检查时偶然发现,这提示LVPA在无并发症的情况下可能无症状。其他患者表现为慢性不典型症状,最常见的是充血性心力衰竭的临床表现,即劳累/运动后呼吸困难、双下肢水肿等。6例患者在诊断LVPA前可闻及新出现的瓣膜杂音,见表3。
超声心动图(80.0%,12/15)是初步筛选或诊断LVPA的首要检查方法,包括经胸超声心动图(transthoracic echocardiography,TTE)和经食管超声心动图(transesophageal echocardiography,TEE)。计算机断层扫描(computed tomography,CT)、CT血管成像(computed tomography angiography,CTA)和磁共振成像(magnetic resonance imaging,MRI)作为附加的可视化方法辅助诊断,其中,分别有6例LVPA患者在TTE/TEE初步筛查后使用CT/CTA进一步评估,3例直接使用CT/CTA进行诊断。LVPA的诊断时间中位数为RMVR/二次RMVR术后2.5月(10 d~9年)。其中,8例(57.1%,8/14)LVPA是在术后半年内发现的。
LVPA瘤颈的位置常见于二尖瓣环(66.7%,10/15),以二尖瓣后环(46.7%,7/15)最常见,瘤颈直径为1.0 cm(0.3~3.0 cm)。LVPA的位置最常见于左心室后内侧壁(66.7%,10/15),瘤腔横径最大值为4.0 cm(1.1~12.2 cm),瘤腔横径最大值<4.5 cm的LVPA占63.6%(7/11),瘤颈/与之平行的最大瘤径比值为0.15(0.1~0.6)(见表3)。这些结果提示RMVR术后的LVPA大部分常见于二尖瓣环部分缺失的区域或其下方。大部分LVPA体积和瘤颈直径较小。
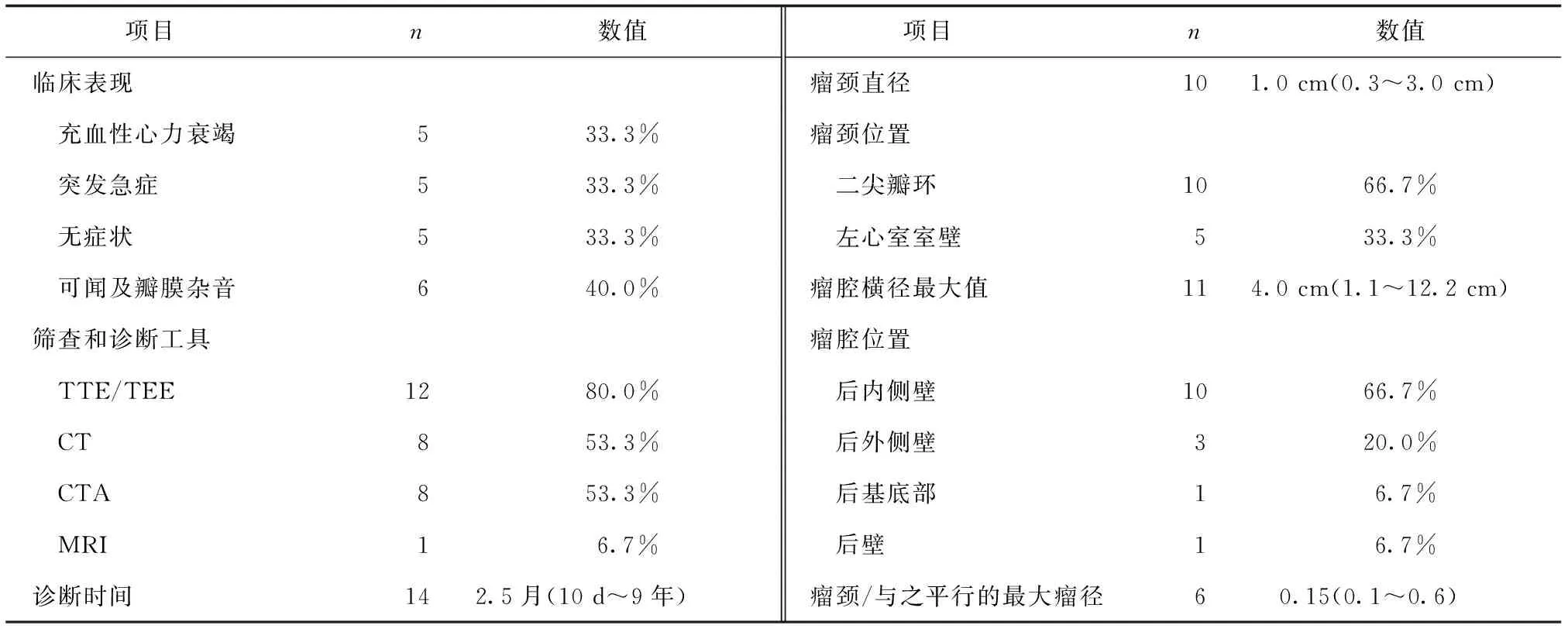
表3 LVPA的临床特征、影像学检查和瘤体的基本特征(n=15)
2.3 治疗情况
在本研究中,8例患者在发现LVPA后进行手术治疗;7例患者拒绝手术采取保守治疗并随访,其中3例患者在随访期间发现LVPA变大而放弃保守治疗选择手术,见表4。
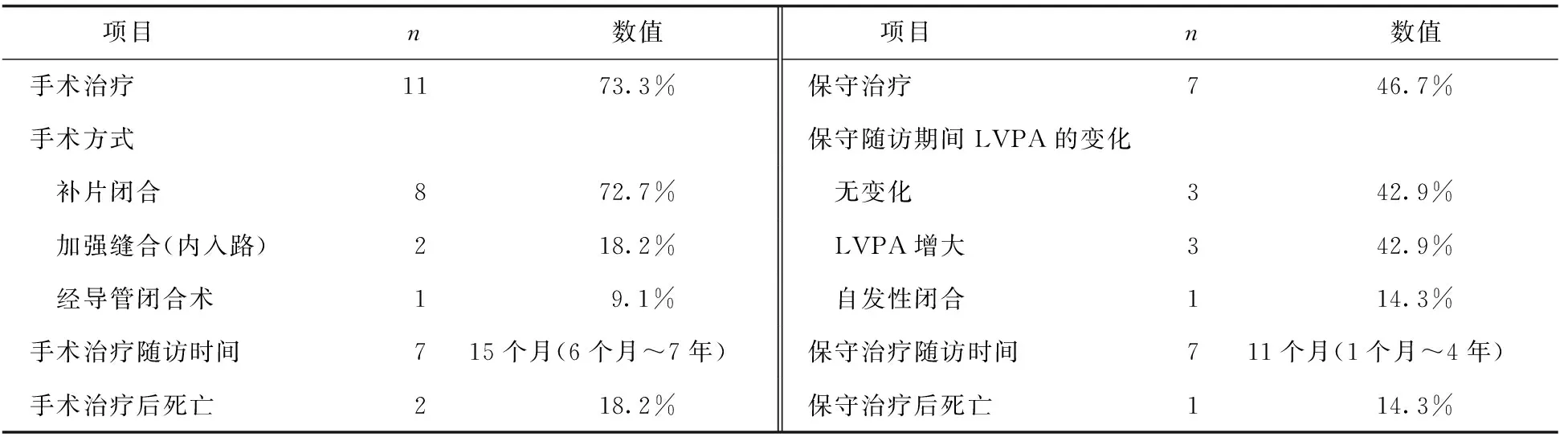
表4 LVPA的治疗情况、随访和转归(n=15)
在手术治疗(11例)中,补片闭合治疗LVPA最常见,被用于8例患者,补片类型包括人工补片(5例)、自体心包补片(1例)、牛心包补片(1例)和马心包补片(1例)。2例患者采用特氟隆毡条加强缝合线间断缝合LVPA的治疗方法,1例患者采用经导管闭合术治疗。在中位随访时间15个月(6个月~7年)内,2例患者手术治疗后死亡,死亡率为18.2%(2/11),其中1例患者在补片闭合术后第3天因低输出综合征死亡[13],1例患者在修补LVPA术后1年死于假体血栓栓塞[10]。
在7例保守治疗中,随访时间为11个月(1个月~4年),1例随访4年后死于室性心动过速[5],死亡率为14.3%(1/7)。1例LVPA瘤颈在RMVR术后2.2年自发性闭合[17],3例随访期间LVPA的大小无变化,3例随访期间LVPA增大。其中1例在RMVR术后第55天发现LVPA,随访7个月,LVPA直径由5 cm增大到7 cm,予补片闭合术[8];1例在RMVR术后第2个月发现LVPA,随访8个月,LVPA增大(直径7 cm),予补片闭合术[11];1例在RMVR术后3个月发现LVPA,因在随访期间(1个月后)出现呼吸困难和胸痛,LVPA增大(7.5 cm×5.0 cm×3.0 cm),患者行导管闭合术[19]。
3 讨论
LVPA是一种致命的疾病,通常继发于心肌梗死、感染性心内膜炎、心脏创伤或瓣膜置换术后,发病率极低。而RMVR术后,在心包粘连的情况下发生心脏破裂,或在成功修复心脏缺损后重新开放时形成LVPA[22]。与真性室壁瘤(室壁离散性变薄)不同的是,LVPA的壁是由纤维组织和心包构成,因此会有很高的破裂风险。
风湿热的免疫性炎症常导致腱索、瓣膜小叶和瓣膜连合的异常。典型的病变包括腱索的弥漫性增厚、融合和缩短,瓣膜小叶的弥漫性纤维化并增厚和瓣膜连合融合,通常还会出现瓣膜小叶钙化,二尖瓣孔呈“鱼嘴”样外观[24]。因此,在风湿性心脏病中,瓣膜特异性病变不仅局限于瓣膜水平,还存在于瓣膜下。本文的RMVR术前二尖瓣病变中,以二尖瓣狭窄占比最高(46.7%,7/15),其次是关闭不全(40.0%,6/15)。术后LVPA大部分直接起源于二尖瓣环(66.7%,10/15)或其下方部分缺失的区域,最常见的是累及二尖瓣环后环(46.7%,7/15)。因此为预防LVPA,在RMVR的手术过程中,应谨慎处理二尖瓣后环及后外侧连合处的组织,防止清创过度。
RMVR术后LVPA的诊断可能很困难,因为大多数患者可能无症状或出现非特异性症状。在本文一系列的LVPA病例中,2/3的病例无症状或表现为慢性不典型症状,最常见的是充血性心力衰竭的临床表现,只有1/3的病例表现为急性症状。这一结果提示在RMVR术后随访期间出现充血性心力衰竭症状时,临床医生应警惕致命性并发症LVPA的潜在威胁。在LVPA患者中,36.4%(4/11)在RMVR术后并发纵隔出血或心包积液。因此风湿性心脏病患者在接受RMVR时,术后出现纵隔出血和心包积液,应考虑二尖瓣瓣环微小破损的可能,及时发现术后残留LVPA。
TTE/TEE(80.0%,12/15)是初步筛查或诊断LVPA的首要检查方法。TTE/TEE能清楚地显示LVPA的大小及其交通颈的解剖位置,可用于LVPA的初步评估和随访。当瘤颈太小而无法检测时,进行综合性检查是必要的,其他诊断方法包括CT、CTA和心脏MRI。利用这些检查手段,对LVPA进行早期诊断并明确LVPA与邻近血管的解剖关系,进行术前评估。在本研究中,发现LVPA距离RMVR/二次RMVR术后的中位时间为2.5个月(10 d~9年),大部分LVPA(57.1%,8/14)是在RMVR术后半年内发现的。因此,风湿性心脏病患者在RMVR术后半年内,使用TTE/TEE密切随访是有必要的。
LVPA一经确诊,应积极进行外科干预。修复LVPA推荐的手术方法包括内、外或联合入路[25]。在二尖瓣环、后壁或大面积左室破裂的病例中,内入路是首选,它包括重新开放左心房和从内矫正心脏破裂,缝合线穿过瓣膜缝合环,从房室沟下方穿出左心室后壁,利用特氟隆毡条加强缝合线缝合,可同时避免移除瓣膜和损伤回旋动脉。而对于局限于心肌的小缺损或术后残留LVPA,一般提倡直接缝合的外部修复,其侵袭性较低且通常不使用体外循环[26]。在广泛的心室肌损伤情况下,建议联合手术切除人工瓣膜并修补心室内外膜。本文手术治疗包括补片闭合治疗(8例)、加强缝合线间断缝合治疗(2例)和经导管闭合术(1例),经导管闭合术亦可作为一种新型有效的治疗策略。3例在保守随访期间LVPA扩大,予以手术修复;1例急性LVPA因室性心动过速而猝死[27];1例巨型LVPA(12.2 cm×8.7 cm)在胸腔压力急剧增大后突发破裂出血[16];1例在RMVR术后第55天发现LVPA,随访7个月,LVPA直径由5 cm增大到7 cm,予补片闭合术[8]。因此,在大型或急性或慢性进展性LVPA中,发生致命性破裂出血的可能性高于手术风险,有必要行手术修复。
当LVPA很小且交通颈很窄时,保守治疗是可行的。在本文7例保守治疗患者的随访资料中,3例随访期间LVPA的大小无变化,病程较稳定;1例LVPA瘤颈(直径0.4 cm)在RMVR术后2.2年自发性闭合。Sakai等[23]报道的8例MVR术后并发LVPA患者中有7例保守治疗,在随访5~136个月仍存活。Prêtre等[25]认为小型无症状慢性LVPA(直径<3 cm或大小无变化)可不用手术治疗。本文瘤体横径最大值<4.5 cm的LVPA占比63.6%(7/11)。因此,对于小型慢性无症状的LVPA患者,保守随访是可行的。当然,LVPA一旦进展或出现急性症状,应立即予以检查及手术治疗。
本研究局限于可获得的样本量过小,结果可能会被夸大,需多中心的大型研究或更多的病例进一步验证。此外,被纳入患者的部分数据缺失可能导致研究结论并不完善。
总之,对于风湿性心脏病患者而言,女性、高龄、二尖瓣狭窄、安置机械瓣和行二次RMVR是RMVR术后LVPA形成的易感因素,2/3的LVPA无症状或表现为慢性不典型症状,以充血性心力衰竭的临床表现最为常见。在RMVR术后半年内使用TTE/TEE密切随访是有必要的。MRV手术过程中防止二尖瓣瓣环清创过度可预防LVPA的发生。LVPA首选外科治疗,但对于小型慢性无症状的LVPA患者,保守随访是外科治疗的一种替代方法。