干细胞疗法治疗左心发育不全综合征的研究进展
奉伟庭,肖宜超
左心发育不全综合征(hypoplastic left heart syndrome,HLHS)是一组先天性心脏畸形,以左心室腔缩小、主动脉瓣口和/或左房室瓣口狭窄或闭锁为主要特征,致死率极高,患儿猝死多发生在出生第1个月内。目前,姑息手术和心脏移植是HLHS的两大治疗措施,但二者均存在局限;接受三期手术治疗的HLHS患儿右心衰竭发生率极高,导致患儿远期存活率极低。目前,国内外HLHS治疗领域相关研究越来越多,其中干细胞疗法因对HLHS有巨大的潜在应用价值而逐渐崭露头角。本文主要综述了干细胞疗法治疗HLHS的研究进展,以期提高临床医务人员对干细胞疗法的认识。
1 HLHS的流行病学
HLHS作为最复杂的先天性心脏病类型之一,其发病率为19/10万,其患病人数占先天性心脏病总数的1.4%~3.8%[1-2]。HLHS是新生儿出生第1年死亡率最高的先天性心脏病[3],新生儿出生第1个月死亡率约为15%、第1周约为23%[4]。有研究发现,干细胞疗法治疗HLHS的效果与年龄呈负相关,新生儿出生第1年治疗效果最佳[5]。据2019年一项研究统计,亚洲地区HLHS发病率首次高于西方国家及非洲地区[6]。
2 HLHS的临床概况
2.1 临床症状 HLHS以左心室、升主动脉、主动脉瓣和左房室瓣发育不良为主要特征[7],根据主动脉瓣和左房室瓣狭窄/闭锁程度分为四类,即动脉和左房室瓣均狭窄、主动脉和左房室瓣均闭锁、主动脉闭锁伴左房室瓣狭窄及左房室瓣闭锁伴主动脉狭窄;根据左心室大小分为三类,即狭缝状左心室、左心室小型化、左心室增厚并伴心内膜纤维弹性增生[8]。目前,HLHS发病机制存在两种假说,一是血流异常导致左心发育不全,其实质为左心发育不全出现在左房室瓣闭锁致血流量减少之后;二是左心自身发育不全。但由于部分患儿虽存在左心发育不全,但并无明显心血管闭锁,故目前主流观点认为左心自身发育不全是HLHS的主要发病机制[9]。
2.2 治疗方法 HLHS患儿通常在出生后1周内死亡,在1981年Norwood手术方式出现之前HLHS几乎无法医治,之后随着研究不断深入,临床研究者开始利用前列腺素E2保持动脉导管畅通以维持全身血供和冠状动脉血供[10]。虽然上述方法在短期内能够达到预期效果,但患儿仍难以靠此法存活较长时间。为了延长HLHS患儿的存活时间,心脏移植或外科三期手术是必要的[11]。经历三期手术的最终结果是体循环和肺循环得到分离,一期Norwood手术通常在新生儿出生第1周进行,其目的是确保心脏能够保持肺循环和体循环[2,11-12],手术示意图见图1a。为了减少右心室负担,通常会在新生儿出生后4~6个月进行二期双向Glenn手术/Hemi-Fontan手术,患儿两岁时进行三期Fontan手术。二期手术的目的是将上腔静脉与右心房断开并吻合到肺动脉,以便血液流入肺动脉,见图1b;三期手术的目的是将静脉血回流至下腔静脉[13],见图1c。但一期Norwood手术并不适用于所有HLHS患儿,且其术后10年存活率仅为40%,而且行此手术患儿术前需生命体征平稳且能够进行体外循环。在此背景下,GIBBS等于1993年率先报道了Hybrid手术方式(图2),其优点是能达到Norwood手术效果,且没有手术时体外循环的生理压力[14-15]。尽管Norwood手术存在一定缺陷,但其技术相对成熟,治疗效果较Hybrid手术好[14],而Hybrid手术目前仅用于状态不稳定的HLHS患儿,故患儿家属常选择Norwood手术而非Hybrid手术[16]。
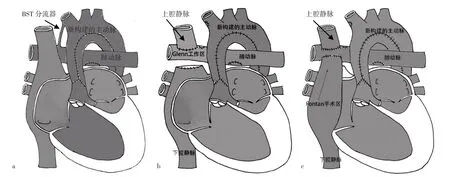
图1 三期手术示意图Figure 1 Diagrammatic sketch of the three-stage operation
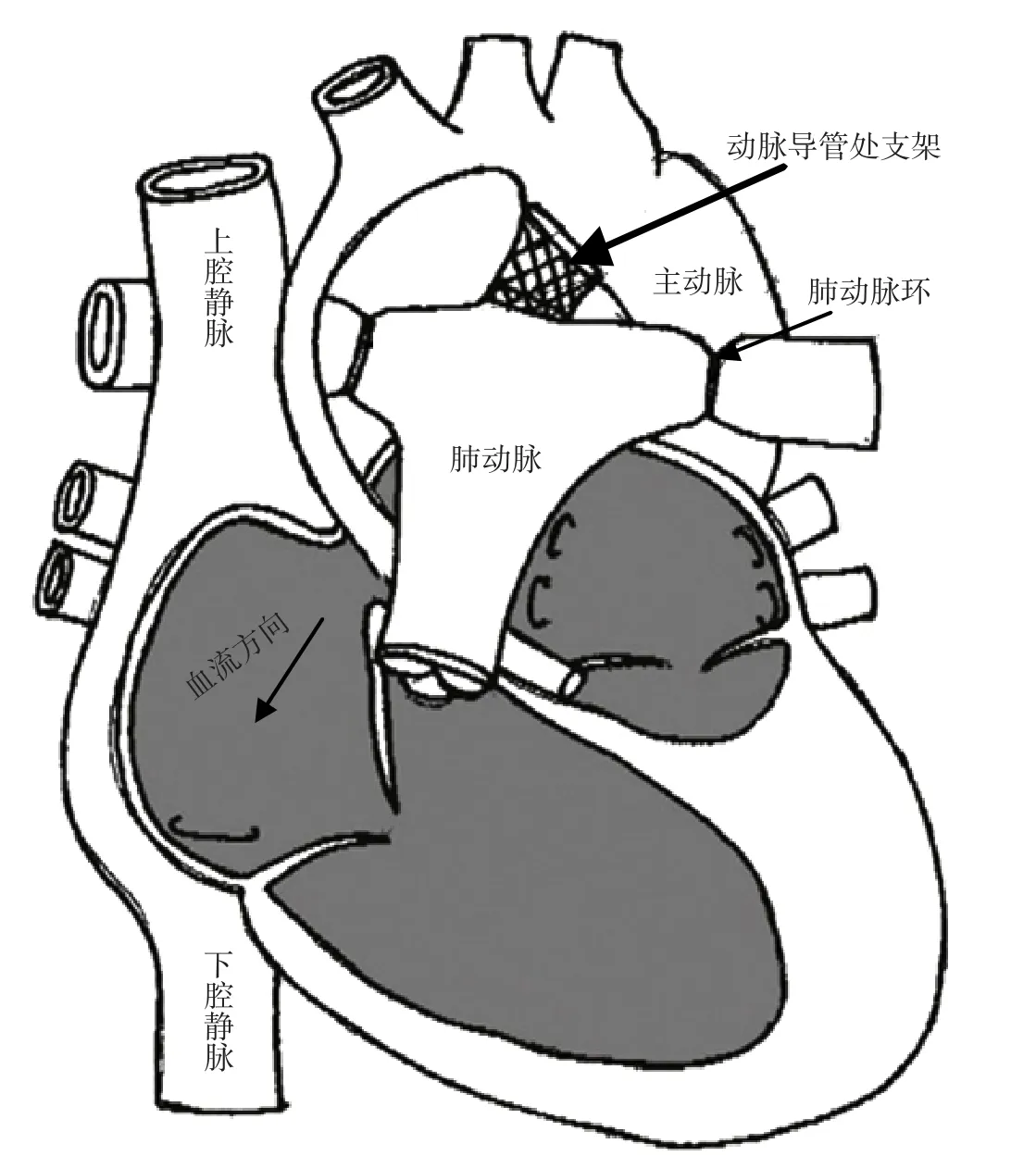
图2 Hybrid手术示意图Figure 2 Diagrammatic sketch of Hybrid surgery
3 HLHS干细胞疗法
尽管近年来HLHS治疗技术和护理有所进步,心脏移植仍是目前根治HLHS的最终选择,但接受三期手术治疗的HLHS患儿心脏移植后的存活率也非常低,再加上心脏供应和匹配困难,故延长或避免心脏移植一直是临床研究热点[17]。此外,由于HLHS患儿术后右心室负荷增加及护理困难,临床研究者迫切希望寻找一种能够改善甚至代替外科手术和心脏移植的方法。近年随着研究不断深入,HLHS的发病机制已涉及细胞水平[9,18]、分子水平[9,19-21]。在此背景下,干细胞疗法逐渐在HLHS治疗领域崭露头角。
HLHS患儿右心室心肌肥大、血管生成和抗氧化活性增加,但仍无法适应过度的氧化应激,故患儿常出现缺血和代偿性心力衰竭等症状,而干细胞疗法可有效解决上述问题。干细胞疗法主要用于改善HLHS患儿右心室功能衰竭,其机制可能与通过旁分泌途径促进血管生成因子生成等来促进血管新生、增加右心室体积有关[22]。目前,可用于临床的潜在干细胞有间充质干细胞、脐带血来源单核细胞、心肌球源性细胞和心脏干/祖细胞。笔者总结近5年干细胞疗法治疗HLHS 的相关临床研究[4,17,23-26],见表 1。

表1 近5年干细胞疗法治疗HLHS的相关临床研究Table 1 Clinical research on stem cell therapy for HLHS in recent 5 years
3.1 间充质干细胞 间充质干细胞是一群位于血管周围区域的异质可塑性细胞,主要通过旁分泌方式分泌促血管生成因子,进而促进血管生成[27]。有动物模型实验证实,间充质干细胞可促进心肌梗死后心脏重塑,改善心功能[28];骨髓来源间充质干细胞治疗成人心力衰竭的成功尝试提示其在HLHS干细胞疗法中有巨大潜力[29-30]。为了证实间充质干细胞治疗HLHS的有效性和安全性,KAUSHAL等[17]开展了ELPIS研究,该研究是将自体骨髓来源间充质干细胞注入10例正在进行二期姑息手术治疗的HLHS患儿心肌内,并评估6个月后的有效性及安全性,结果显示,HLHS患儿右心室可对骨髓来源间充质细胞传递的生物信号做出反应,从而改善右心室功能。另有研究表明,无论是自体还是异体间充质干细胞均未产生免疫排斥反应,且可使心肌梗死面积减少33%,心功能明显改善[31]。但需要注意的是,间充质干细胞治疗HLHS的具体作用机制尚未明确,可能与其促进成熟的心肌细胞分化、减少炎症/瘢痕形成、减少心肌细胞凋亡、促进旁分泌细胞因子及刺激自身心脏祖细胞和心肌球源性细胞增殖有关[31]。
3.2 脐带血来源单核细胞 在临床前研究中,脐带血来源单核细胞主要通过分泌促血管生成因子而改善心功能,此外也可通过衍生间充质干细胞而减轻右心室负荷[32-33]。2015年,BURKHART等[34]报道了首例使用脐带血来源单核细胞治疗的HLHS病例,其成功将自体脐带血来源单核细胞移植到HLHS患儿右心室游离壁,随访3个月后患儿无严重不良事件发生,表明心肌内注射脐带血来源单核细胞安全可行。在此基础上,BURKHART等[4]于2016年12月—2018年9月进行了Ⅱ期临床试验,分别对10例HLHS患儿同时进行了二期姑息治疗和心肌内注射脐带血来源单核细胞,进一步证明了脐带血来源单核细胞治疗HLHS的安全性和可行性,这也为之后的Ⅱb期随访研究建立了基础。另有类似设计的临床研究均证实了脐带血来源单核细胞用于治疗HLHS的安全性和有效性[18,22,34],提示脐带血来源单核细胞可作为一种潜在的安全有效的干细胞药品,但仍需大规模临床研究进一步证实。
3.3 心肌球源性细胞 心肌球源性细胞是由心脏祖细胞发育而来,具有心脏修复和再生功能[35-36]。心肌球源性细胞的心脏再生和修复功能已被一系列研究证实[20,31-32,37-39]。心肌球源性细胞可在小鼠心脏内存活16周[40],可明显减少心肌梗死瘢痕并改善心功能[38,41]。心肌球源性细胞的心脏再生和修复功能也在一定程度上反映了其在HLHS治疗领域的潜力。MAKKAR等[38]于2009年5月—2010年12月开展了CADUCEUS研究,将25例心肌梗死后左心功能不全患者分为向冠状动脉内注射心肌球源性细胞组(试验组)和8例不接受治疗组(对照组),随访6个月证实冠状动脉内注射心肌球源性细胞安全可行,之后的临床试验也进一步证明了心肌球源性细胞具有心脏再生功能[37]。为了证实心肌球源性细胞具有改善或治疗HLHS的能力,ISHIGAMI等[24]开展了PERSEUS研究,该研究是在Ⅰ期临床试验[25]的基础上,将41例HLHS患儿按照1∶1分为为期3个月的心肌球源性细胞早期移植组和晚期移植组,结果证实心肌球源性细胞可改善HLHS患儿心功能,逆转心肌重塑。上述试验所用的心肌球源性细胞均为同体心肌球源性细胞。为了验证异体心肌球源性细胞是否也有此效果,CHAKRAVARTY等[42]开展了ALLSTAR研究,该研究向心肌梗死患者冠状动脉内注射同种异体心肌球源性细胞,拟进行Ⅰ期临床试验及Ⅱ期临床试验(疗效终点分别为1个月和12个月),其中Ⅰ期临床试验初步证明同种异体心肌球源性细胞可改善心功能,且安全可行。但ALLSTAR研究于6个月时(中期)终止,其原因是接受同种异体心球源性细胞的试验组在6个月时并未表现出心功能改善,且认为12个月时出现心功能改善的可能性不大[43]。
3.4 心脏干/祖细胞 心脏干细胞指存在于胚胎和成体的全能干细胞,其也可分化为心肌细胞等,从而改善心功能[31]。另有学者发现,心脏干细胞也可改善心肌纤维化[22]。虽然向心肌、静脉和心外膜内注射心脏干细胞的案例均被报道[44],但其有效性仍存在争议[32,45]。由心脏干细胞分化而来的心脏祖细胞也可改善心功能[32]。虽然有试验证明心脏祖细胞可改善小鼠心肌梗死后心功能[46],但心脏祖细胞几乎无分化为心肌细胞的能力,故目前推测心脏祖细胞治疗HLHS的机制可能与旁分泌有关[47]。
4 小结与展望
干细胞疗法在治疗HLHS的潜在价值逐渐被证实,任何一项对HLHS有效的干细胞疗法均可能具有划时代意义[48]。但由于干细胞疗法的长期效果不佳及其干预机制尚不明确,其在HLHS的应用仍存在争议[49],仍需大规模临床研究进一步证实。
作者贡献:肖宜超进行文章的构思与设计、可行性分析,负责文章的质量控制及审校,并对文章整体负责、监督管理;奉伟庭进行文献/资料收集、整理,并撰写论文。
本文无利益冲突。

