不同疗程布地奈德福莫特罗对咳嗽变异性哮喘患者疗效及辅助性T细胞因子的影响研究
刘威威,苏玉峰,王欢,李敏,吴旭兰,陈晓香
咳嗽变异性哮喘是一种以咳嗽为主要症状但不伴有典型哮喘症状的慢性呼吸道疾病,在全球范围内其发病率高达9.6%,是成人慢性咳嗽的主要原因之一[1]。国内外研究表明,咳嗽变异性哮喘的发生、发展与气道炎症反应所致的气道高反应密切相关,需采用抗哮喘治疗,以改善患者咳嗽症状,防止病情进展为典型哮喘,临床常采用布地奈德福莫特罗吸入治疗该类患者[2-3]。但布地奈德福莫特罗吸入治疗咳嗽变异性哮喘的疗程尚未统一,近年越来越多学者倾向于适当延长布地奈德福莫特罗疗程,如延长至16周或24周,期望在保证安全性的同时,更有效地提高咳嗽变异性哮喘患者的临床疗效[4]。研究表明,辅助性T(helper T,Th)细胞失衡可能是咳嗽变异性哮喘的病理基础,其可导致气道炎症及气道高反应[5]。目前,不同疗程布地奈德福莫特罗对咳嗽变异性哮喘患者疗效的影响鲜有报道。基于此,本研究旨在比较不同疗程布地奈德福莫特罗对咳嗽变异性哮喘患者疗效及Th细胞因子的影响,以期为选择布地奈德福莫特罗吸入最佳治疗疗程提供参考依据。
1 对象与方法
1.1 研究对象 选取2018年8月—2020年3月廊坊市人民医院收治的198例咳嗽变异性哮喘患者作为研究对象,采用随机数字表法分为A组、B组和C组,每组66例。A组中男31例,女35例;年龄22~75岁,平均(38.9±7.8)岁;病程9~59周,平均(15.8±4.6)周。B组中男30例,女36例;年龄21~78岁,平均(41.3±6.5)岁;病程9~68周,平均(17.8±4.0)周。C组中男34例,女32例;年龄23~71岁,平均(41.8±8.7)岁;病程9~72周,平均(16.8±5.4)周。三组患者性别(χ2=0.526,P=0.769)、年龄(F=0.635,P=0.361)及病程(F=0.581,P=0.408)比较,差异无统计学意义。本研究经廊坊市人民医院伦理委员会审核批准〔批准文号:廊医人审(2018)1号〕,患者知悉本研究内容并自愿参加。
1.2 纳入与排除标准 纳入标准:(1)年龄≥18岁;(2)符合《咳嗽的诊断与治疗指南(2015)》[6]中咳嗽变异性哮喘的诊断标准。排除标准:(1)合并其他类型呼吸系统疾病者;(2)近1个月内接受抗感染、免疫调节剂和气管舒张剂治疗者;(3)合并免疫系统疾病、恶性肿瘤者;(4)具有布地奈德福莫特罗吸入治疗禁忌证者。
1.3 治疗方法 三组患者均予以布地奈德福莫特罗(瑞典AstraZeneca AB生产,规格:160 μg/4.5 μg,60吸/支)吸入治疗,1吸/次,2次/d。其中A组患者疗程为8周,B组患者为16周,C组患者为24周。
1.4 观察指标
1.4.1 咳嗽症状 采用咳嗽症状评分和莱斯特咳嗽问卷(Leicester Cough Questionnaire,LCQ)评分评估三组患者治疗前及治疗结束后1 d咳嗽症状,其中咳嗽症状评分包括日间咳嗽症状评分〔分为无咳嗽(0分);偶有咳嗽(1分);频繁咳嗽,轻度影响日常生活(2分);频繁咳嗽,严重影响日常生活(3分)〕和夜间咳嗽症状评分〔分为无咳嗽(0分),入睡时偶有咳嗽(1分),咳嗽轻度影响睡眠质量(2分),咳嗽严重影响睡眠质量(3分)〕[7]。LCQ包括生理、心理和社会3个方面共19个项目,每个项目采取6级评分法,其中一直都是、大部分时间都会、经常会、偶尔会、几乎不会、从来没有分别评为1~7分[8]。
1.4.2 肺功能指标 比较三组患者治疗前及治疗结束后1 d肺功能指标,采用森迪斯肺功能仪检测最大呼气流量占预计值的百分比(PEF%)、第1秒用力呼气容积占预计值的百分比(FEV1%)及用力肺活量占预计值的百分比(FVC%)。
1.4.3 气道激发试验结果 比较三组患者治疗前及治疗结束后1 d气道激发试验结果,以最佳第1秒用力呼气容积(FEV1)为基础对照值,逐步吸入不同剂量磷酸组胺,计算FEV1较基础对照值下降大于20%的最低累积剂量(PD20-FEV1)。
1.4.4 诱导痰炎性递质 比较三组患者治疗前及治疗结束后1 d诱导痰炎性递质,采用酶联免疫吸附试验检测诱导痰白介素(IL)-5、IL-10水平,并计算嗜酸粒细胞百分比(EOS%)。
1.4.5 血清Th细胞因子 比较三组患者治疗前及治疗结束后1 d血清Th细胞因子,抽取患者肘静脉血10 ml,分离血清,采用放射免疫分析法检测血清Th1细胞因子〔IL-2、肿瘤坏死因子α(TNF-α)〕、Th2细胞因子(IL-10)水平,并计算IL-2/IL-10及TNF-α/IL-10。
1.4.6 不良反应 比较三组患者治疗期间不良反应发生率,包括皮疹、头痛、心悸、声嘶、咽部不适等。
1.4.7 结局指标 所有患者随访24周,记录典型支气管哮喘转化率、气道高反应转阴率、复发率。
1.5 统计学方法 采用SPSS 22.0统计学软件进行数据处理。符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用q检验,组内比较采用配对t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Kruskal-Wallis秩和检验;计数资料以相对数表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 咳嗽症状评分和LCQ评分 三组患者治疗前后日间咳嗽症状评分、夜间咳嗽症状评分及LCQ评分比较,差异无统计学意义(P>0.05);治疗后三组患者日间咳嗽症状评分、夜间咳嗽症状评分分别低于本组治疗前,LCQ评分分别高于本组治疗前,差异有统计学意义(P<0.05),见表1。
表1 三组患者治疗前后咳嗽症状评分和LCQ评分比较(±s,分)Table 1 Comparison of cough symptom score and LCQ score among the three groups before and after treatment
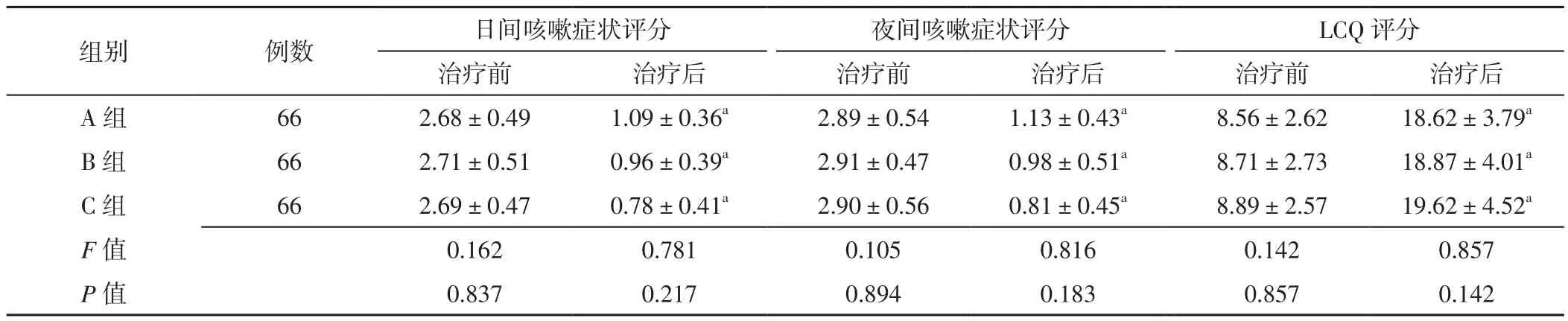
表1 三组患者治疗前后咳嗽症状评分和LCQ评分比较(±s,分)Table 1 Comparison of cough symptom score and LCQ score among the three groups before and after treatment
注:与本组治疗前比较,aP<0.05;LCQ=莱斯特咳嗽问卷
组别 例数 日间咳嗽症状评分 夜间咳嗽症状评分 LCQ评分治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A 组 66 2.68±0.49 1.09±0.36a 2.89±0.54 1.13±0.43a 8.56±2.62 18.62±3.79a B 组 66 2.71±0.51 0.96±0.39a 2.91±0.47 0.98±0.51a 8.71±2.73 18.87±4.01a C 组 66 2.69±0.47 0.78±0.41a 2.90±0.56 0.81±0.45a 8.89±2.57 19.62±4.52a F值 0.162 0.781 0.105 0.816 0.142 0.857 P值 0.837 0.217 0.894 0.183 0.857 0.142
2.2 肺功能指标及PD20-FEV1三组患者治疗前PEF%、FEV1%、FVC%、PD20-FEV1比较,差异无统计学意义(P>0.05);三组患者治疗后PEF%、FEV1%、FVC%、PD20-FEV1比较,差异有统计学意义(P<0.05)。B组和C组患者治疗后PEF%、FEV1%、FVC%及PD20-FEV1高于A组,C组患者治疗后PEF%、FEV1%、FVC%及PD20-FEV1高于B组,差异有统计学意义(P<0.05),见表2。
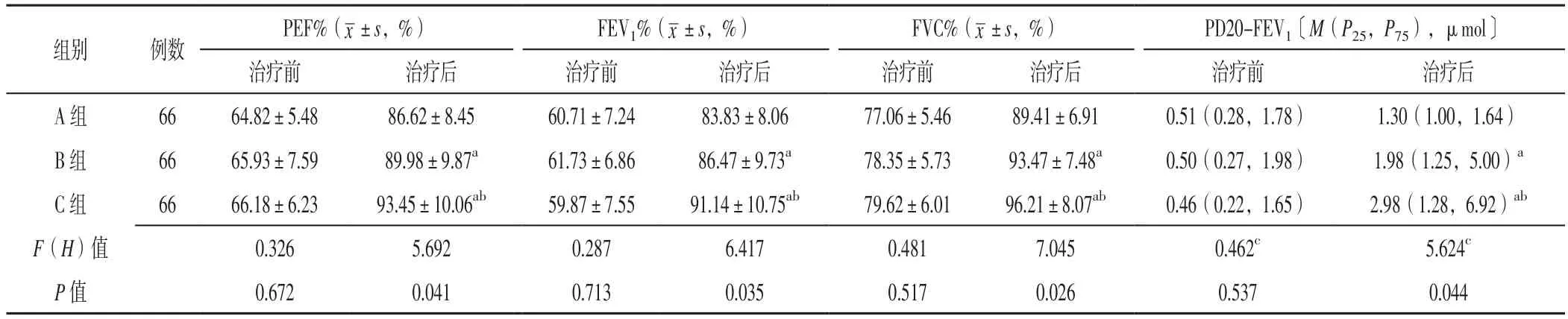
表2 三组患者治疗前后肺功能指标及PD20-FEV1比较Table 2 Comparison of pulmonary function indexes and PD20-FEV1 among the three groups before and after treatment
2.3 诱导痰炎性递质 三组患者治疗前诱导痰IL-5、IL-10水平及EOS%比较,差异无统计学意义(P>0.05);三组患者治疗后诱导痰IL-5、IL-10水平及EOS%比较,差异有统计学意义(P<0.05)。B组和C组患者治疗后诱导痰IL-5水平、EOS%低于A组,C组患者治疗后诱导痰IL-5水平、EOS%低于B组,差异有统计学意义(P<0.05);B组和C组患者治疗后诱导痰IL-10水平高于A组,C组患者治疗后诱导痰IL-10水平高于B组,差异有统计学意义(P<0.05)见表3。
表3 三组患者治疗前后诱导痰炎性递质比较(±s)Table 3 Comparison of induced sputum inflammatory mediators among the three groups before and after treatment

表3 三组患者治疗前后诱导痰炎性递质比较(±s)Table 3 Comparison of induced sputum inflammatory mediators among the three groups before and after treatment
注:与A组比较,aP<0.05;与B组比较,bP<0.05;IL=白介素,EOS%=嗜酸粒细胞百分比
组别 例数 IL-5(ng/L) IL-10(ng/L) EOS%治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A 组 66 142.45±4.45 56.42±4.56 14.62±4.26 29.84±5.82 3.04±0.93 1.23±0.75 B 组 66 140.54±7.51 34.52±3.69a 15.14±3.58 37.41±7.63a 3.62±0.78 0.94±0.51a C 组 66 139.87±6.62 18.84±2.23ab 14.98±3.91 56.42±9.86ab 3.35±0.81 0.45±0.23ab F值 0.246 12.604 0.416 8.724 0.537 4.812 P值 0.754 <0.001 0.583 0.021 0.462 0.048
2.4 血清Th细胞因子 三组患者治疗前血清IL-2、TNF-α、IL-10水平及IL-2/IL-10、TNF-α/IL-10比较,差异无统计学意义(P>0.05);三组患者治疗后血清IL-2、TNF-α、IL-10水平及IL-2/IL-10、TNF-α/IL-10比较,差异有统计学意义(P<0.05)。B组和C组患者治疗后血清IL-2、TNF-α水平及IL-2/IL-10、TNF-α/IL-10低于A组,血清IL-10水平高于A组,差异有统计学意义(P<0.05);C组患者治疗后血清IL-2、TNF-α水平及IL-2/IL-10、TNF-α/IL-10低于B组,血清IL-10水平高于B组,差异有统计学意义(P<0.05),见表4。
表4 三组患者治疗前后血清Th细胞因子比较(±s)Table 4 Comparison of serum Th cytokines among the three groups before and after treatment
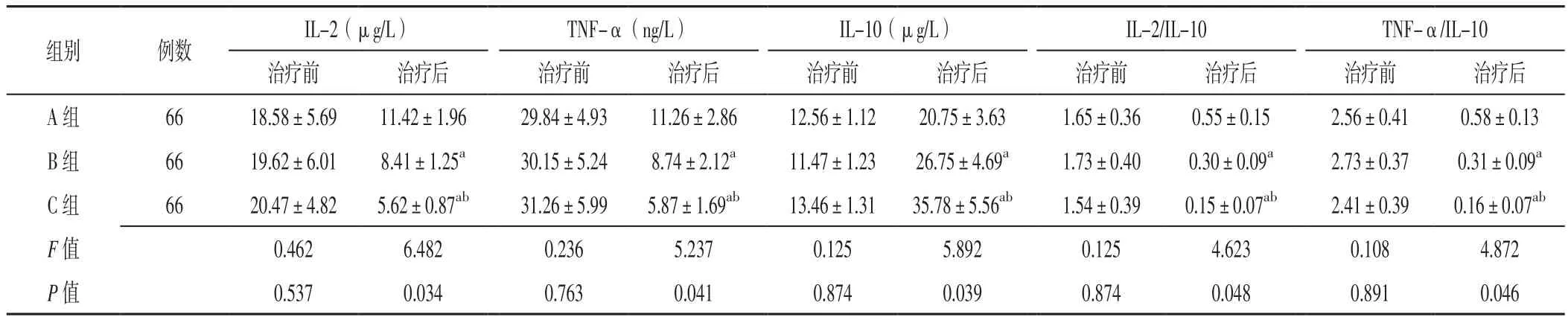
表4 三组患者治疗前后血清Th细胞因子比较(±s)Table 4 Comparison of serum Th cytokines among the three groups before and after treatment
注:与A组比较,aP<0.05;与B组比较,bP<0.05;TNF-α=肿瘤坏死因子α
组别 例数IL-2(μg/L) TNF-α(ng/L) IL-10(μg/L) IL-2/IL-10 TNF-α/IL-10治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A 组 66 18.58±5.69 11.42±1.96 29.84±4.93 11.26±2.86 12.56±1.12 20.75±3.63 1.65±0.36 0.55±0.15 2.56±0.41 0.58±0.13 B组 66 19.62±6.01 8.41±1.25a 30.15±5.24 8.74±2.12a 11.47±1.23 26.75±4.69a 1.73±0.40 0.30±0.09a 2.73±0.37 0.31±0.09a C组 66 20.47±4.82 5.62±0.87ab 31.26±5.99 5.87±1.69ab 13.46±1.31 35.78±5.56ab 1.54±0.39 0.15±0.07ab 2.41±0.39 0.16±0.07ab F值 0.462 6.482 0.236 5.237 0.125 5.892 0.125 4.623 0.108 4.872 P值 0.537 0.034 0.763 0.041 0.874 0.039 0.874 0.048 0.891 0.046
2.5 不良反应发生率及结局指标 三组患者不良反应发生率及典型支气管哮喘转化率比较,差异无统计学意义(P>0.05);三组患者气道高反应转阴率及复发率比较,差异有统计学意义(P<0.05);C组患者气道高反应转阴率高于A组,复发率低于A组,差异有统计学意义(P<0.05),见表5。
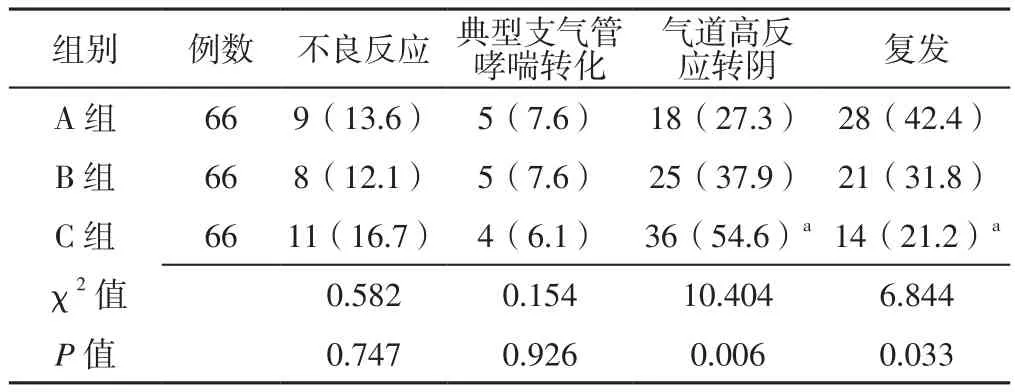
表5 三组患者不良反应发生率及结局指标比较〔n(%)〕Table 5 Comparison of incidence of adverse reactions and outcome indexes among the three groups
3 讨论
咳嗽变异性哮喘被认为是支气管哮喘的早期病变,其病理基础与典型哮喘相似,尤其在气道炎症和平滑肌功能异常方面相对突出。布地奈德福莫特罗是吸入皮质激素和长效β2-受体激动剂的复合剂,其能有效控制咳嗽变异性哮喘患者的临床症状。国内外研究表明,布地奈德福莫特罗在抗炎和舒张支气管平滑肌上具有协同效应,可延缓病情加重[9-10]。目前,国内关于布地奈德福莫特罗治疗咳嗽变异性哮喘的研究多采用8周疗程,且更长疗程的疗效、安全性研究鲜有报道。李桂仙等[11]研究表明,布地奈德福莫特罗吸入治疗咳嗽变异性哮喘患者的疗效与其疗程密切相关,但选择哪种疗程并未明确。笔者在临床实践中发现,咳嗽变异性哮喘患者疗效不佳、复发率高常与布地奈德福莫特罗疗程不足有关。
本研究旨在比较不同疗程布地奈德福莫特罗对咳嗽变异性哮喘患者疗效及Th细胞因子的影响,结果显示,三组患者治疗前后日间咳嗽症状评分、夜间咳嗽症状评分及LCQ评分间差异无统计学意义,提示不同布地奈德福莫特罗吸入治疗疗程对咳嗽变异性哮喘患者咳嗽症状的改善效果相似。SUENAGA等[12]通过对106例咳嗽变异性哮喘患者进行短疗程的布地奈德福莫特罗吸入治疗,发现治疗疗程为8周的患者肺功能、气道高反应和诱导痰炎性递质均无明显改善。赵乌云[13]比较了不同疗程布地奈德福莫特罗吸入治疗咳嗽变异性哮喘患者的疗效,结果显示,随着疗程延长患者病情进一步缓解。基于上述研究,笔者推测延长布地奈德福莫特罗吸入治疗疗程有望增加咳嗽变异性哮喘患者的临床获益。本研究结果显示,B组和C组患者治疗后PEF%、FEV1%、FVC%、PD20-FEV1及诱导痰IL-10水平高于A组,诱导痰IL-5水平、EOS%低于A组;C组患者治疗后PEF%、FEV1%、FVC%、PD20-FEV1及诱导痰IL-10水平高于B组,诱导痰IL-5水平、EOS%低于B组,提示与8周和16周布地奈德福莫特罗吸入治疗疗程相比,24周治疗疗程的咳嗽变异性哮喘患者肺功能、气道高反应及诱导痰炎性递质改善更为明显,与OHATA等[14]研究结果相似。但延长布地奈德福莫特罗吸入治疗疗程能否确保用药安全尚不清楚[15]。本研究结果显示,三组患者不良反应发生率间差异无统计学意义,但C组患者气道高反应转阴率高于A组,复发率低于A组,提示24周疗程的布地奈德福莫特罗吸入治疗咳嗽变异性哮喘患者的临床获益更好。
研究表明,血清IL-2、TNF-α均是参与气道炎症的重要Th细胞因子,IL-10是免疫抑制因子,且血清Th细胞因子失衡是咳嗽变异性哮喘的病理基础[16-17]。徐栋辉等[18]研究表明,布地奈德福莫特罗吸入治疗咳嗽变异性哮喘的主要机制是抑制气道炎症、舒张支气管及降低血清Th细胞因子水平。本研究结果显示,B组和C组患者治疗后血清IL-2、TNF-α水平及IL-2/IL-10、TNF-α/IL-10低于A组,血清IL-10水平高于A组;C组患者治疗后血清IL-2、TNF-α水平及IL-2/IL-10、TNF-α/IL-10低于B组,血清IL-10水平高于B组,提示与8周和16周布地奈德福莫特罗吸入治疗疗程相比,24周治疗疗程能更有效地纠正咳嗽变异性哮喘患者Th细胞因子失衡,分析其原因可能如下:布地奈德福莫特罗具有抗炎和平喘作用,而延长治疗疗程可改善患者免疫功能、减少外周血嗜酸粒细胞(EOS),进而纠正免疫失衡状态[19]。但需要注意的是,在临床实践中仍需根据咳嗽变异性哮喘患者的咳嗽严重程度、基础病史等综合确定布地奈德福莫特罗治疗疗程。
综上所述,与8周和16周布地奈德福莫特罗吸入治疗疗程相比,24周治疗疗程能更有效地减轻咳嗽变异性哮喘患者咳嗽症状、气道炎症,纠正Th细胞因子失衡,进而获得更好的临床获益,且未增加不良反应发生率。但本研究亦存在不足:本研究为单中心研究,随访时间较短,且未分析布地奈德福莫特罗吸入治疗咳嗽变异性哮喘患者的最佳用药剂量,这些均有待进一步研究探讨。
作者贡献:刘威威、苏玉峰进行文章的构思与设计;王欢进行研究的实施与可行性分析;刘威威进行数据收集、整理、分析,撰写论文,并对文章整体负责、监督管理;刘威威、李敏进行结果分析与解释;吴旭兰进行论文的修订;陈晓香负责文章的质量控制及审校。
本文无利益冲突。

