骨科患者创面感染肺炎克雷伯菌耐药性及毒力特性研究
邹 鹏,涂继军,陈治权,杨永超,陈新锋
(1.郑州市第七人民医院骨科,河南 郑州 450000;2.郑州市第七人民医院检验科,河南 郑州 450000)
肺炎克雷伯菌是广泛存在于自然界的一种革兰阴性条件致病菌,可造成院内感染和社区获得性感染,免疫力低下和大量使用抗生素的患者对肺炎克雷伯菌易感[1]。随着抗菌药物广泛使用,肺炎克雷伯菌的耐药性逐年增高,甚至出现一些多重耐药菌和泛耐药菌株[2-3],给临床治疗带来了巨大的挑战。肺炎克雷伯菌的致病性是由于其携带各种毒力因子,这些毒力因子可表达为各种毒力表型,如荚膜(capsule,CPS)、高黏液性(hypermucoviscous,HMV)、脂多糖、黏附素、铁获取系统和生物膜(biofilm,BF)形成能力等。研究表明,携带有不同毒力因子的肺炎克雷伯菌的致病能力不同,引起的临床感染类型也不同[4]。国内外的一些研究已经针对医院不同科室感染的肺炎克雷伯菌的耐药性进行报道[5-6],对不同标本来源的肺炎克雷伯菌的分子特性进行研究[7-8]。然而,目前对于骨科患者创面感染的肺炎克雷伯菌的研究报道较少。因此,本研究对从郑州市第七人民医院骨科创面感染患者分离的肺炎克雷伯菌进行耐药性和毒力特性研究,以期了解骨科患者创面感染的肺炎克雷伯菌的分子特性和致病性,为防控此类细菌感染的传播、流行提供依据。
1 资料与方法
1.1 菌株收集从2017年2月至2019年10月于郑州市第七人民医院骨科住院的创面感染患者分离的32株肺炎克雷伯菌,收集菌株时剔除同一患者相同部位分离的重复菌株,32株肺炎克雷伯菌均经形态染色、生化试验初步鉴定,应用Vitek-AMS 60全自动细菌鉴定系统(法国梅里埃生物公司)进行菌种鉴定后进入后续试验。大肠杆菌ATCC25922、肺炎克雷伯菌ATCC700603、肺炎克雷伯菌ATCC27853质控菌株购自卫生部临床检验中心。
1.2 试剂与仪器营养肉汤干粉、哥伦比亚血琼脂购自青岛海博生物技术有限公司,结晶紫购自美国Sigma公司,无水乙醇购自天津科密欧试剂有限公司,聚合酶链反应(polymerase chain reaction,PCR) mixture、DNA Marker购自宝生物工程(大连)有限公司;生物安全柜购自青岛海尔股份有限公司,隔水式恒温培养箱购自上海跃进医疗器械有限公司,DR100型比浊仪购自法国梅里埃公司,自动立式压力蒸汽灭菌器购自上海博迅医疗生物仪器股份有限公司,PCR仪、凝胶电泳成像仪购自美国 Bio-Rad公司。
1.3 试验方法
1.3.1 药物敏感性试验根据临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI) 推荐的肉汤稀释法[9]测定32株肺炎克雷伯菌对13种常用抗菌药物的敏感性,包括氨苄西林 (ampicillin,AMP)、头孢哌酮(cefoperazone,CFP)、头孢曲松(ceftriaxone,CRO)、头孢他啶(ceftazidime,CAZ)、亚胺培南(imipenem,IPM)、复方磺胺甲噁唑(sulfamethoxazole,SXT)、环丙沙星(ciprofloxacin,CIP)、左氧氟沙星(levofloxacin,LEV)、庆大霉素(gentamicin,GEN)、阿米卡星(amikacin,AMK)、加替沙星(gatifloxacin,GAT)、四环素(tetracyclines,TET)、呋喃妥因(nitrofurantoin,NIT)。具体方法:将13种抗菌药物以灭菌的肉汤培养基倍比稀释成不同的浓度,取100 μL依次加入 96 孔细胞培养板,再将0.5麦氏标准菌悬液按110稀释后每孔加入5 μL,室孔内菌液的最终浓度为 5×108CFU·L-1,将 96 孔板密封,于37 ℃ 下培养 20 h,观察孔中液体的浊度变化,无细菌生长的最小药物浓度即为该药物的最小抑菌浓度 (minimum inhibitory concentration,MIC)。药物敏感性试验结果根据CLSI 2018年版的标准判断结果[9],如果MIC值达到以下标准时即判断为耐药:AMP≥32 mg·L-1、CFP≥64 mg·L-1、CRO≥4 mg·L-1、CAZ≥16 mg·L-1、IPM≥4 mg·L-1、SXT≥4 mg·L-1、CIP≥4 mg·L-1、LEV≥8 mg·L-1、GEN≥16 mg·L-1、AMK≥64 mg·L-1、GAT≥8 mg·L-1、TET≥16 mg·L-1、NIT≥128 mg·L-1,对3种以上药物产生耐药即可认为多重耐药。
1.3.2 菌株毒力表型的测定(1)CPS和黏液表型检测。采用常规Hiss荚膜染色法[10]检测肺炎克雷伯菌是否形成CPS:按照常规方法进行细菌涂片后,在涂片区滴加结晶紫染液1滴,于火焰上加温染色30 s,勿使染液沸腾,然后用硫酸铜溶液冲洗染液,自然干燥后进行镜检,菌体呈紫色,荚膜呈淡紫色。采用“拉丝试验”[11]检查菌株黏液表型:将肺炎克雷伯菌转接至哥伦比亚血平板上,37 ℃培养过夜,用接种环蘸取菌落,将接种环向上提起,若形成的黏丝长度大于0.5 cm则判定为阳性,反之则为阴性。拉丝试验阳性的菌株为HMV表型菌株。(2)BF形成能力测定。参考文献[12]采用96孔板结晶紫染色法测定肺炎克雷伯菌BF形成能力,具体操作步骤为:将在血平板上活化的单菌落接种于LB培养基中,35 ℃、120 r·min-1摇床培养18~20 h,将获得的菌液用LB培养基调至0.5麦氏浊度,按120的比例稀释后加入96孔培养板中。35 ℃恒温静置培养6 h。弃去上层浮游菌,加入 200 μL结晶紫染液,震荡混匀,染色15 min,弃去染液,用无菌水冲掉染液。然后每孔各加 200 μL无水乙醇,使BF均匀悬浮于无水乙醇中,应用酶标仪测定波长590 nm处吸光度值。参考文献[12]标准并结合实验过程中BF染色结果,将吸光度值≥0.200确定为BF形成。根据毒力表型将肺炎克雷伯菌分为4种毒力类型,分别是毒力1型 (virulence phenotype 1,VP1):能形成BF的HMV型;毒力2型 (virulence phenotype 2,VP2):能形成BF型;毒力3型(virulence phenotype 3,VP3):HMV型;毒力4型(virulence phenotype 4,VP4):不能形成BF的非HMV型[12]。
1.3.3 耐药基因及毒力基因的检测采用煮沸法[13]提取32株待测菌的基因组DNA,并以此为模版用PCR法扩增耐药基因和毒力基因,PCR反应体系25 μL,包括10×PCR Buffer 2.5 μL,Mg2+溶液1.5 μL,dNTP Mixture 2.5 μL,上、下游引物(10 μmol·L-1)各0.5 μL,rTaq酶(5×106U·L-1)0.1 μL,无菌水15.4 μL,DNA模板 2.0 μL;PCR扩增条件为94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共25个循环,最后72 ℃延伸10 min。耐药基因包括编码超广谱β内酰胺(extended-spectrum β-lactamase,ESBLs)酶的基因(blaCTX-M、blaTEM、blaSHV)、碳青霉烯酶基因(blaKPC、blaNDM、blaOXA-48)、喹诺酮类耐药基因(qnrA、qnrB、gyrA);毒力基因包括编码荚膜多糖基因(magA)、黏附素基因(fimH-1、markD)、肠毒素基因(entB)、黏液表型相关基因(rmpA)、铁载蛋白基因(iroNB)。blaCTX-M上游引物:5′-AAAAATCACTGCGTCAGTTCAC-3′,下游引物:5′-AAAAATCACTGCGTCAGTTCAC-3′,长度867 bp;blaTEM上游引物:5′-CAGAAACGCTGGTGAAAG-3′,下游引物:5′-AACTACGATACGGGAGGG-3,长度1 183 bp;blaSHV上游引物:5′-GGTTATGCGTTATATTCGCC-3′,下游引物:5′-TTAGCGTTGCCAGTGCTC-3′,长度865 bp;blaKPC上游引物:5′-GCTACACCTAGCTCCACCTTC-3′,下游引物:5′-CTCCCTAACCCGCAGTTG-3′,长度912 bp;blaNDM上游引物:5′-GGTTTGGCGATCTGGTTTTC-3′,下游引物:5′-CGGAATGGCTCACGATC-3′,长度621 bp;blaOXA-48上游引物:5′-TTGGTGGCATCGATTATCGG-3′,下游引物:5′-GAGCACTTCTTTTGTGATGGC-3′,长度744 bp;qnrA上游引物:5′-TTCAGCAAGAGGATTTCTCA-3′,下游引物:5′-GGCAGC ACTATTACTCCCAA-3′,长度641 bp;qnrB上游引物:5′-CCTGAGCGGCACTGAATTTAT-3′,下游引物:5′-GTTTGCTGCTCGCCAGTCGA-3′,长度409 bp;gyrA上游引物:5′-AAATCTGCCCGTGTCGTTGGT-3′,下游引物:5′-AAATCTGCCCGTGTCGTTGGT-3′,长度744 bp;magA上游引物:5′-GGTG CTCTTTACATCATTGC-3′,下游引物:5′-GCAATGGCCATTTGCGTTAG-3′,长度1 283 bp;entB上游引物:5′-ATTTCCTCAACTTCTGGGGC-3′,下游引物:5′- AGCATCGGTGGCGGTGGTCA-3′,长度371 bp;rmpA上游引物:5′-ACTGGGCTACCTCTGCTTCA-3′,下游引物:5′-CTTGCATGAGCCATC TTTCA-3′,长度516 bp;iroNB上游引物:5′-GGCTACTGATACTTGACTATTC-3′,下游引物:5′-CAGGATACAATAGCCCATAG-3′,长度992 bp;fimH-1上游引物:5′-GCTCTGGCCGATACCACCACGG-3′,下游引物:5′-GCGAAGTAACGCGCCTGGAACGG-3′,长度423 bp;markD上游引物:5′-CGGTAAAGTTACCGACGTATCTTGTACTG-3′,下游引物:5′-GCTGTTAACCACACCGGTGGTAAC-3′,长度498 bp。引物由生工生物(上海)股份有限公司合成。
2 结果
2.1 32株肺炎克雷伯菌药物敏感性试验结果结果见表1。AMP的MIC≥32.00 mg·L-1有26株,CFP、AMK的MIC≥64.00 mg·L-1分别有20株和8株,CRO、IPM、CIP、SXT的MIC≥4.00 mg·L-1分别有24株、2株、19株和14株,CAZ、GEN和TET的MIC≥16.00 mg·L-1分别有16株、11株和11株;LEV和GAT耐药折点是8.00 mg·L-1,分别有12株和3株;NIT的MIC≥128.00 mg·L-1有7株。32株肺炎克雷伯菌对13种药物的耐药率为6.25%~81.25%,其中对AMP的耐药率最高,为81.25%;其次是CRO和CFP,分别为75.00%和62.50%;在喹诺酮类药物中,对CIP的耐药率最高,为 59.38%,对第4代喹诺酮类耐药率最低为9.38%,仅有2株(6.25%)对IPM产生耐药。
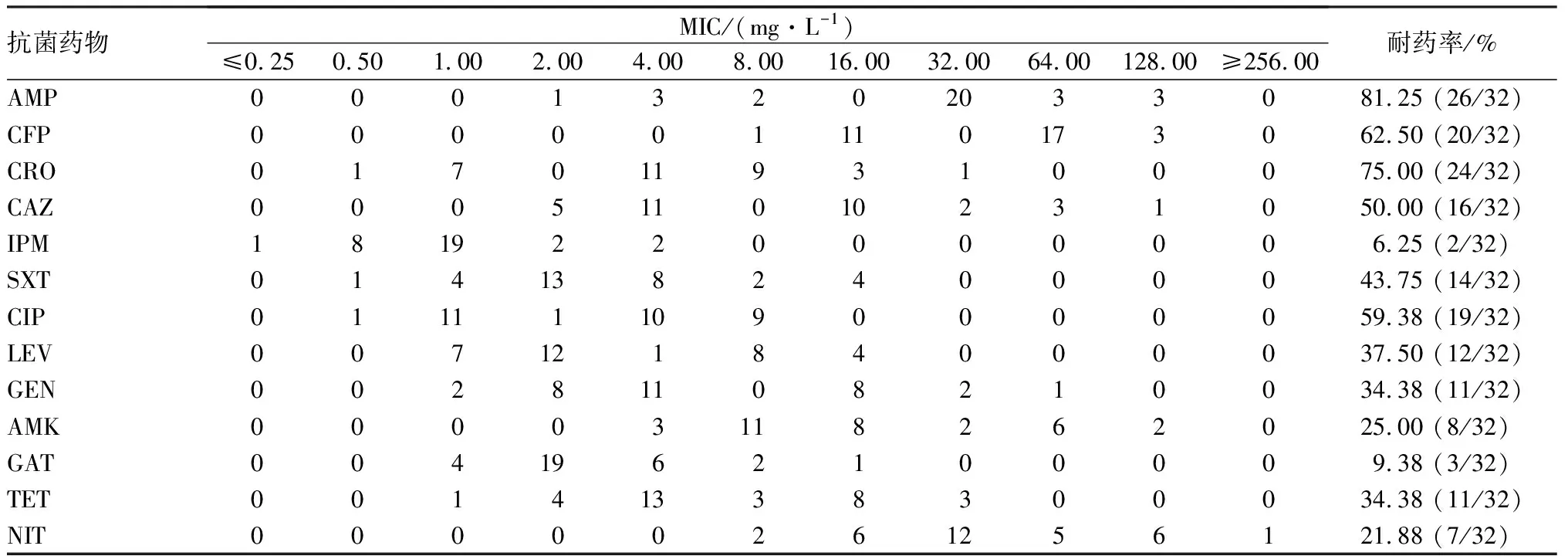
表1 32株肺炎克雷伯菌对13种抗菌药物的MIC值
2.2 32株肺炎克雷伯菌的毒力表型及毒力基因32株肺炎克雷伯菌均能形成CPS,其中21株(65.63%)能形成BF,12株(37.50%)产生HMV。32株肺炎克雷伯菌均携带有编码Ⅰ型菌毛的fimH-1基因,31株(96.88%)携带有编码肠毒素基因entB,30株(93.75%)携带有编码Ⅲ型菌毛基因markD,7株(21.88%)携带有编码黏蛋白调控基因rmpA,6株(18.75%)携带有iroNB基因,3株(9.38%)携带有magA基因。
2.3 毒力表型及耐药性、耐药基因的相关性结果见表2。32株肺炎克雷伯菌中,9株(28.13%)属于VP1型,均为多重耐药,对AMP、CFP、CRO、CAZ、AMK等耐药,携带的耐药基因主要有blaCTX-M、blaSHV、blaKPC、gyrA、qnrA基因,其中1株为blaOXA-48型;VP2型有12株(占37.50%),其中多重耐药菌有9株(82.33%),携带的耐药基因主要为blaCTX-M、blaKPC、gyrA,3株携带qnrA、gyrA基因的菌株仅对CIP、LEV耐药;8株VP4菌株中5株为多重耐药菌,携带的耐药基因为blaCTX-M、blaTEM、blaKPC、qnrA、gyrA,其中1株为blaOXA-48。32株肺炎克雷伯菌中,75.0%(24/32)携带blakPC基因,均为多重耐药。
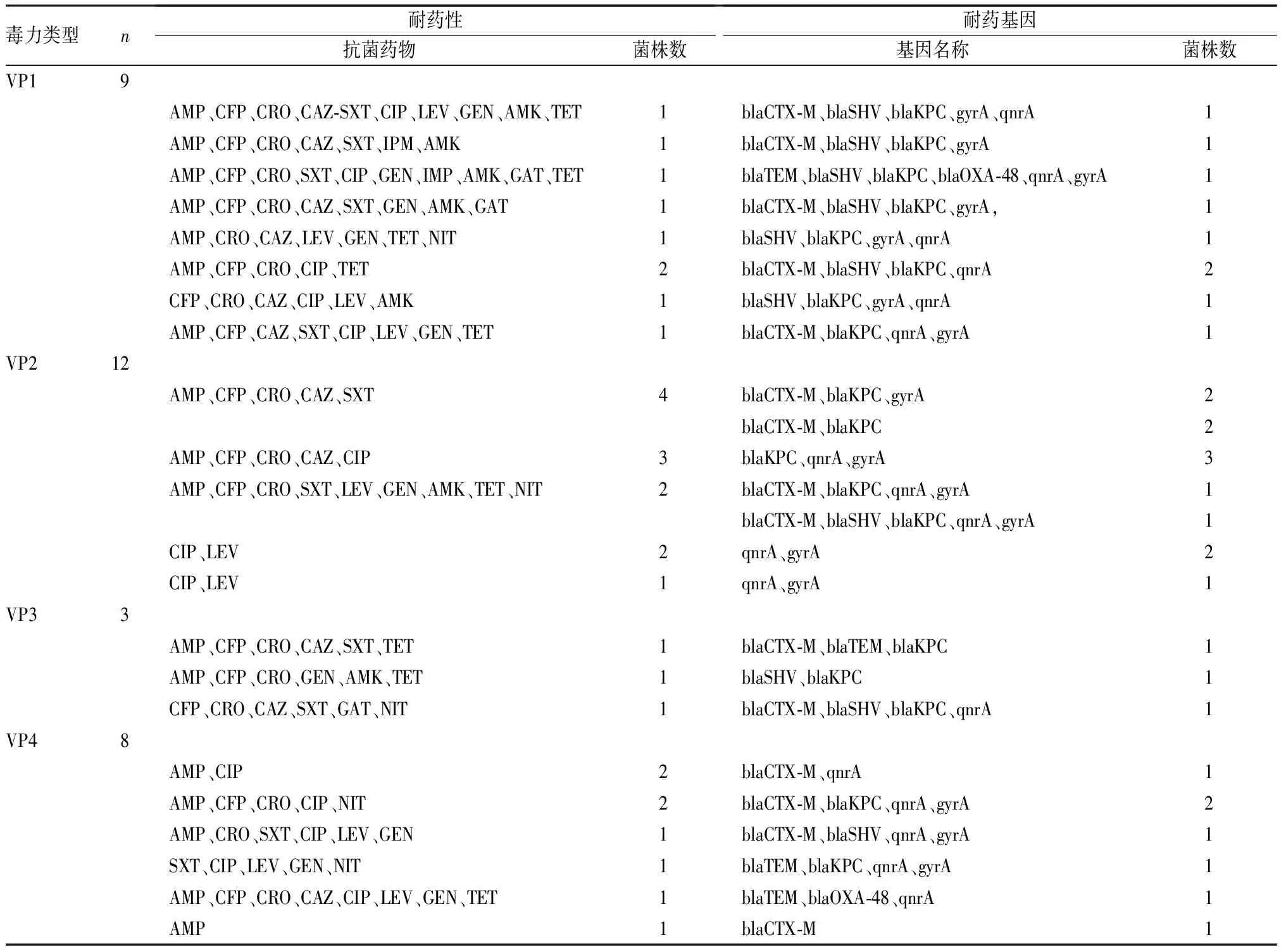
表2 32株肺炎克雷伯菌的毒力类型及耐药性分布
3 讨论
近年来,从临床患者分离的肺炎克雷伯菌数呈增高趋势,感染的标本来源科室以重症监护室为最多,其次是呼吸科和血液科[14]。目前,对骨科患者分离的肺炎克雷伯菌的耐药性的研究报道较少且结果不尽相同。王学志等[15]对224例骨科伤口感染病原进行分析,结果发现,肺炎克雷伯菌对AMP的耐药率最高;游明园等[16]研究报道,骨科患者分离的肺炎克雷伯菌对部分头孢类抗菌药物耐药率超过90%。本研究32株肺炎克雷伯菌对AMP的耐药率最高,达到81.25%;对其他头孢类抗生素的耐药率也均超过50.00%。本研究结果与王学志等[15]和游明园等[16]研究结果相似,说明从骨科患者分离的肺炎克雷伯菌对头孢类抗生素的耐药率较高。但张令博等[17]研究报道,骨科患者分离的肺炎克雷伯菌对头孢类抗生素的耐药率低于10%,这与本研究不一致。这种肺炎克雷伯菌对头孢类抗生素耐药率不同的原因可能是不同地区流行的肺炎克雷伯菌的分子特性不同,也可能与本地区医院使用抗生素习惯有关。
肺炎克雷伯菌主要致病因子包括CPS、产生黏液性、形成BF等,研究表明,编码这些毒力特性的毒力因子种类很多,包括Khe、magA、wzy、rmpA、allS、kfuBC、ybtA、iucB、iroNB、fimH-1、ureA、uge、wabG及markA等[8]。目前,针对骨科患者分离的肺炎克雷伯菌的分子特性尤其是毒力类型的研究尚未见报道。因此,本研究选择6种毒力基因进行扩增,结果表明,fimH-1和markD基因的携带率分别为100.00%和93.75%。fimH-1和markD基因主要编码Ⅰ型菌门和Ⅲ型菌毛,I型菌毛利用其顶端的黏附素结合到宿主上皮细胞的糖蛋白上,介导细菌侵入到细胞内;Ⅲ型菌毛能牢固地黏附于机体黏膜上皮细胞,从而促使BF的形成。entB编码肠毒素,肠毒素可与血浆载体蛋白中的铁结合,促进细菌生长,当entB基因表达上调时,能使细菌内环境铁元素增加,从而促进BF的形成[18]。本研究32株肺炎克雷伯菌entB基因的携带率为96.88%,这与WALKER等[19]研究报道一致。一般认为HMV菌株为高毒力菌株,在本研究中, 12株(37.5%)表现为HMV表型,而表达黏液表型的基因rmpA和magA的携带率分别为21.88%和9.38%,说明HMV表型肺炎克雷伯菌可同时携带rmpA和magA基因。YANG等[20]对不同来源的肺炎克雷伯菌分子特性研究发现,携带有magA、rmpA毒力基因的菌株表型不一定表现出高黏液特征。推测可能还有其他因素参与了肺炎克雷伯菌HMV表型的形成,这有待进一步研究。
本研究结果还显示,9株VP1型肺炎克雷伯菌均为多重耐药菌,且大部分对AMP、CFP、CAZ、AMK耐药;VP2型肺炎克雷伯菌的多重耐药率为83.33%。推测这种高多重耐药率可能与细菌BF形成能力有关。有研究显示,BF可通过物理屏障阻止药物作用于BF内的肺炎克雷伯菌,从而提高肺炎克雷伯菌的耐药性[21],这可能也是导致临床上肺炎克雷伯菌感染率升高的原因之一。研究表明,超广谱β-内酰胺酶是肺炎克雷伯菌对β-内酰胺类抗菌药物耐药的重要机制,产ESBLs菌株多呈多重耐药[22],而此多重耐药是由质粒携带的多种耐药基因介导。本研究32株肺炎克雷伯菌携带的耐药基因主要为blaCTX-M、blaSHV、blaKPC、gyrA、qnrA,表明本院流行的产ESBLs菌株多为CTX-M型。碳青霉烯类药物被认为是人类抗感染性治疗的最后一道防线,然而关于耐碳青霉烯类肺炎克雷伯菌感染的报道逐渐增多,尤其产碳青霉烯酶(Klebsiella pneumoniae carbapenemase,KPC)被认为是目前引起肺炎克雷伯菌对碳青霉烯类抗菌药物耐药的主要原因[23]。本研究结果显示,75.0%的菌株携带有blaKPC基因,且这些菌株均为多重耐药菌;这与BASSETTI等[24]研究结果一致。喹诺酮类药物主要作用于DNA旋转酶和拓扑异构酶IV,这2种酶对细菌的生长和增殖起关键作用。研究表明,肺炎克雷伯菌gyrA基因突变可导致酶的结构和构象发生变化,阻止DNA的复制、转录及其他功能,从而引起耐药[25]。此外,qnrA阳性细菌在经过氟喹诺酮药物治疗后可促进细菌体内染色体介导的喹诺酮耐药基因发生突变[26]。本研究32株肺炎克雷伯菌中普遍存在gyrA、qnrA 基因,而这2个基因极易发生突变;因此,推测肺炎克雷伯菌对喹诺酮耐药的主要机制是由基因突变引起,但还有待进一步进行研究。
综上所述,从本院骨科创面感染患者分离的肺炎克雷伯菌对多种抗菌药物的耐药率较高,其中对AMP、头孢菌素的耐药率最高;HMV且能形成BF的肺炎克雷伯菌均为多重耐药菌;携带不同耐药基因的肺炎克雷伯菌的耐药性不同。因此,在临床上治疗骨科患者创面感染的肺炎克雷伯菌应选择敏感药物。由于本研究的样本量有限,今后还需扩大样本量进行研究,以进一步确定本地区骨科患者创面感染的肺炎克雷伯菌的耐药性和毒力特性,并加强分子流行病学的监测,从而制定合理的用药措施来减少该类菌株的流行。

