胃肠道线虫感染对宿主羊蛋白质利用和分配的影响研究进展
向 海 钟荣珍
(1.中国科学院东北地理与农业生态研究所,吉林省草地畜牧重点实验室,长春130102; 2.中国科学院大学现代农业科学学院,北京100049)
反刍家畜,主要包括牛、绵羊和山羊,对全球的粮食与经济作出了重大贡献,特别是对中低收入的国家而言[1]。胃肠道线虫(gastrointestinal nematode,GIN)感染是导致反刍家畜生产力下降的重要因素[2]。Charlier等[3]调查了18个欧洲国家的反刍家畜每年因寄生虫感染而付出的经济代价,其中法国因寄生虫感染造成的年经济损失高达4.4亿欧元。中国目前尚无此类数据统计。反刍动物(牛、绵羊和山羊)中常见的GIN见表1[4],其中毛圆科血矛属捻转血矛线虫(Haemonchuscontortus)是感染反刍动物的最主要的GIN之一,它主要寄生在反刍动物皱胃和小肠,以皱胃为主[5]。Haemonchuscontortus生活周期包括体外自由生活和体内寄生生活2个阶段,其虫卵经过5次蜕皮成为成虫,绵羊通过摄取具有感染性的L3期幼虫而被感染,L3期幼虫被宿主动物摄食,在宿主皱胃中发育成L4期幼虫后成为成虫,然后形成吸血习性,导致宿主严重贫血并伴随采食量下降、生产力下降、营养物质代谢改变,甚至死亡[6]。
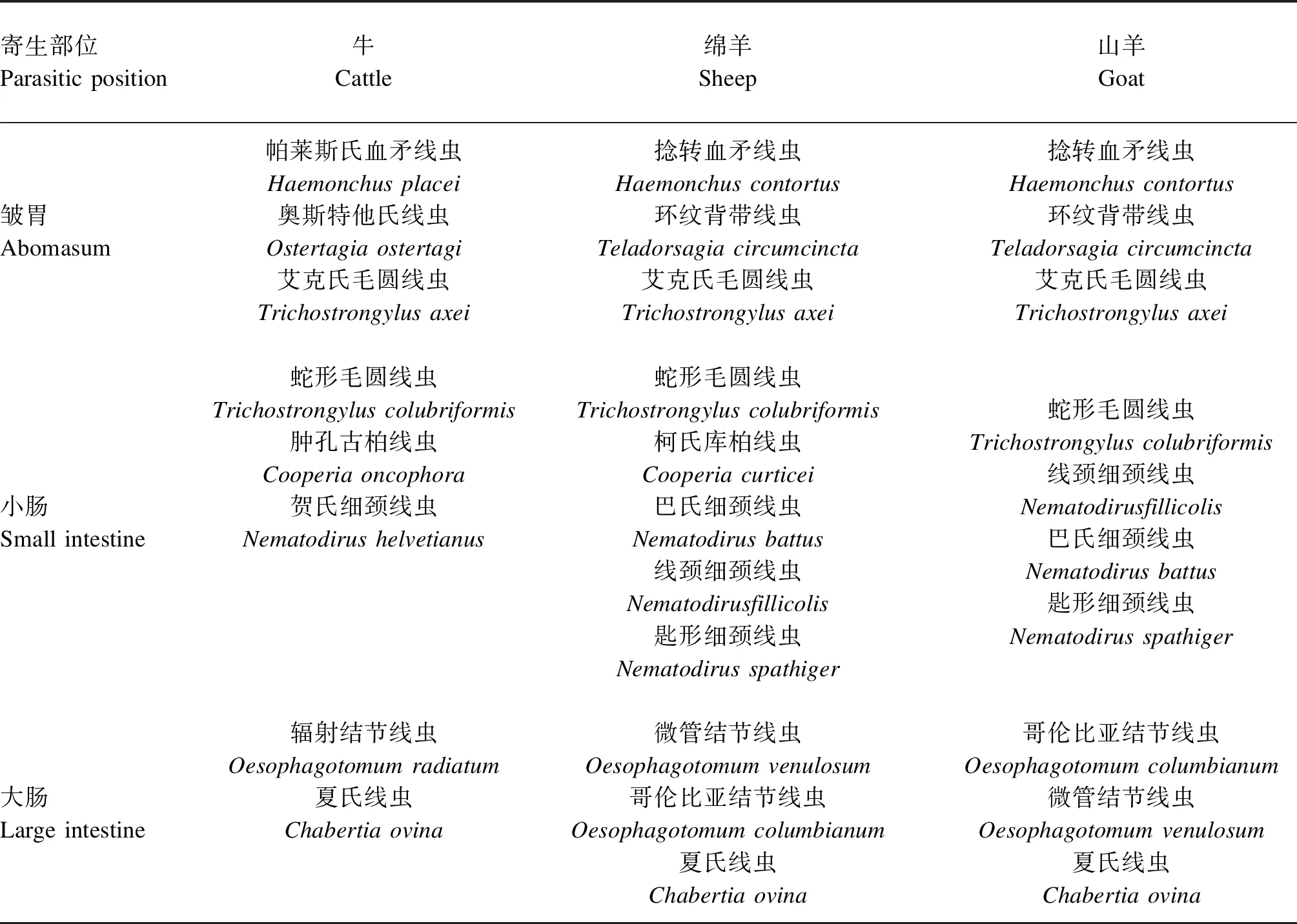
表1 反刍动物(牛、绵羊和山羊)中常见的胃肠道线虫
在GIN感染期间观察到的动物生产力下降的主要原因是,机体组织内的营养利用和分配发生了明显变化:寄生宿主采食量明显减少,同时机体用于宿主自身生产组织(如骨骼肌)的蛋白质(氨基酸)数量减少,而用于修复受损组织和启动免疫反应所需的蛋白质(氨基酸)数量明显增加,进而导致宿主全身的蛋白质(氨基酸)代谢发生相应变化[7]。
1 GIN感染改变宿主羊采食行为
GIN感染对宿主的首要影响是造成宿主采食量下降,出现厌食的现象。厌食症已经在许多寄生宿主上被发现,如小鼠[8]、驯鹿[9]以及绵羊[10-11],其中绵羊的采食量下降30%~60%[12]。厌食症也许可以被理解为一种宿主对寄生线虫的适应性行为:当宿主感染GIN时,宿主会适当增加含有抵抗GIN的活性成分的物质的摄入,并减少对GIN生长有利的物质的摄入[13]。另外,当宿主可以在不同营养水平的食物中进行选择时,它们会选择质量更好的食物来弥补因GIN定植发育而损失的营养,如高蛋白质饲粮[14]。同时,宿主也倾向于采食更有利于驱除寄生虫而提高自身对寄生虫抗性的饲粮[15-16]。
这种由GIN导致宿主的厌食症可能是通过改变胃肠激素水平进行调节的,其中血清胃泌素水平升高和自愿采食量减少之间有很强的联系[17]。Fox等[18]的研究初步证实了血清胃泌素水平升高与采食量降低之间的关系,当使用胃酸分泌抑制剂奥美拉唑(omeprazole)间接提高内源性血清胃泌素水平时,未感染的动物的食欲下降了40%,其值与感染动物相当。GIN感染时,宿主往往伴有明显的高胃泌素血症,因此这种胃黏膜破损而导致反刍动物血清胃泌素水平升高的现象,可作为GIN感染亚临床疾病的诊断工具[19]。
与胃泌素相互作用并调节宿主厌食症的潜在神经内分泌递质包括胃促生长素和瘦素。胃促生长素的分泌受到胃泌素的抑制,胃促生长素可以穿过血脑屏障并与大脑中的受体结合,导致下丘脑中的神经元细胞分泌的一种强有力的饲料摄取刺激物神经肽Y;另外,血清胃泌素水平的升高可能通过上调瘦素的合成,导致血清瘦素水平增加,从而降低神经肽Y的合成[20]。宿主对外来的GIN作出相应的抵御行为促进胃泌素增加后,GIN为保证自身生活环境更加适宜,会产生相应的GIN的排泄/分泌(excretory-secretory,ES)产物去抑制宿主胃泌素的产生,进而提高宿主胃内pH,保证自生生活环境有利于生存和繁殖[21]。
2 GIN感染导致宿主羊营养分配改变
2.1 用于宿主羊维持生长性能的营养减少
在GIN感染期间,由于采食量的减少,宿主羊必然不能通过增加对饲粮中蛋白质摄取来满足机体营养需求,这表明宿主羊机体内的蛋白质在GIN感染期间被重新调动与分配。目前研究已确定GIN可以损害宿主羊活重增加、软组织沉积、骨骼生长、乳制品和羊毛生产,以满足机体其他组织的蛋白质需求[22]。Yu等[23]指出,感染蛇形毛圆线虫(Trichostrongyluscolubriformis)的羔羊增加了胃肠道内氨基酸氧化和蛋白质周转,并导致生产组织中(骨骼肌)氨基酸减少。宿主不仅存在骨骼肌蛋白质合成的减少,往往也伴随着骨骼肌蛋白质降解的增加,更多的氨基酸从骨骼肌中释放出来[24],以满足宿主组织修复以及免疫反应的蛋白质需求,减少了肌肉和皮肤等生产组织的蛋白质需求[24-26],最终结果为宿主全身蛋白质和氨基酸的代谢发生改变。
2.2 用于宿主羊胃肠道物理屏障修复的营养增加
宿主胃肠道代谢率较高,这主要是由于小肠内蛋白质合成率高,能量消耗高,这些代谢活动占宿主全身蛋白质代谢和能量消耗的20%~50%[27]。因此,改变胃肠道形态和功能的因素,如GIN感染,可能对宿主组织的营养(蛋白质)利用率产生巨大影响。
宿主感染GIN后胃肠道黏膜受损主要表现在以下2个方面:一方面,宿主胃肠道组织形态学改变。胃肠道组织受损的实质是线虫能利用其发达的口囊牢固地吸附在宿主的消化道肠壁上,并分泌消化酶于宿主的胃肠绒毛组织上,使组织变性溶解为营养液供自身定植发育,从而导致定植部位局部组织病变[28]。胃肠道组织受损的后果可能是继发感染、败血症和细菌易位,这可能导致宿主的全身炎症。在感染Trichostrongyluscolubriformis的绵羊中,主要寄生部位以外的肠道位点也出现了黏膜增厚、黏膜上皮增生、黏膜肌层以及脑膜下层大量嗜酸性粒细胞浸润的现象[29]。另外,在寄生虫的易感部位通常可以观察到隐窝细胞增殖速率增加的现象,但这种反应似乎不足以弥补由于寄生虫的存在而导致的绒毛细胞死亡率的增加。另一方面,宿主胃肠道生化环境发生改变。GIN感染直接导致宿主胃肠道黏膜严重受损,特别是皱胃。宿主皱胃的产酸壁细胞被L4期线虫严重破坏,盐酸分泌量减少,导致皱胃内pH升高。同时,GIN为避免胃酸或胃蛋白酶对其表皮的作用而释放大量胺类物质,使得宿主皱胃内pH升高,阻止了宿主胃肠道中胃蛋白酶原向胃蛋白酶的转化,蛋白质消化受到抑制,氨基酸和小肽吸收受阻,炎症现象产生,导致宿主消化不良,出现消瘦、体腔内水肿以及局部淋巴结肥大等临床症状[30]。
随着胃肠道组织受损,GIN吸血能力加强。Haemonchuscontortus是绵羊和山羊的一种高致病性吸血性线虫,Haemonchuscontortus成虫吸血可导致宿主严重贫血、生产性能下降,甚至死亡。在亚临床感染中,贫血主要是由L4期幼虫和成虫导致,1条Haemonchuscontortus成虫每天可以吸取宿主0.05 mL的血液,如果1只绵羊感染5 000条Haemonchuscontortus,每天可能会失去约250 mL血液,约占绵羊全身血液的5%[28]。GIN以宿主血红蛋白作为氨基酸的主要来源[31],感染羊与未感染羊的血液血红蛋白含量存在显著差异[32]。GIN释放的ES产物,含有多种蛋白酶,能促进自身入侵宿主组织,消化宿主血液和组织,其作用机制为宿主血红蛋白首先被天冬氨酸蛋白酶攻击,然后被半胱氨酸蛋白酶和金属蛋白酶降解为更小的小肽,最后,GIN外肽酶进一步对这些小肽进行消化[31]。
由GIN感染导致胃肠道发生上述变化对宿主蛋白质和氨基酸代谢的影响可能是由于感染导致的宿主黏膜受损使得宿主部分饲粮蛋白质被机体用以修复受损的黏膜。Bermingham等[33]报道,感染Trichostrongyluscolubriformis羊的十二指肠、回肠平滑肌和肠系膜淋巴结的蛋白质分数合成率(fractional synthesis rate,FSR,即通过将同位素直接掺入组织蛋白质中测量,表示单位时间内某种标记氨基酸掺入蛋白质的比率)[25]增加,表明每天有更多的组织蛋白质在胃肠道和淋巴结被重新合成,十二指肠组织完整性的重建可能是十二指肠平滑肌FSR增加的原因,而一般免疫反应的启动可能是回肠平滑肌和淋巴结FSR增加的原因。这些被重新分配到胃肠道的氨基酸可能主要参与了受损黏膜的修复,而非用于宿主机体蛋白质的合成[34]。
2.3 用于宿主羊胃肠道化学屏障建立的营养增加
GIN感染引起的胃肠道菌群改变是宿主免疫反应的一部分,这可能是一种适应性机制,免疫系统需要大量的特定营养物质,特别是在感染期间,许多调控因子被激活来调节这一生物学过程。大量试验证据表明,GIN感染主要诱导宿主Th2型细胞介导的免疫反应,但其诱导机制尚不明确[35]。胃肠道上皮细胞(intestinal epithelial cells,IECs)不仅仅是宿主营养吸收的细胞,而且在宿主的免疫反应中也发挥重要作用。IECs通过释放典型的细胞因子,如胸腺基质淋巴生成素(thymic stromal lymphopoietin,TSLP)、白细胞介素(interleukin,IL)-33和IL-25,在启动寄生虫诱导的Th2型免疫中发挥重要作用。TSLP信号在对寄生虫的排斥反应中起关键作用;IL-33作为一种警报蛋白,能诱导Th2型细胞、嗜碱性细胞、肥大细胞、巨噬细胞和2型先天淋巴细胞(group 2 innate lymphoid cells,ILC2s)分泌2型细胞因子驱除寄生虫;IL-25通过激活ILC2s在诱导保护性Th2型免疫反应中发挥关键作用[36]。Th2型淋巴细胞协调分泌主要细胞因子IL-4、IL-5、IL-9和IL-13的体液免疫反应,导致B细胞产生不同亚型的免疫球蛋白(immunoglobulin,Ig)——IgA、IgE和IgG,IgA和IgE水平增加是蠕虫感染的局部黏膜最显著的特征,而IgG主要在感染动物的血清中检测到[37]。另外,还存在嗜碱性粒细胞、嗜酸性粒细胞、巨噬细胞、肥大细胞的扩张和活化以及杯状细胞增生的现象[38]。与GIN相关的免疫细胞因子的作用如图1所示。
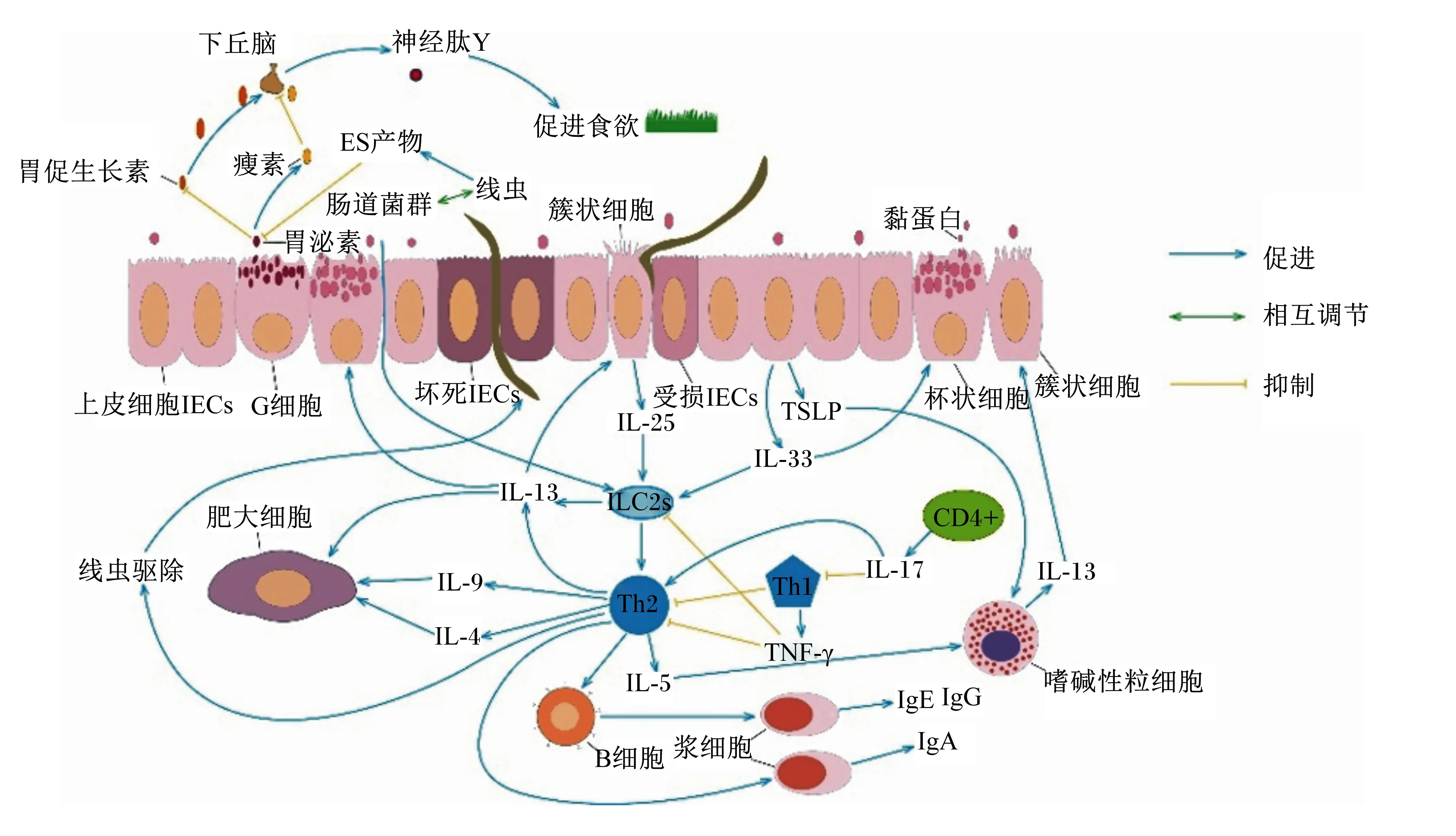
IECs:胃肠道上皮细胞 intestinal epithelial cells;ILC2s:2型先天淋巴细胞 group 2 innate lymphoid cells;TSLP:胸腺基质淋巴生成素 thymic stromal lymphopoietin;ES:排泄/分泌excretory/secretory;IL:白细胞介素 interleukin;Ig:免疫球蛋白 immunoglobulin;TNF-γ:肿瘤坏死因子-γ tumor necrosis factor-γ。
越来越多的研究表明Th2型免疫在宿主-寄生虫-微生物群相互作用中发挥了重要作用。近期研究表明,寄生虫诱导的Th2型免疫应答在蠕虫相关的肠道菌群的定性和定量修饰中发挥关键作用,因为这种修饰在Th2型细胞因子缺失小鼠中没有观察到,给未感染的小鼠注射Th2型细胞因子会导致与蠕虫感染小鼠相似的微生物表型,从而说明Th2型免疫在宿主-寄生虫-微生物群相互作用中发挥了重要作用[39-40]。由簇状细胞分泌的IL-25在抗寄生虫免疫和维持肠道内免疫稳态中发挥关键作用,它可能是宿主-寄生虫-微生物区系相互作用的关键中介[41]。胃肠道微生物群可能提供了这些信号使胃肠道的IL-25表达增加[42],味觉化学感觉通路将微生物信号传导到细胞,特别是胃肠道中的簇状细胞[43]。
3 GIN感染导致宿主羊蛋白质代谢改变
3.1 宿主羊胃肠道微生物蛋白质代谢改变
胃肠道微生物代谢在宿主营养和代谢中起着至关重要的作用。关于GIN感染和宿主微生物群落变化之间的因果关系,有3个主要的假说:1)宿主对线虫感染产生免疫反应导致宿主微生物菌群变化;2)由宿主驱动,试图为线虫创造一个敌对的环境而导致宿主微生物菌群的变化;3)微生物与线虫ES产物直接相互作用而导致宿主微生物菌群变化[44],这些过程直接改变了胃肠道菌群各群落的生态位。虽然山羊感染寄生虫似乎没有影响皱胃感染部位的微生物多样性,但它确实导致皱胃微生物组成发生重大改变,所有物种水平19%的操作分类单元(operational taxonomic unit,OTU)的丰度发生改变[45]。同时,在感染了Ostertagiacircumcincta的绵羊中也观察到厌氧细菌密度的变化[46]。这些变化可能与微生物栖息地的pH升高有关,随着管腔pH的升高宿主皱胃中活菌总数增加了2~3个级次[47]。升高的pH促使耐酸菌种增殖,如牛链球菌(Streptococcusbovis),它已被证明能产生一种抑制绵羊细胞分泌胃泌素的抑制剂[17]。另外,微生物菌群的变化也可能是由于GIN分泌具有抗菌活性的ES产物[48]或是宿主免疫反应所介导的改变[39-40,49],但其中的机制尚不清楚。
被感染的宿主羊蛋白质代谢明显改变,这可能是由于胃肠道微生物结构与组成发生改变,但微生物群代谢变化和宿主代谢的变化是由微生物群与线虫的直接相互作用引起的,还是间接由对线虫感染的黏膜免疫变化引起的仍有待确定。其中,普雷沃氏菌属(Prevotella)在感染线虫的山羊皱胃中变化显著,平均丰度由16.65%增加到25.35%[45]。反刍动物胃肠道是蛋白酶(肽酶)最丰富的来源,蛋白质的降解受微生物控制,且受到肠道内pH的强烈影响。Prevotella是反刍动物瘤胃和后肠中最丰富的菌属之一,在瘤胃蛋白质降解过程中起着至关重要的作用,特别是在寡肽分解过程中,因为其具有限速型四肽酶活性,主要作用于蛋白质和碳水化合物的分解[50]。宿主皱胃中Prevotella丰度的增加可能代表一种代偿机制,以抵消线虫感染导致的宿主蛋白质损失[51]。
除了Prevotella以外,其他菌属丰富度也有所改变。例如,在感染了Haemonchuscontortus的山羊皱胃中具有抗炎功能的毛螺旋菌属(Lachnospiraceae)和丁酸弧菌属(Butyrivibrio)的数量减少[45]。感染Strongyloidesvenezuelensis的宿主山羊胃肠道中具有免疫调节作用的拟杆菌属(Bacteroides)和CandidatusArthromitus的数量增加,Bacteroides影响宿主的免疫系统并控制其他(竞争的)病原体繁殖,CandidatusArthromitus是诱导免疫细胞分化的特异性诱导物[52];在Teladorsagiacircumcincta感染的羔羊中发现卟啉单胞菌(Porphyromonas)扩增[45]。如果将宿主GIN驱除后,宿主胃肠道微生物群可以恢复到感染前的状态,这表明GIN带来的这些菌群代谢变化是可逆的[52]。
3.2 宿主羊特定氨基酸代谢改变
目前关于GIN影响宿主氨基酸代谢的研究较少,且不多的研究主要集中在对酪氨酸、亮氨酸、苯丙氨酸、缬氨酸、半胱氨酸以及甲硫氨酸代谢的研究上[53]。通常使用氨基酸的不可逆损失率(irreversible loss rate,ILR)进行宿主氨基酸代谢的定量研究,当感染和未感染的动物的营养摄入量控制在相同水平,ILR表示从胃肠道吸收和机体蛋白质分解中吸收的氨基酸,即该氨基酸的利用率[54]。感染Trichostrongyluscolubriformis的绵羊小肠中酪氨酸[24]、缬氨酸[55]以及苯丙氨酸[56]的ILR与未感染的绵羊相比无明显变化,但是蛋氨酸[55]和半胱氨酸[7]的ILR下降了13%~15%。另外,Yu等[23]通过同位素示踪法发现,绵羊感染Trichostrongyluscolubriformis后第5、7、11、13周,整个肠道的亮氨酸吸收增加24%,但在感染后18~20周,整个肠道的亮氨酸吸收增加消失,这可能是由于免疫反应在感染的不同时期有所不同,说明GIN对宿主氨基酸代谢的影响会随感染时期的变化而改变。Bermingham等[57]的研究也证明GIN感染对宿主氨基酸代谢的影响随感染时期的变化而有所不同。GIN在感染的不同阶段的确存在不同的基因转录和表达模式,对各自阶段的能量、氨基酸、氮、脂肪酸代谢产生显著影响。例如,幼虫的有氧代谢依赖于有效的三羧酸循环,而成虫的无氧代谢主要依赖糖酵解[58]以及L4期幼虫向成虫的转变伴随着氨基酸代谢的增加[59]等。
已有研究表明在与免疫相关的反应中半胱氨酸的需求很高,这可能是因为半胱氨酸是黏蛋白的主要成分之一(占4%~9%),比整个机体组织蛋白质的半胱氨酸含量高2~4倍(羊毛除外)。半胱氨酸通常用于合成急性反应蛋白、白蛋白以及谷胱甘肽,并且半胱氨酸和谷胱甘肽是一些细胞因子的合成底物[25]。每天向被GIN感染的绵羊饲粮中添加2 g半胱氨酸,可增加嗜酸性粒细胞以及皱胃球状白细胞的数量,表明额外添加半胱氨酸可以提高宿主羊的免疫能力并达到驱虫作用[60]。绵羊感染GIN后,空肠、肝脏和皮肤的亚精胺和精胺含量增加[61],表明甲硫氨酸需求增加,甲硫氨酸的需求增加归因于甲硫氨酸向半胱氨酸的转化增加,支持了感染期间宿主的高半胱氨酸需求[25]。另外,参与免疫反应的其他氨基酸,如精氨酸(通过精氨酸酶和一氧化氮2条途径参加免疫反应)、色氨酸(参与蛋白质及核酸合成,维持动物体内细胞活化和增殖)、甘氨酸(一种神经递质)以及谷氨酰胺(机体内重要运载工具)等氨基酸也值得关注。
GIN在每一个发育阶段都会产生一个新的角质层(鞘),在发育过程中,需要前一阶段的鞘脱落,并在蜕皮过程中被新的鞘取代,整个线虫的生命周期中,共需脱鞘5次。胶原蛋白和类胶原蛋白占线虫表皮总蛋白质的80%,构成表皮结构成分的绝大部分,胶原蛋白由Gly-X-Y基序(其中Gly为甘氨酸,X和Y通常分别为脯氨酸和羟脯氨酸)组成[62],因此脯氨酸在GIN感染期间的需求增加。另外,氨基酸可能参与了寄生虫细胞内渗透压的调节,将寄生虫从宿主体内移走并在体外培养时,其渗透平衡被破坏,很可能导致氨基酸泄漏,特别是脯氨酸[63]。寄生虫向体外排泄氨基酸可能起到信号传导作用,例如,曼氏血吸虫释放精氨酸主要是刺激附着反应的发生[63],植物线虫通过排泄蛋白质与宿主相互作用[64]。除此之外,Chi等[65]的研究显示,在片形吸虫感染期间,宿主的脯氨酸分解代谢受损。因此,在研究GIN参与宿主绵羊的氨基酸代谢的过程中宿主脯氨酸代谢值得关注。
4 小 结
综上所述,GIN对宿主蛋白质和氨基酸代谢产生了很大的影响。一方面,GIN感染导致宿主羊采食行为改变,进而导致宿主利用的外源氨基酸含量减少;另一方面,GIN通过改变用于宿主羊生产性能、胃肠道黏膜修复、免疫反应的蛋白质分配,最终导致宿主羊胃肠道微生物蛋白质代谢乃至宿主羊全身蛋白质代谢改变。但目前GIN改变宿主氨基酸代谢的确切机制尚不清楚,有必要应用多技术手段,联合分析感染GIN情况下,宿主蛋白质和氨基酸代谢变化与微生物组、代谢组和转录组的变化及其信号通路与调控因子的变化的关联机制。

