复方苦参注射液治疗急性出血重症放射性肠炎大鼠的实验研究∗
许文婧 马玥诗 王 佩 高丽萍 杨志祥 孟令占
(重庆市中医院,重庆 400021)
放射治疗是恶性肿瘤治疗过程中的重要手段[1],而放射性肠炎(RE)也成为最常见的并发症之一,发病率大约5%~20%[2],其中小肠对放射耐受量较低,在100 cc范围内总受照射≥4 500 cGy,或最大剂量点剂量>5 000 cGy以上,5年内有约5%的患者发生小肠溃疡、狭窄、出血等严重不良反应,甚至威胁生命[3],这也大大影响了肠癌等盆腔肿瘤放疗剂量的给予和疗效。对于3级及以上的放射性肠炎,特别是严重的溃疡或出血,当前西医治疗并没有特效手段,治疗后症状容易反复。中医学认为放疗为外邪,其本质为“火、热、毒、邪”,故治疗多以扶正祛邪为主,其中以解毒、利湿、活血为要[4]。而复方苦参注射液是一种具有清热利湿、凉血止痛功效的中成药,临床已经广泛用于肿瘤引起的疼痛和出血。笔者通过临床观察发现,在部分患者的盆腔放疗过程中使用复方苦参注射液能有效改善放射性肠炎导致的便血。因此,本实验建立了大鼠急性出血重症放射性肠炎模型,希望能进一步发现复方苦参注射液在这类严重放疗不良反应中的治疗作用和机制。
1 材料与方法
1.1 实验动物 健康SD雌性大鼠购自湖南斯莱克实验动物有限公司,许可证号:SCXK(湘)2019-0004,共24只,7~8周龄,体质量180~200 g,喂养于重庆市中医院SPF级动物实验室环境,温度25℃,湿度50%~55%。各组大鼠按每只每日100 mL纯化水和50 g大鼠灭菌专用饲料(江苏省协同医药生物工程有限责任公司)给予固定饲养。
1.2 试药与仪器 复方苦参注射液由山西振东制药股份有限公司生产,国药准字Z14021230。血管内皮生长因子(VEGF)一抗购自博士德生物工程有限公司。大鼠白细胞介素-6(IL-6)以及肿瘤坏死因子-α(TNF-α)ELISA试剂盒购自北京四正柏生物科技有限公司。转轮式切片机(徕卡-2016,德国);JT-12S自动组织脱水机(武汉俊杰电子有限公司);BMJ-A型包埋机(常州郊区中威电子仪器厂);RS36型全自动染色机(常州派斯杰医疗设备有限公司);PHY-Ⅲ型病理组织漂烘仪(常州市中威电子仪器有限公司);数字切片扫描仪(Pannoramic 250,济南丹吉尔电子有限公司)。济南丹吉尔电子有限公司生产的Pannoramic 250数字切片扫描仪对切片进行图像采集。
1.3 造模与分组 随机将24只SD大鼠随机分为空白组、模型组与治疗组,每组8只。采用直线加速器照射腹部法造模。实验第1天模型组和治疗组用10%水合氯醛0.3 mL/100 g腹腔注射,待大鼠全麻后仰卧位固定上,直线加速器(医科达Synergy)以4 mV X射线,源皮距100 cm,单次30 Gy照射大鼠腹部,照射野即两侧肋弓连线以下至肛门以上的腹部,制备重症血性放射性肠炎动物模型。
1.4 干预方法 照射后24 h,予以空白组、模型组以0.9%氯化钠注射液2 mL腹腔注射,每日1次,连续14 d。治疗组大鼠以0.3 mL/100 g复方苦参注射液原液加生理盐水稀释成2 mL后腹腔注射,每日1次,连续给药14 d。在前期预实验中,参考临床常规成人药物用量,采用低、中、高3种剂量腹腔注射复方苦参注射液,发现中剂量组(符合成人临床使用的常规剂量)不增加大鼠死亡率,在有效的基础上亦不对大鼠腹膜产生强烈刺激。因此采用中剂量(0.3 mL/100 g)作为最终治疗剂量。
1.5 标本采集与检测 观察大鼠的大便形状、体质量、精神状态、毛发、饮水和饲料消耗量,及时记录大鼠死亡情况并及时解剖,记录死亡原因。于最后一次给药后24 h,采用颈椎脱臼法处死大鼠,并剖腹取出与盲肠交界处以上2 cm的小肠,用4℃磷酸盐缓冲液(PBS)冲洗至无粪便残留,剪切约为0.5 cm小段数段,分别置于10%甲醛中固定,以及-80℃冰箱冻存备用。将空白组、治疗组随机选取的标本以及模型组部分肠道标本(每组n=3)在固定24 h后,常规梯度酒精脱水、二甲苯透明、石蜡包埋、组织切片及常规HE染色,并对组织切片进行VEGF免疫组化染色。观察肠道黏膜绒毛高度和隐窝深度、炎症细胞浸润情况、细胞坏死情况。另剪去0.1 mm大小肠道组织置于电镜固定液中,送陆军军医大学基础实验室做电镜切片和观察。所有组别处死老鼠冻存的肠道组织进行液氮下研磨经行细胞匀浆,细胞匀浆液低温低速离心机3 000 r/min离心10 min后取得上清液,按试剂盒说明书,进行酶联免疫吸附测定(ELISA)法的IL-6、TNF-α测定。
1.6 统计学处理 应用SPSS22.0统计软件。计量资料以(±s)表示,组间比较采用单因素方差分析或重复测量设计的方差分析,用LSD法进一步两两比较,大鼠生存时间使用Kaplan-Meier法进行检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠表征观察情况 空白组大鼠反应灵活,活动良好,体毛光滑,食欲正常,大便正常,体质量增长良好。模型组造模起第2天出现稀便,随后相继出现不同程度的黏液便、脓血便同时伴有食欲减退、懒动、消瘦、毛发凌乱、腹壁毛发污秽等现象,自造模第4天开始出现死亡,结束时共死亡5只,经解剖发现死亡大鼠肠道及肠道系膜广泛充血,肠腔内大量血便。治疗组造模第4天出现不形成大便或软便,但较模型组明显程度轻,伴一定程度的食欲减退、活动下降、体质量减轻、毛色失去光泽、腹壁毛发污秽等现象,但程度较模型组较轻,实验结束时共死亡大鼠2只,经解剖发现肠系膜少许肿胀,无明显肠道出血,但肠道内胀气,内有大量稀水便。空白组、模型组、治疗组在体质量曲线以及生存曲线上表现出的差异具有统计学意义(P<0.05),表明治疗组在体质量以及生存方面更加具有优势。见图1。

图1 各组大鼠体质量曲线及生存曲线
2.2 各组大鼠肠道组织病理形态观察和VEGF染色分析 光镜下(图2)可以发现空白组黏膜层、黏膜下层、肌层及外膜结构较完整;肠绒毛黏膜表面覆单层柱状上皮,黏膜固有层内管状肠腺结构清晰,腺上皮细胞形态正常,小肠腺周围间质内细胞成分较多,偶见少量淋巴细胞和巨噬细胞散在分布;黏膜下层为疏松结缔组织,其内分布血管和神经等;肌层和浆膜层未见明显炎性细胞浸润和增生。模型组的黏膜层、黏膜下层、肌层及外膜结构较完整;但大量肠绒毛脱落,肠绒毛局部不同范围结构模糊,黏膜上皮脱落,固有层结构不清晰,肠腺结构坏死,结构模糊;急性溃疡形成,炎细胞浸润,以淋巴细胞为主;黏膜下层少量炎性细胞浸润和增生。治疗组黏膜层、黏膜下层、肌层及外膜结构较完整;黏膜被覆单层柱状上皮细胞,排列较整齐,绒毛长度变短,隐窝稍浅;黏膜固有层内可见管状肠腺,结缔组织内细胞排列较紧密,轻微炎性浸润及纤维增生;黏膜下层、肌层和浆膜层未见明显炎性细胞浸润和增生;其他未见明显病理改变。电镜下(图3)可以看到,空白组的肠道黏膜细胞绒毛完好,细胞线粒体等细胞器形态好,细胞间连接紧密。模型组的肠道黏膜部分细胞有坏死脱落,绒毛缺失,部分线粒体形成空泡状改变,溶酶体增多,核糖体减少,细胞连接松散。治疗组绒毛形态尚可,线粒体部分肿胀、空泡化,核糖体减少,细胞连接尚完好。

图2 各组大鼠肠道组织光镜图(HE染色,200倍)
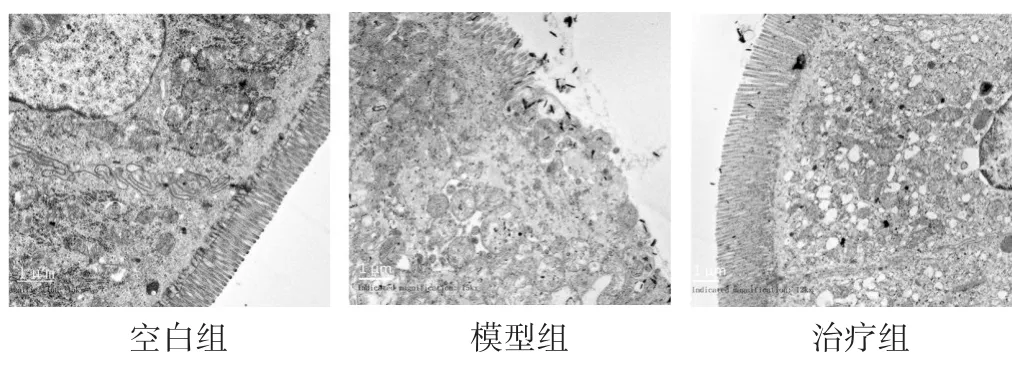
图3 各组大鼠肠道黏膜细胞透射电镜图(1 700倍)
2.3 各组大鼠VEGF表达水平比较 见表1,图4。治疗组大鼠的VEGF表达显著低于模型组,且高于对照组,对染色图像用Image-Pro Plus 6.0进行处理分析VEGF相对表达值,发现模型组与空白组、治疗组比较差异有统计学意义(P<0.05),而空白组与治疗组差异无统计学意义(P>0.05)。
表1 各组大鼠VEGF表达水平较比较(±s)

表1 各组大鼠VEGF表达水平较比较(±s)
注:与模型组比较,∗P<0.05。下同。
组别空白组模型组治疗组n333 VEGF 2.67±1.15*5.67±1.15 3.33±0.58*
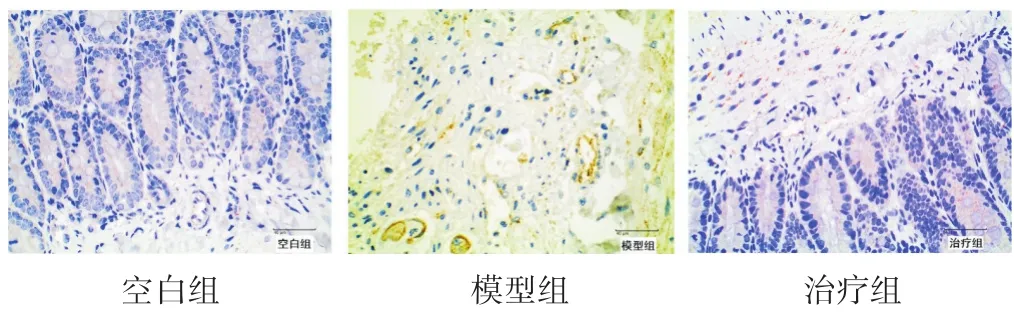
图4 大鼠肠道组织VEGF的表达(免疫组化染色,400倍)
2.4 各组大鼠肠道组织IL-6与TNF-α水平比较 见表2。空白组大鼠小肠黏膜上皮细胞中IL-6水平显著低于模型组及治疗组,而治疗组低于模型组,组间差异均有统计学意义(P<0.05)。模型组大鼠小肠黏膜上皮细胞中TNF-α水平显著高于空白组及治疗组(P<0.05),而空白组与治疗组无显著统计学差异(P>0.05)。
表2 各组大鼠肠道组织IL-6与TNF-α水平比较(pg/mL,±s)

表2 各组大鼠肠道组织IL-6与TNF-α水平比较(pg/mL,±s)
注:与空白组比较,△P<0.05。
组 别n IL-6TNF-α 136.15±18.26*214.34±21.76 162.52±12.58*190.25±21.16 358.27±45.88△256.26±36.09*△3 3 3空白组模型组治疗组
3 讨 论
放射性肠炎被认为是迅速分裂的肠上皮尤其是干细胞,直接暴露在放射线下导致的细胞毒性作用,肠道上皮细胞凋亡脱落,黏膜屏障破坏、肠道运动障碍、细菌异位,Na+/K+泵异常以及微血管内皮损伤[6]。在大鼠放射线肠炎模型中,可以观察到上皮细胞、腺体损伤,大量炎症细胞浸润,血管结构异常,溃疡灶形成,同人类的组织病理学改变几乎完全一致[7],因此鼠的放射性肠炎模型也是研究人类放射病理生理变化的最佳手段之一。本次研究参考了其他重度放射性肠炎动物模型的放射剂量[8],模型组大鼠致死率达到62.5%,与空白组有明显的解剖形态学和镜下病理差异,成功模拟了临床上由于放疗导致的急性出血重症肠炎。同时实验发现复方苦参注射液能明显减轻SD大鼠由于大剂量放疗造成的急性出血重症肠炎,保护肠道黏膜细胞以及结构,明显降低死亡率。
复方苦参注射液由苦参和白土苓提取研制而成,临床研究证实其在抗肿瘤,缓解癌性疼痛、出血,与放化疗联合起到增效减毒等方面均具有积极效果,而苦参与白土苓配伍较单味药应用增强了抗炎、止痛、止血的功效[9]。目前复方苦参注射液在治疗放射性肠炎上也有不少报道。陈延群等发现复方苦参注射液能减轻大鼠急性放射性小肠炎的消化道反应和病理形态学改变,并降低小肠黏膜一氧化氮(NO)浓度,对急性放射性小肠炎有较好的抗感染治疗作用[10]。熊钢等观察到在复方苦参注射液在宫颈癌同步放化疗中,不影响肿瘤的近期疗效且明显减轻由放疗造成的膀胱炎和肠炎反应[11]。
复方苦参注射液因为是中药复方制剂,其作用机制复杂,体现了中药多靶点、多通路、多效应的特色,因此作用机制研究起来相对烦琐和困难。有许多研究者,使用网络药理学结合生物信息学分析,使得研究中药的潜在成分和其作用基因靶点具有了可用的研究策略。例如黄坤等发现复方苦参注射液可能作用机制是通过调节低氧诱导引子(HIF-1)、VEGF、肿瘤坏死因子(TNF)、白细胞介素-17(IL-17)信号通路等,起到改变肿瘤组织微环境,促肿瘤细胞凋亡、抑制其转移,并通过免疫炎症调节杀灭肝癌细胞等作用[12]。还有研究通过目标蛋白相互作用网络(PPI)分析发现,复方苦参注射液的活性成分和抗癌的主要目标蛋白前4位是IL-6、EGFR、CASP3、VEGF[13]。综上可见复方苦参注射液与IL-6、TNF-α以及VEGF通路密切相关。IL-6、TNF-α作为重要的促炎细胞因子,参与了包括放疗炎症在内各的种炎性疾病的发生发展[14]。而VEGF则是参与血管生成以及增加血管通透性最强的因子之一[15],有研究发现在急性脑出血这类出血性疾病中,出血量大、神经功能缺损评分高的患者,其血清VEGF平均水平明显高于出血量小、神经功能缺损评分低的患者。亦有研究提示血清中VEGF浓度升高与病情严重程度有一定的关系[16]。本研究发现模型组IL-6、TNF-α以及VEGF的表达明显较空白组升高,而治疗组的IL-6、TNF-α以及VEGF对比模型组有明显的下降,提示复方苦参注射液能起到减轻放射性炎症反应以及控制出血的作用。
综上所述,本研究发现复方苦参注射液能降低大鼠重症出血放射性肠炎的大量腹泻、消瘦、便血等症状以及大鼠死亡率,机制与减轻炎症介质有关。推测在临床放疗实践中使用复方苦参注射液可以降低由于放疗损伤导致肠炎以及继发的营养障碍、出血甚至死亡等严重不良事件的风险,并可能减少需要输血、手术肠道切除等事件的概率,特别是针对那些病灶本来就侵犯或邻近肠道,肠道受量相对较高,以及体弱、有出血倾向的患者。期望在以后的研究中能进一步揭示复方苦参注射液的作用机制,为扩展其临床应用提供理论依据,并为重症出血性放射性肠炎提供新的辅助治疗手段。

