麻黄细辛附子汤拆方干预CD4+T细胞调控相关细胞因子分泌及STAT6 mRNA表达的研究∗
张 艺 李廖英子 韩爱庆 吴璐蔚 孙彤彤 范淑月 倪钰莹 刘 敏
(北京中医药大学,北京 100029)
T细胞作为机体适应性免疫重要的参与细胞,在抗原提呈细胞的作用下激活,并向Th2方向分化,进而产生白细胞介素-4(IL-4)、白细胞介素-5(IL-5)、白细胞介素-13(IL-13)等Th2型细胞因子并作用于下游细胞,引起嗜酸性粒细胞等炎症细胞聚集在患部,出现炎症反应。本课题组前期研究发现,麻黄细辛附子汤可升高T-bet mRNA/GATA-3 mRNA比值,并在体外能促进活化的T细胞增殖并抑制向Th2细胞的分化[1]。麻黄细辛附子汤能够调控树突状细胞IL-4/STAT6通路,降低IL-4、IL-13含量,抑制IL-4 mRNA、STAT6 mRNA的表达,从而调节Th1/Th2失衡[2]。此外,对于经胸腺基质淋巴生成素(TSLP)刺激的树突状细胞,麻黄细辛附子汤能升高干扰素-γ(IFN-γ)mRNA,下调IL-4 mRNA的表达,同时抑制IL-13,促进IFN-γ的分泌,恢复Th1/Th2失衡[3]。刘书宇等[4]亦从细胞因子失衡的角度研究,发现此方通过使IFN-γ含量升高,IL-13含量降低来纠正体内Th1和Th2表达失衡从而抑制炎症。本次实验中,在体外培养的CD4+T细胞中加入抗IFN-γ抑制T细胞向Th1方向的分化,重点从影响Th2细胞分化及 IL-4、IL-5、白细胞介素-10(IL-10)、IL-13、白细胞介素-17A(IL-17A)与STAT6 mRNA表达角度观察各给药组干预情况。现将结果报告如下。
1 材料与方法
1.1 实验动物
C57BL/6雌性小鼠4周龄,SPF级,体质量(25±5)g,购于北京斯贝福生物技术有限公司,许可证号:SCXK(京)2016-0002。实验前适应性饲养1周,正常饮食、饮水,温度为(22±2)℃,湿度为(60±5)%。
1.2 试药与仪器
实验所用麻黄、细辛、附子3味中药均购自北京中医药大学国医堂。CytoBox Th2 mouse(编号:130-107-760,Miltenyi),T Cell Activation/Expansion Kit mouse(编号:130-093-627,Miltenyi),MACS Smart Strainer 70 μm(编号:130-098-462,Miltenyi),Spleen Dissocia⁃tion Kit mouse(编号:130-095-926,Miltenyi),Gentle MACS 25 C Tubes(编号:130-093-237,Miltenyi),APC anti-mouse CD3(编号:100236,Miltenyi),流式多因子检测试剂盒[编号:A211164(IL-5)、A211128(IL-13)、A211119(IL-10)、A211134(IL-25)、P200201(Basic kit),Miltenyi],胎牛血清(编号:备 10099141,Invitro⁃gen),RPMI Medium 1640(编号:备 11875093,Invitro⁃gen),青链霉素(编号:备15140122,Invitrogen),红细胞裂解液(编号:R1010,Invitrogen),75%医用酒精(编号:SDT-0025),CCK8试剂盒(编号:DE5001-500T,BIODEE),IL-4检测试剂盒(编号:KE10010-48T,pro⁃teintech),总RNA提取试剂盒(编号:R1200,索莱宝),反转录试剂盒(编号:RP1105,索莱宝),Realtime PCR荧光定量试剂盒(编号:RP1110,索莱宝)。组织破碎仪(BSH-CL2,lifereal),微量取液器(eppendorf,量程:10 μL、100 μL、200 μL、1 000 μL),高压蒸汽灭菌锅(MLS-3020,SANYO),离心机(5810,eppendorf),漩涡震荡仪(QL-901,其林贝尔),流式细胞仪(Cantoll,BD Biosciences),CO2培养箱(311,Thermo),倒置显微镜(TE2000-S,Nikom),多功能酶标仪(Safire2,Tecan)。
1.3 细胞分选与培养
无菌取正常小鼠脾组织边研磨边加入PBS溶液冲洗细胞混悬液至EP管中,离心并收集细胞悬液,加入红细胞裂解液裂解红细胞,清洗干净后用磁珠阴性分选得到CD4+T细胞悬液,取10 μL细胞悬液,PBS稀释1倍后加入20 μL的CD3抗体,4℃反应5 min后立即做流式检测分选出的T细胞纯度。将剩余细胞重悬于含白细胞介素-2(IL-2)、抗IFN-γ的10%完全培养基中,并用装载有CD3、CD28抗体的抗生物素MACSIBeadTM颗粒刺激T细胞增殖活化,按2×106个/3 mL的密度接种于24孔板中,37℃、5% CO2条件下培养,每3.5天换液1次,第4天收集细胞备用。
1.4 药物制备与筛选
1)中药水提液制备:以麻黄6 g,细辛3 g,附子9 g配比称量,并分为全方组、麻辛组、麻附组、辛附组、麻黄组、细辛组、附子组7个组,用纯净水煎成终质量浓度为1 g/mL的浓缩液,4 ℃,12 000 r/min,30 min/次,离心2次。分别收集上清液,0.22 μm细菌滤器分别过滤后立即分装,-20℃保存备用。2)CCK8筛选各组中药最适质量浓度:收集24孔板中细胞,调整细胞浓度为每孔2 000个/100 μL,加入96孔板中,将中药液按10倍稀释浓度等比稀释成7个不同浓度,按顺序加入96孔板中,每孔10 μL,将培养板置于CO2培养箱各培养6、12、18、24 h后,每个孔加入10 μL的CCK8溶液,2 h后于酶标仪450 nm波长处读取OD值,根据结果,最终确定附子组中药液的质量浓度为0.02 g/mL,其余组均为0.2 g/mL。
1.5 分组与给药
本次实验设计对照组、全方组、麻辛组、麻附组、辛附组、麻黄组、细辛组、附子组共8个组,各给药组除给药外,其余条件与对照组相同,干预18 h后进行各项指标检测。
1.6 指标检测
1.6.1 ELISA法检测上清液中IL-4含量 于18 h收集各组细胞上清液,应用小鼠IL-4酶联免疫试剂盒,按照说明书步骤检测各组上清液中IL-4的浓度。
1.6.2 流式细胞术检测上清液中IL-5、IL-10、IL-13、IL-17A的含量 于18 h收集各组细胞上清液,按照Aimplex流式高通量多因子检测技术检测各组细胞上清液中IL-5、IL-10、IL-13、IL-17A的含量。
1.6.3 实时荧光定量PCR法检测STAT6 mRNA含量氯仿提取细胞总RNA,并检测总RNA浓度,应用逆转录试剂盒反转录成cDNA,加入相应引物按照试剂盒说明书步骤用PCR仪进行PCR扩增,计算各组2-ΔΔCt值,求得STAT6 mRNA表达量,STAT6、GAPDH的引物序列如表1。
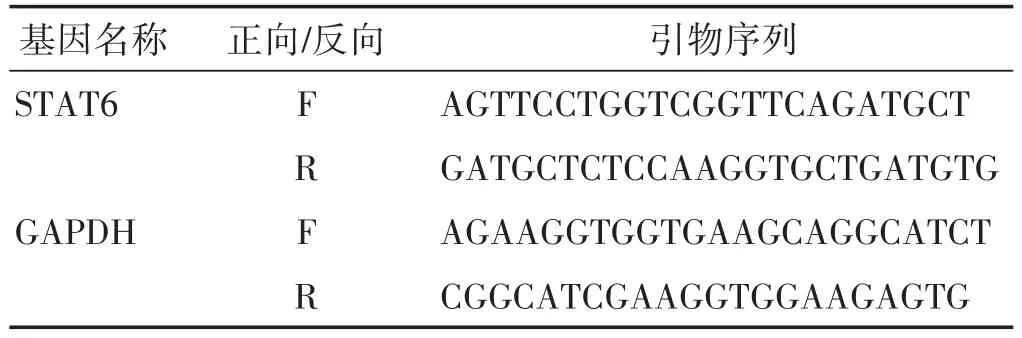
表1 PCR引物序列
1.7 统计学处理
2 结果
2.1 T细胞磁珠分选纯度检测结果、细胞培养状态及CCK8检测结果
磁珠阴性分选成功分离出T细胞,加入CD3抗体后流式检测T细胞纯度为96.7%,如图1所示;装载CD3、CD28抗体的抗生物素MACSIBeadTM颗粒(体积较小、偏黄亮)成功诱导T细胞(体积较大)增殖,并在第4天达到高峰,如图2所示;CCK8筛选出各组中药最适质量浓度:除附子组的最佳药物质量浓度为0.02 g/mL外,其余各组最佳质量浓度均为0.2 g/mL,如图3所示。
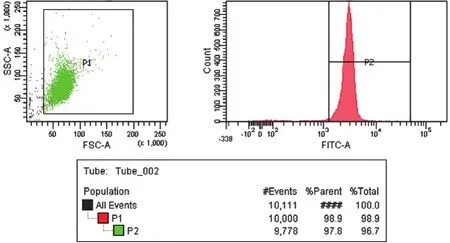
图1 细胞磁珠分选纯度图
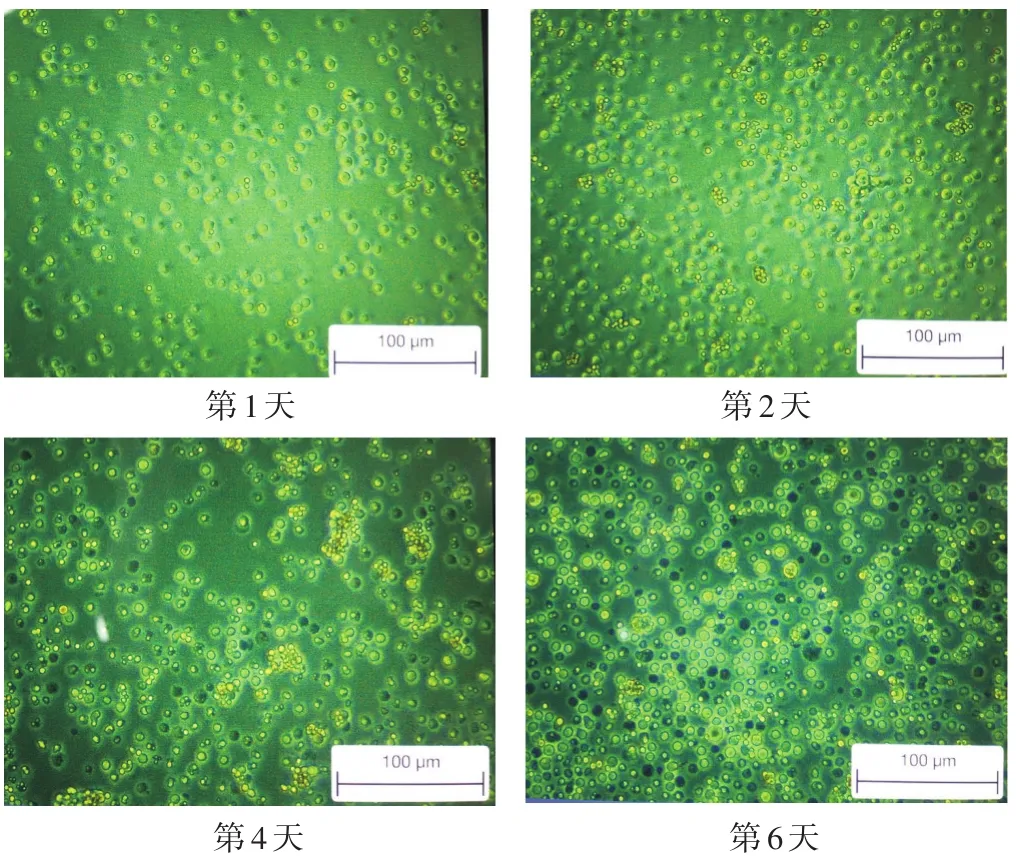
图2 细胞培养状态图(100倍)
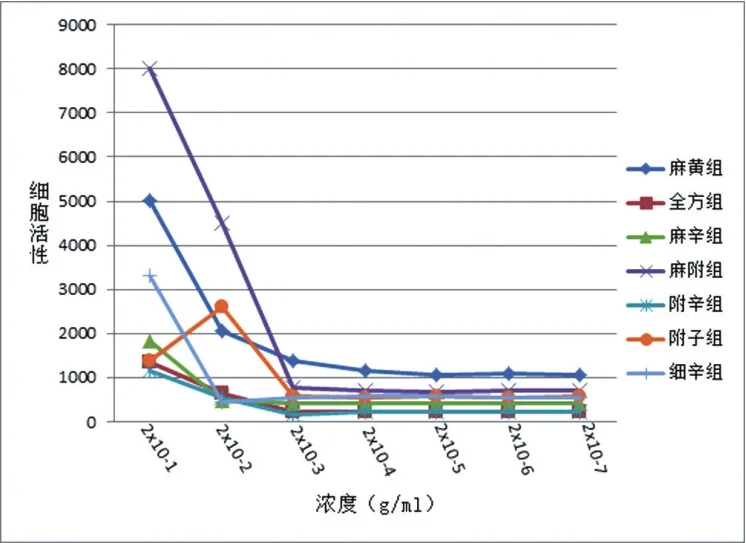
图3 各组细胞CCK8结果图
2.2 各组细胞上清液中IL-4、IL-5、IL-10、IL-13、IL-17A的含量比较
见表2。1)IL-4:较之对照组,辛附组、细辛组、附子组有降低趋势,但无明显差异(P>0.05),全方组、麻附组则含量升高(均P<0.05),其中麻黄组显著升高(P<0.001),如图4所示。2)IL-5:与对照组比较,全方组含量有降低趋势,但差异无统计学意义(P>0.05),而辛附组含量则明显升高(P<0.05)。3)IL-17A:与对照组相比,全方组显著降低(P<0.01),而麻辛组含量明显升高(P<0.05)。与全方组相比,麻附组、辛附组、麻黄组、细辛组、附子组含量均显著升高(均P<0.01)。4)各给药组IL-10、IL-13的含量较之对照组差异无统计学意义(P>0.05)。
表2 各组细胞上清液中IL-4、IL-5、IL-10、IL-13、IL-17A的含量比较(pg/mL,±s)
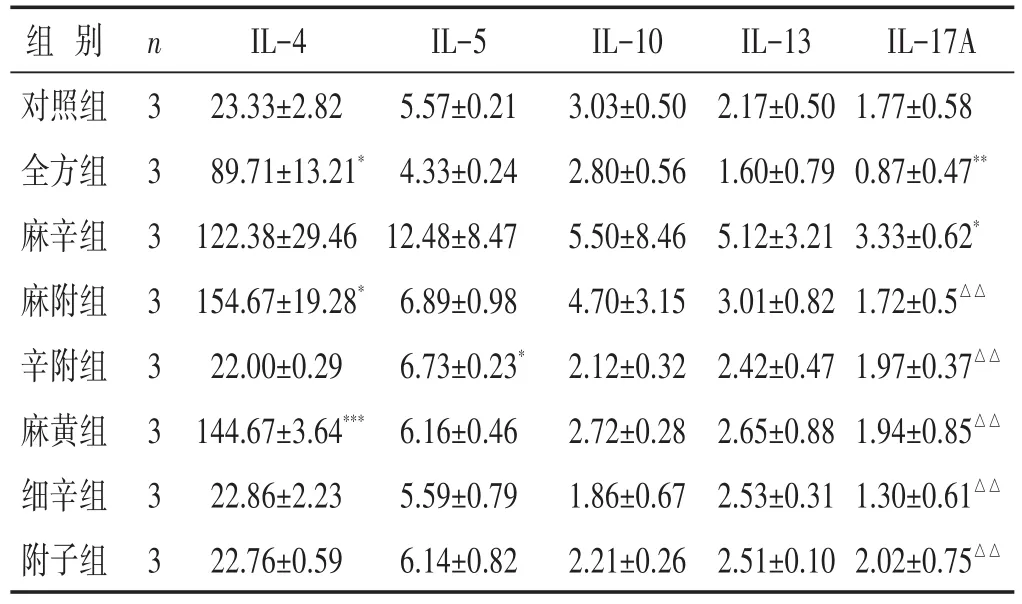
表2 各组细胞上清液中IL-4、IL-5、IL-10、IL-13、IL-17A的含量比较(pg/mL,±s)
注:与对照组比较,∗P<0.05,∗∗P<0.01,∗∗∗P<0.001;与全方组比较,△P<0.05,△△P<0.01。下同。
组别对照组全方组麻辛组麻附组辛附组麻黄组细辛组附子组n 3 3 3 3 3 3 3 3 IL-4 23.33±2.82 89.71±13.21*122.38±29.46 154.67±19.28*22.00±0.29 144.67±3.64***22.86±2.23 22.76±0.59 IL-5 5.57±0.21 4.33±0.24 12.48±8.47 6.89±0.98 6.73±0.23*6.16±0.46 5.59±0.79 6.14±0.82 IL-10 3.03±0.50 2.80±0.56 5.50±8.46 4.70±3.15 2.12±0.32 2.72±0.28 1.86±0.67 2.21±0.26 IL-13 2.17±0.50 1.60±0.79 5.12±3.21 3.01±0.82 2.42±0.47 2.65±0.88 2.53±0.31 2.51±0.10 IL-17A 1.77±0.58 0.87±0.47**3.33±0.62*1.72±0.5△△1.97±0.37△△1.94±0.85△△1.30±0.61△△2.02±0.75△△
2.3 各组T细胞STAT6 mRNA的表达水平比较
见表3。较之对照组,附子组含量降低(P<0.05),尤以辛附组、细辛组明显(P<0.01或P<0.001);全方组、麻附组含量则升高(P<0.05),麻辛组尤为明显(P<0.01),如表2、图6所示。
表3 各组T细胞STAT6 mRNA表达水平比较(±s)
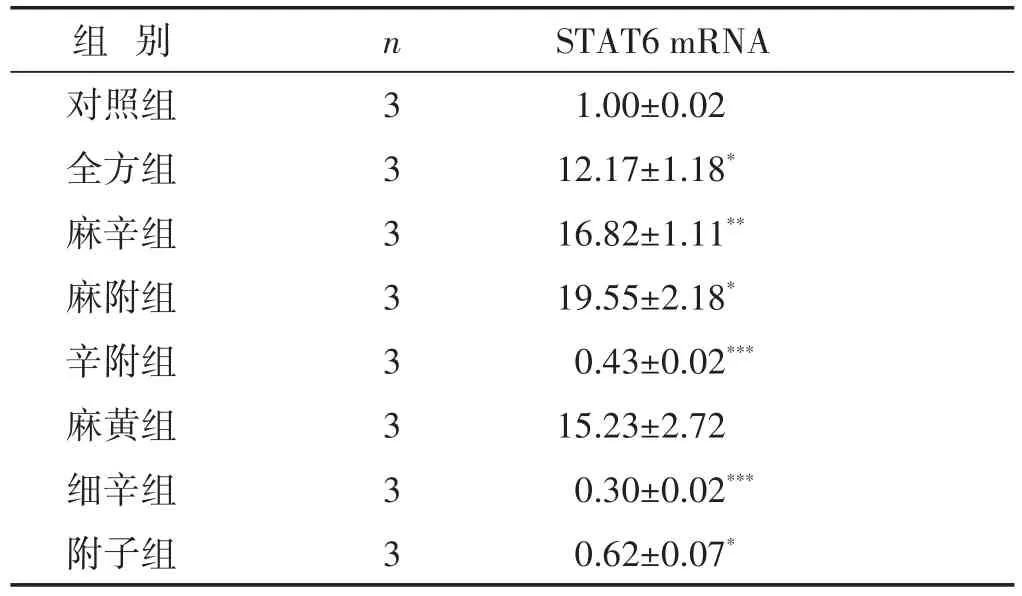
表3 各组T细胞STAT6 mRNA表达水平比较(±s)
组别对照组全方组麻辛组麻附组辛附组麻黄组细辛组附子组n33333333 STAT6 mRNA 1.00±0.02 12.17±1.18*16.82±1.11**19.55±2.18*0.43±0.02***15.23±2.72 0.30±0.02***0.62±0.07*
3 讨 论
IL-4主要由Th2细胞分泌产生,是T细胞诱导炎症反应早期启动因素,可促进IgE合成,增加炎症细胞的聚集、活化[5-6],对B细胞、T细胞、肥大细胞、巨噬细胞等多种细胞都具有免疫调节作用,作用范围广泛。本实验中,各给药组未见有明显降低IL-4的趋势,相反,全方组、麻附组、麻黄组IL-4显著升高,表明麻黄细辛附子汤(0.2 g/mL)可能有促进T细胞向Th2细胞分化,进而促进IL-4分泌的作用,基于本课题组前期关于麻黄细辛附子汤(0.002 g/mL)可抑制IL-4的分泌,从而抑制T细胞向Th2细胞分化的研究[7],因此在相对细胞毒性都较低的情况下,由对IL-4分泌的影响推测,当给药浓度差异很大时,可能存在对T细胞向Th2细胞分化的双向调节作用,此外,由各给药组对比得出,在一定程度上麻黄可拮抗细辛、附子的作用,表明不同药物配伍可能也会影响T细胞分化,从而影响IL-4分泌。
IL-5主要由活化的Th2细胞和肥大细胞产生,其作用尤以反应后期,嗜酸性粒细胞的活化、黏附、滚动等活动为体现[8]。麻黄细辛附子汤有降低IL-5趋势,但未见明显差异,而辛附组IL-5含量升高表明麻黄协同细辛、附子增加麻黄细辛附子汤对IL-5的抑制作用。IL-10是一种负性调节因子,可由Th2细胞产生,参与免疫细胞、炎症细胞等多种细胞的生物调节[9]。IL-13亦属于Th2型细胞因子,可促进趋化因子过度表达,促进嗜酸性粒细胞活化、增殖[10]。对于IL-10、IL-13,各给药组未能有效干预,其结果没有统计学差异,表明麻黄细辛附子汤在IL-10、IL-13环节作用较弱。IL-17A是一种促炎细胞因子,是IL-17家族(IL-17A-F)中的一员,主要由Th17细胞分泌产生,并参与许多由T细胞驱动的炎症,在自身免疫性炎症中发挥作用[11]。本研究中,只有麻黄细辛附子汤全方组显著降低了IL-17A的产生,说明全方配伍能通过有效抑制IL-17A的分泌发挥其免疫调控作用,具有拆方不具有的优势,其中,附子对全方来说,在IL-17A环节有举足轻重的作用,可逆转麻辛组对IL-17A的升高作用。有研究发现,IL-23能诱导效应和记忆型CD4+T细胞产生IL-17[12],并与慢性炎症的发生有着很大联系,表明麻黄细辛附子汤可能在慢性炎症中发挥治疗作用。
STAT6是胞质蛋白家族STAT1-6中的一员,具有信号传导与转录活化的作用[13-14],IL-4可激活STAT6,活化后的STAT6又可进一步促进IL-4分泌,是诱导Th2型免疫反应的关键转录因子[15-17]。本实验通过检测各组STAT6 mRNA表达,发现附子、辛附、细辛3组STAT6 mRNA含量降低,尤以辛附组、细辛组效果显著,而全方、麻附、麻辛3组含量不降反升,与IL-4结果类似,与前期研究结果相反,从基因层面再一次印证麻黄细辛附子汤给药浓度不同,可能对STAT6 mRNA以及T细胞的分化有双向调节的作用,同时,从拆方角度看,表明细辛或辛附配伍在降低STAT6 mRNA表达方面具有明显优势,可能通过抑制STAT6 mRNA表达,从而间接抑制IL-4的分泌,而麻黄的加入则明显减弱该环节,与上述IL-4结果相符。
综上所述,基于本研究,首先,麻黄细辛附子汤对于慢性炎症反应可能会有一定作用;其次,推测麻黄细辛附子汤可能主要在免疫反应的初、中期参与炎症的调节,对于IL-5、IL-13等作用于迟发相反应阶段的因子效果并不显著;最后,细胞之间、细胞与细胞因子之间的作用是一个网络,麻黄细辛附子汤作用于细胞也是一个多靶点、多方向调节的结果,给药浓度、不同药物配伍均会影响作用的结果,对于临床指导用药也需关注药量、配伍的重要性。同时,使我们思考中药对于机体免疫的调节并非一味抑制免疫细胞或细胞因子来抑制炎症的发生,而是更多地通过调节免疫平衡来恢复机体自身的调节。

